1000 câu hỏi ôn tập môn Hóa có đáp án (Phần 24)
Bộ 1000 câu hỏi ôn tập môn Hóa có đáp án Phần 24 hay nhất được biên soạn và chọn lọc giúp bạn ôn luyện và đạt kết quả cao trong bài thi môn Hóa.
1000 câu hỏi ôn tập Hóa (Phần 24)
Câu 1: Khi cho NH3 dư tác dụng với Cl2 thu được?
Lời giải:
Đầu tiên xảy ra phản ứng:
2NH3 + 3Cl2 → N2 + 6HCl
Sau đó, vì dư amoniac nên:
NH3 + HCl → NH4Cl
Vậy các chất thu được là NH4Cl, N2 và NH3 dư nếu có.
Câu 2: Khi cho thanh Fe (dư) vào 200 ml dung dịch CuSO4 nồng độ x (M). Sau khi phản ứng xảy ra hoàn toàn, thấy khối lượng chất rắn tăng 0,8 gam so với ban đầu. Giá trị của x là:
A: 2;
B: 1;
C: 1,5;
D: 0,5.
Lời giải:
Đáp án đúng là: D
Fe + CuSO4 → FeSO4 + Cu
a…………………………a (mol)
mchất rắn tăng = mCu – mFe = 64a – 56a = 0,8 → a = 0,1
→x=0,10,2=0,5(M)
Câu 3: Khi đốt dây sắt, sắt phản ứng cháy với oxi theo phương trình:
3Fe+2O2→t°.Tính thể tích O2 (đktc) cần dùng để phản ứng hoàn toàn với 16,8 gam Fe?
Lời giải:
PTHH:
Ta có:
Theo PTHH:
Vậy thể tích khí oxi ở đktc cần dùng là 4,48 (l).
Nước vôi trong tác dụng với khí cacbonic có trong không khí tạo thành canxi cacbonat không tan trong nước, do đó khi để lâu trong không khí thì bề mặt dung dịch nước vôi trong sẽ có một lớp váng màu trắng.
PTHH: CO2 + Ca(OH)2 → CaCO3↓ + H2O
Lời giải:
Gọi CTTQ của A là CxHyOzNt
có:
Ta có :
Vậy CT của A là C2H5OzN
mà MA = 12.2 + 5 + 16z + 14 = 59
⇒z = 1
Vật CTPT của A là C2H5ON.
b. Viết CTCT có thể có và đọc tên theo IUPAC
Lời giải:
Gọi số mol của CO2 và H2O lần lượt là x và y mol.
Ta có: gam → 44x − 18y = 3,36 (1)
Bảo toàn nguyên tố C, H:
Từ (1) và (2) suy ra: x = 0,15; y = 0,18
Số C
Số H
CTPT: C5H12
b. CTCT:
CH3 − CH2 − CH2 − CH2 − CH3: n−pentan
CH3 − CH(CH3) – CH2 – CH3: 2−metylbutan
CH3 − C(CH3)2 − CH3: 2,2− đimetylpropan
A. 1,2 g.
B. 4,25 g.
C. 1,88 g .
D. 2,52 g.
Lời giải:
Đáp án đúng là: A
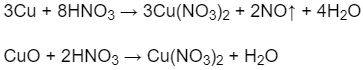
Số mol khí NO:
![]()
Theo phản ứng (1) số mol Cu:
![]()
Khối lượng Cu trong hỗn hợp ban đầu: mCu = 0,45.64 = 28,8 (g).
Khối lượng CuO trong hỗn hợp ban đầu: mCuO = 30 - 28,8 = 1,2 (g).
Câu 8: Khi nào phản ứng hoá học cần có nhiệt độ?
Lời giải:
Các phản ứng thu nhiệt là các phản ứng cần thêm nhiệt độ t0.
Ngoài ra nhiệt độ là một động lực thúc đẩy tốc độ phản ứng diễn ra nhanh hơn.
Các phản ứng giữa kim loại với phi kim, phi kim với phi kim và phản ứng phân hủy thường cần thêm nhiệt độ vào phản ứng. (ngoài ra còn một số phản ứng tổng hợp hữu cơ)
VD:
Kim loại với phi kim:
Phi kim với phi kim:
Phân hủy:
Phản ứng hữu cơ:
Câu 9: Nhiệt phân Cu(NO3)2. Phần trăm thể tích NO2 trong hỗn hợp khí thu được là?
Lời giải:
Gọi
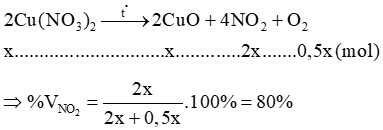
Câu 10: Nung nóng 11,28 gam Cu(NO3)2 một thời gian thu được 6,96 gam chất rắn
b) Hấp thụ toàn bộ lượng khí vào 120 gam H2O được dung dịch X. Tính C% của dd X?
Lời giải:
Gọi x là số mol Cu(NO3)2 phản ứng
⇒mrắn = 11,28 − 188x + 80x = 6,96
⇒x = 0,04 (mol)
b,
Theo PTHH:
mdd = 120 + 3,68 = 123,68 (g)
Lời giải:
Quặng: Cu(OH)2.CuCO3
Áp dụng định luật bảo toàn khối lượng:
b) mquặng = = 6 + 0,9 + 2,2 = 9,1 (g)
Câu 12: Khi thủy phân este HCOOCH2CH=CH2 bằng kiềm ta được:
D. 1 muối và 1 ancol.
Lời giải:
Đáp án đúng là: D
Sản phẩm thuỷ phân bằng NaOH: HCOONa (muối), CH2=CHCH2OH (ancol)
OH không gắn vào cacbon không no nên sản phẩm là ancol, không chuyển thành anđehit, xeton.
B. 9;
C. 12;
D. 12,3.
Lời giải:
Đáp án đúng là: C
Gọi V1 = V2 = 1 thì sau khi trộn: n(HNO3) = 0,01 và n(NaOH) =0,03
Axit + Bazo theo tỉ lệ 1:1 nên NaOH dư = 0,02 mol
Vậy [OH- ] dư =0,02 : 2 =0,01 suy ra p[OH] = - log(0,01) = 2
Như vậy pH = 14 - 2 = 12.
Lời giải:
Ta có:
Gọi a là số mol của Cu và b là số mol của Al.
Ta có các quá trình:
Theo đề bài ta có hệ phương trình:
%mAl = 100% - 78,05% = 21,95%.
Xem thêm các câu hỏi ôn tập Hóa học chọn lọc, hay khác:
1000 câu hỏi ôn tập môn Hóa có đáp án (Phần 19)
1000 câu hỏi ôn tập môn Hóa có đáp án (Phần 20)
1000 câu hỏi ôn tập môn Hóa có đáp án (Phần 21)
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)
