1000 câu hỏi ôn tập môn Hóa có đáp án (Phần 16)
Bộ 1000 câu hỏi ôn tập môn Hóa có đáp án Phần 16 hay nhất được biên soạn và chọn lọc giúp bạn ôn luyện và đạt kết quả cao trong bài thi môn Hóa.
1000 câu hỏi ôn tập Hóa (Phần 16)
Câu 1: Cho các chất có CTHH sau: CO2, CaO, SO2, NaCl, NaOH, Cu(OH)2, HCl, H2SO4, NaHCO3, Ba(OH)2, Ca(H2PO4)2, Fe(OH)2, BaSO4, CuO, H2S.
Lời giải:
|
CTHH |
Phân loại |
Gọi tên |
|
CO2 |
Oxit axit (Acidic oxide) |
Cacbon đioxit (Carbon dioxide) |
|
CaO |
Oxit bazơ (Basic oxide) |
Canxi oxit (Calcium oxide) |
|
SO2 |
Oxit axit (Acidic oxide) |
Lưu huỳnh đioxit (Sulfur dioxide) |
|
NaCl |
Muối |
Natri clorua (Sodium chloride) |
|
NaOH |
Bazơ (Base) |
Natri hiđroxit (Sodium hydroxide) |
|
Cu(OH)2 |
Bazơ (Base) |
Đồng(II) hiđroxit (Copper(II) hydroxide) |
|
HCl |
Axit (Acid) |
Axit clohiđric (Hydrochloric acid) |
|
H2SO4 |
Axit (Acid) |
Axit sunfuric (Sulfuric acid) |
|
NaHCO3 |
Muối |
Natri hiđrocacbonat (Sodium hydrogencarbonate) |
|
Ba(OH)2 |
Bazơ (Base) |
Bari hiđroxit (Barium hydroxide) |
|
Ca(H2PO4)2 |
Muối |
Canxi đihiđrophotphat (Calcium dihydrogen phosphate) |
|
Fe(OH)2 |
Bazơ (Base) |
Sắt (II) hiđroxit (iron(II) hydroxide) |
|
BaSO4 |
Muối |
Bari sunfat (Barium sulfate) |
|
CuO |
Oxit bazơ (Basic oxide) |
Đồng (II) oxit (Copper(II) oxide) |
|
H2S |
Axit (Acid) |
Axit sunfuhiđric (Hydrogensulfide acid) |
Lời giải:
Điều chế được những khí: O2, Cl2, NH3, SO2, SO3, H2, HCl, CO2, H2S
2KMnO4 →t° K2MnO4 + MnO2 + O2
2NH4HCO3 (NH4)2CO3 + CO2 + H2O
2NaHSO3 Na2SO3 + SO2 + H2O
BaS + 2HCl → BaCl2 + H2S
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
H2S + Cl2 → 2HCl + S
NH4HCO3 + Ba(OH)2 → NH3 + BaCO3 + 2H2O
Fe + 2HCl → FeCl2 + H2
H2 + Cl2 2HCl
2SO2 + O2 2SO3
Câu 3: Cho các chất sau NaCl, C2H4, CH3COOH, Ba(OH)2, KNO3. Số chất điện li là?
Lời giải:
Trong các chất: NaCl, C2H4, CH3COOH, Ba(OH)2, KNO3. Số chất điện li là 4.
Chất điện li gồm axit, bazơ, muối. Do đó NaCl, CH3COOH, Ba(OH)2, KNO3 là các chất điện li.
C2H4 là hidrocacbon nên không là chất điện li.
Lời giải:
Những chất có liên kết ion là: NaCl, MgCl2, CaO.
(NaCl) ta có:
(MgCl2) ta có:
(CaO) ta có:
Câu 5: SO2, P2O5, Fe2O3, Na2O, Al, Cu, Na2CO3, BaCl2, H2SO4, NaOH, Fe(OH)3.
Chất nào tác dụng với:
a. Nước
b. Dung dịch KOH
c. Dd H2SO4 loãng
d. Dd CuSO4.
Lời giải:
a) SO2 + H2O → H2SO3
P2O5 + 3H2O → 2H3PO4
Na2O + H2O → 2NaOH
b) SO2 + 2KOH → K2SO3 + H2O
P2O5 + 6KOH → 2K3PO4 + 3H2O
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
2KOH + H2SO4 → K2SO4 + 2H2O
c) Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
Na2O + H2SO4 → Na2SO4 + H2O
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2↑
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
2NaOH + H2SO4 → Na2SO4 + 2H2O
2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O
d) 2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
BaCl2 + CuSO4 → BaSO4↓ + CuCl2
2NaOH + CuSO4 → Cu(OH)2↓ + Na2SO4
Na2O + H2O + CuSO4 → Cu(OH)2↓ + Na2SO4
Lời giải:
P2O5, CO2, SO2 tác dụng với CaO, Na2O.
P2O5 + 3CaO → Ca3(PO4)2
P2O5 + 3Na2O → 2Na3PO4
CO2 + CaO → CaCO3
CO2 + Na2O → Na2CO3
SO2 + CaO → CaSO3
SO2 + Na2O → Na2SO3
A. 12, 20, 30;
B. 8, 16, 24;
C. 5, 13, 31;
D. 9, 17, 25.
Lời giải:
Đáp án đúng là: C
Các nguyên tố có số hiệu nguyên tử là 5, 13, 31 đều thuộc nhóm IIIA
Câu 8: Cho các khí sau bị lẫn hơi nước (khí ẩm): N2, O2, SO2, CO2, NH3. Biết NH3 có tính chất hóa học của bazơ tan. Khí ẩm nào có thể làm khô bằng:
a) H2SO4 đặc.
b) CaO.
Lời giải:
Các khí được chọn phải không có phản ứng với chất làm khô.
a, N2, O2, SO2, CO2.
b, N2, O2, NH3.
A: 4 chất;
B: 3 chất;
C: 2 chất;
D: 5 chất.
Lời giải:
Đáp án đúng là: A
CaCO3; Na2S; Ca3(PO4)2, KNO3 tác dụng được với HCl.
Lời giải:
2Al + 6HCl → 2AlCl3 + 3H2
MgO + 2HCl → MgCl2 + H2O
Fe + 2HCl → FeCl2 + H2
ZnO + 2HCl → ZnCl2 + H2O
Câu 11: Cho dãy biến đổi hóa học sau:
CaCO3 → CaO → Ca(OH)2 → Ca(HCO3)2 → CaCO3 → CO2
Điều nhận định nào sau đây đúng:
A. Có 2 phản ứng oxi hoá – khử;
B. Có 3 phản ứng oxi hoá – khử;
C. Có 4 phản ứng oxi hoá – khử;
D. Không có phản ứng oxi hoá – khử.
Lời giải:
Đáp án đúng là: D
Lời giải:
Khi VY = và ở cùng điều kiện thì nY =
Mà nên
Đặt a, b là số mol CO, CO2 trong Y
X tác dụng với HCl nên X gồm Cu, CuO
Đặt nCuO dư = x (mol)
CuO + 2HCl → CuCl2 + H2O
mddHCl = 80.1,225 = 98 (g)
→ mdd sau = 80x + 98 (g)
→ nCuO phản ứng = nCuO = = 0,1 (mol)
→ mX = 0,1.64 + 0,025.80 = 8,4 (g).
A. 19,7 gam;
B. 41,1 gam;
C. 68,95 gam;
D. 59,1 gam.
Lời giải:
Đáp án đúng là: D
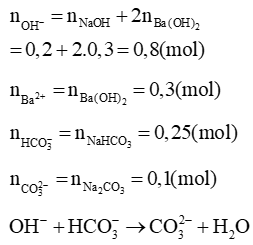
dư, hết
tổng = 0,25 + 0,1 = 0,35 (mol)
dư, hết
Vậy m = 0,3.197 = 59,1 (g)
Câu 14: Dung dịch X chứa 0,01 mol , 0,02 mol , 0,02 mol và x mol
a. Tính x
b. Trộn dung dịch X với 100 ml dung dịch Ba(OH)2 0,3M thu được m gam kết tủa và V lít khí (đktc). Tính m và V?
Lời giải:
a) Bảo toàn điện tích:
→ 3.0,01 + 0,02 = 2.0,02 + x → x = 0,01
b)
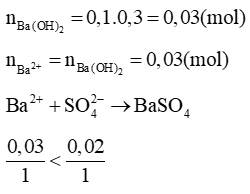
→ Tính theo ion

Lời giải:
→ a = 0,2M
Mặt khác:
Câu 16: Cho m gam Al vào 200 ml dung dịch HCl 1,5M thu được V (l) H2. Tìm V, m?
Lời giải:
nHCl = 0,2. 1,5 = 0,3 (mol)
Phương trình: 2Al + 6HCl → 2AlCl3 + 3H2
→ mAl = 0,1.27 = 2,7 (g).
Lời giải:
nNaOH = 0,1 (mol);
→ Dung dịch A chứa NaHCO3 (0,1) và Ca(HCO3)2 (0,3 – 0,1 = 0,2 mol)
Bảo toàn nguyên tố C:
→ V = 0,6.22,4 = 13,44 (l)
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3 + 2H2O
A. 6,72;
B. 10,08;
C. 8,96;
D. 11,2.
Lời giải:
Đáp án đúng là: C
nAl = 0,2, nFe = 0,1 (mol)
2Al + 6HCl → 2AlCl3 + 3H2
0,2 → 0,3 (mol)
Fe + 2HCl→ FeCl2 + H2
0,1 0,1 (mol)
V = (0,3+0,1).22,4 = 8,96 (l).
Lời giải:
CaCO3 + 2HCl → CaCl2 + H2O + CO2
MgCO3 + 2HCl → MgCl2 + H2O + CO2
Na2CO3 + 2HCl → 2NaCl + H2O + CO2
K2CO3 + 2HCl → 2KCl + H2O + CO2
CaO + 2HCl → CaCl2 + H2O
MgO + 2HCl → MgCl2 + H2O
Số mol HCl bài cho: 0,3 mol; chọn 100 g (A) → 80 g (B) → nHCl = 2,4 mol
Dùng định luật bảo toàn chất để thấy số mol HCl phản ứng với (A) hay (B) hay (C) là như nhau; khối lượng CO2 là:
A. a = 0,06; b = 0,03;
B. a = 0,12; b = 0,06;
C. a = 0,06; b = 0,12;
D. a = 0,03; b = 0,06.
Lời giải:
Đáp án đúng là: B
Bảo toàn e: 15a + 10b = 0,8.3
Bảo toàn S:
Giải hệ trên được:
Lời giải:
Cho X tác dụng với dung dịch HNO3 loãng dư thì không thấy khí thoát ra → Phản ứng chỉ tạo muối
PTHH:
4Mg + 10HNO3 → 4Mg(NO3)2 + NH4NO3 + 3H2O (1)
0,3……0,75
4Zn + 10HNO3 → 4Zn(NO3)2 + NH4NO3 + 3H2O (2)
0,4……0,1
8Al + 30HNO3 → 8Al(NO3)3 + 3NH4NO3 + 9H2O (3)
0,2……0,75
Theo các phương trình, ta có:
A. 25% N2; 25% H2 và 50% NH3;
B. 25% NH3; 25% H2 và 50% N2;
C. 25% N2; 25% NH3 và 50% H2;
D. 15% N2; 35% H2 và 50% NH3;
Lời giải:
Đáp án đúng là: A
Khi cho hỗn hợp gồm N2, H2 và NH3 đi qua dung dịch H2SO4 đặc, dư thì toàn bộ NH3 bị hấp thụ.
Theo giả thiết thì sau khi đi qua dung dịch H2SO4 đặc thì thể tích khí còn lại một nửa
⇒ Coi V(NH3 ) = 1 thì V(N2) + V(H2) = 1 (1)
(2)
Giải (1) và (2) ta có V (N2) = 0,5, V(NH3) = 0,5
%NH3 = 50%.
A. 10,87 gam;
B. 7,45 gam;
C. 9,51 gam;
D. 10,19 gam.
Lời giải:
Đáp án đúng là: A
Ta có:
Nhận thấy nếu nBa = 0,06 → nNa = 0,259 → (Vô lý)
Câu 24: Cho hỗn hợp khí X gồm 22 gam khí CO2, 12,8 gam khí SO2 và 15,4 gam khí N2O. Hãy xác định tỉ khối của hỗn hợp X so với khí N2?
Lời giải:
Lời giải:
* Cho hỗn hợp X vào dung dịch H2SO4 loãng dư:
Fe phản ứng tạo ra H2, Cu không phản ứng.
Bảo toàn e:
→ nFe =0,1 mol
* Cho hỗn hợp X vào dung dịch HNO3 đặc, nguội, dư.
Cu phản ứng tạo khí NO2, Fe bị thụ động (không phản ứng).
= 0,05 mol
Bảo toàn e:
2nCu = → nCu = 0,025 mol
Khối lượng của hỗn hợp X:
m = mFe + mCu = 0,1.56 + 0,025.64 = 7,2 gam.
Lời giải:
Ta có tỉ lệ khối lượng của FeO và Fe2O3 là 9 : 20.
→
Ta có:
FeO + Fe2O3 → Fe3O4
Do vậy có thể quy đổi X về Fe3O4
Phản ứng xảy ra:
Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O
Ta có:
nHCl = 0,2.1 = 0,2 mol
→ = 0,05 mol
Cho Fe vào Y:
Fe + 2FeCl3 → 3FeCl2
→ = 0,025 mol
→ mFe = 0,025.56 = 1,4 gam.
Câu 27: Cho hợp chất MX2. Trong phân tử MX2 , tổng số hạt cơ bản là 140 và số hạt mang điện nhiều hơn số hạt không mang điện là 44. Số khối của X lớn hơn số khối của M là 11. Tổng số hạt cơ bản trong X nhiều hơn trong M là 16 hạt. Xác định công thức MX2?
A. NO2;
B. MgCl2;
C. CuCl2;
D. SO2.
Lời giải:
Đáp án đúng là: B
Tổng số các hạt trong phân tử là 140
→ 2ZM + NM + 2.(2ZX + NX ) = 140 (1)
Số hạt mang điện nhiều hơn số hạt không mang điện là 44 hạt
→ 2ZM + 4ZX - NM - 2.NX = 44 (2)
Giải hệ (1), (2) → 2ZM + 4ZX = 92 và NM + 2NX = 48
Tổng số hạt cơ bản trong X nhiều hơn trong M là 16 hạt
→ 2ZX + NX - (2ZM + NM) = 16 (3)
Số khối của X lớn hơn số khối của M là 11
→ (ZX + NX)- (ZM + NM) = 11 (4)
Lấy (3) - (4) → ZX - ZM = 5
Ta có hệ:
M là Mg và X là Cl
Vậy công thức của MX2 là MgCl2.
A. 4,48 lít;
B. 3,36 lít;
C. 2,24 lít;
D. 1,12 lít.
Lời giải:
Đáp án đúng là: A
TQ:
→ VCO = 4,48 lít.
Lời giải:
Vào MgCl2 thì có khí bay ra; có kết tủa.
Ba + 2H2O + MgCl2 → Mg(OH)2↓ + BaCl2 + H2↑
Vào H2SO4 thì có khí bay ra; có kết tủa không tan trong axit.
Ba + H2SO4 → BaSO4↓ + H2↑
Vào AlCl3 thì có khí bay ra; có kết tủa, nếu Ba dư thì kết tủa tan dần.
Ba + 2H2O → Ba(OH)2 + H2↑
3Ba(OH)2 + 2AlCl3 → 2Al(OH)3↓ + 3BaCl2
2Al(OH)3 + Ba(OH)2 → Ba(AlO2)2 + 4H2O.
Lời giải:
phản ứng = 0,9 – 0,865 = 0,035 (mol).
→ mkim loại = mchất rắn – moxi phản ứng = 2,12 – 0,035.32 = 1 (gam).
Lời giải:
Sơ đồ phản ứng:
Quá trình cho nhận electron:
Bảo toàn electron:
A. 9,9 gam;
B. 9,8 gam;
C. 8,9 gam;
D. 7,5 gam.
Lời giải:
Đáp án đúng là: C
Alanin có công thức là: CH3-CH(NH2)-COOH
CH3-CH(NH2)-COOH + NaOH CH3-CH(NH2)-COONa + H2O
Ta có:
⇒ nAla = nAla-Na = 0,1 (mol)
⇒ mAla = 0,1.89 = 8,9 (gam).
A. 0,1 và 0,1;
B. 0,2 và 0,2;
C. 0,2 và 0,1;
D. 0,18 và 0,06.
Lời giải:
Đáp án đúng là: C
C6H5OH + Na → C6H5ONa + 0,5 H2
x………………….....x (mol)
C2H5OH + Na → C2H5ONa + 0,5 H2
y…………………….y (mol)
C6H5OH + NaOH → C6H5ONa + H2O
0,01………0,01 (mol)
Ta có hệ phương trình:
a. Xác định kim loại M và công thức các muối và oxit của M.
b. Viết phương trình phản ứng khi cho:
1) M tác dụng với Cl2, MCly, H2SO4 (loãng, đặc nguội, đặc nóng).
2) MO0,5x tác dụng với HNO3 loãng; khí H2; dung dịch KMnO4 (Trong môi trường axit loãng).
Lời giải:
a) Trong MClx:
Trong MCly:
→ MM.(1,172x – y) = -6,106xy (1)
Trong MO0,5x:
Trong M2Oy:
→MM.(1,35x – y) = -2,8xy (2)
Từ (1) và (2) suy ra:
Cặp nghiệm x = 2; y = 3 thì thoả mãn
Kim loại có hai hoá trị là II và III suy ra M là sắt (Fe)
b) 1)
Fe + 2FeCl3 → 3FeCl2
Fe không tác dụng với H2SO4 đặc nguội
2) 3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O
10FeO + 2KMnO4 + 18H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 18H2O
Câu 35: Hiện tượng xảy ra khi cho 1 lá nhôm vào dung dịch H2SO4 đặc, nguội
B. Khí không màu và không mùi thoát ra
C. Lá nhôm tan dần
D. Không có hiện tượng
Lời giải:
Đáp án đúng là: D
Chú ý: Một số kim loại như Al, Fe, Cr … không tác dụng với H2SO4 đặc, nguội.
Câu 36: Nêu hiện tượng viết PTHH để giải thích các thí ngiệm sau:
Thí nghiệm 1: Cho Na dư vào dung dịch Al(NO3)3. Sau đó lại sục CO2 vào dung dịch thu được.
Thí nghiệm 2: Đốt cháy quặng pirit sắt trong oxi dư sau đó hấp thu sản phẩm khí vào dung dịch brom.
Thí nghiệm 3: Cho sắt vào dung dịch đồng (ll) sunfat.
Lời giải:
Thí nghiệm 1: Na tan dần, có khí xuất hiện. Có kết tủa trắng keo xuất hiện. Một thời gian sau kết tủa keo tan dần dần. Sục CO2 vào lại thấy có kết tủa.
2Na + 2H2O → 2NaOH + H2
Al(NO3)3 + 3NaOH → Al(OH)3↓ + 3NaNO3
NaOH + Al(OH)3 → NaAlO2 + 2H2O
CO2 + NaAlO2 + 2H2O → Al(OH)3↓ + NaHCO3
Thí nghiệm 2: Đốt quặng pirit sắt sinh ra khí mùi hắc không màu. Sục khí này vào dung dịch brom thấy brom mất màu.
4FeS2 + 11O2 2Fe2O3 + 8SO2
SO2 + Br2 + 2H2O → 2HBr + H2SO4
Thí nghiệm 3: Sau 1 thời gian thấy màu xanh của dung dịch mất dần. Sắt tan một phần, có kim loại đồng màu đỏ bám ngoài sắt.
Fe + CuSO4 → FeSO4 + Cu
a) Tìm nguyên tử khối và gọi tên X
b) Nguyên tố X có 2 đồng vị, đồng vị 1 hơn đồng vị 2 là 50% tổng số nguyên tử, hạt nhân nguyên tử đồng vị 1 kém hạt nhân đồng vị 2 là 2 notron. Xác định số khối mỗi đồng vị?
Lời giải:
a. Gọi số mol của NaX là a (mol; a > 0)
Phương trình hóa học:
Ta có:
X là clo, nguyên tử khối là 35,5.
b. Gọi phần trăm đồng vị 1 và đồng vị 2 lần lượt là a và b.
Ta có:
Gọi số khối của đồng vị 1 là A.
Hạt nhân đồng vị 1 kém hạt nhân đồng vị 2 là 2 notron nên số khối của đồng vị 2 là A + 2.
Ta có:
Vậy số khối của hai đồng vị 1 và 2 lần lượt là 35 và 37.
Lời giải:
Cho Zn dư vào dung dịch, sau phản ứng lọc lấy rắn không tan ta thu được dung dịch chỉ chứa ZnCl2.
Phương trình hóa học
Zn + CuCl2 → ZnCl2 + Cu↓
Zn + 2HCl → ZnCl2 + H2↑
Câu 39: Cho 1 lượng bột sắt dư vào 200 ml dung dịch HCl thu được 6,72 lít khí. Nồng độ mol của HCl?
Lời giải:
PTHH:
= nkhí = = 0,3 mol.
Theo PTHH thì nHCl = 2 = 2.0,3 = 0,6 mol.
⇒
Lời giải:
(NH4)2SO4 + 2NaOH → Na2SO4 + 2NH3 + 2H2O
nNaOH = 0,3.1 = 0,3 (mol)
NaOH dư
Câu 41: Khi cho NH3 dư tác dụng với Cl2 thu được gì?
Lời giải:
Đầu tiên xảy ra phản ứng:
2NH3 + 3Cl2 → N2 + 6HCl
Sau đó, vì dư amoniac nên:
NH3 + HCl → NH4Cl
Vậy các chất thu được là NH4Cl, N2 và NH3 dư nếu có.
Câu 42: Cho phản ứng 4Al + 3O2 2Al2O3. Biết có 2,4.1022 nguyên tử Al phản ứng.
b) Tính khối lượng Al2O3 tạo thành.
Lời giải:
4Al + 3O2 2Al2O3
a. Theo phương trình:
→ Vkk = 0,672.5 = 3,36 (l)
b. Theo phương trình:
Câu 43: Cho sơ đồ phản ứng sau: Fe2O3 + CO Fe + CO2
b) Hãy cho biết tỉ lệ số nguyên tử, phân tử của các chất trong phản ứng trên.
c) Cho 16,8 kg CO tác dụng với 32 kg Fe2O3 tạo ra 26,4 kg CO2, tính khối lượng sắt thu được?
Lời giải:
a) Fe2O3 + 3CO 2Fe + 3CO2
b) Tỉ lệ: 1 : 3 : 2 : 3
c) Bảo toàn khối lượng: = 32 + 16,8 – 26,4 = 22,4(kg).
Câu 44: Cho sơ đồ: (NH4)2SO4 NH4Cl NH4NO3
Trong sơ đồ A, B lần lượt là các chất:
A. HCl, HNO3;
B. CaCl2, HNO3;
C. BaCl2, AgNO3;
d. HCl, AgNO3.
Lời giải:
Đáp án đúng là: C
(NH4)2SO4 + BaCl2 → BaSO4↓ + 2NH4Cl
NH4Cl + AgNO3 → AgCl↓ + NH4NO3
A. CH3COOH;
B. HCl;
C. C2H5OH;
D. NaOH.
Lời giải:
Đáp án đúng là: D
Để hạn chế ảnh hưởng của khí nâu đỏ đó thoát ra gây ô nhiệm môi trường, bạn An đã nút ống nghiệm bằng bông tẩm dung dịch NaOH vì:
2NO2 + 2NaOH → NaNO3 + NaNO2 + H2O
Câu 46: Sục 4,48 lít CO2 (đktc) vào dung dịch chứa 0,15 mol Ca(OH)2 thu được bao nhiêu gam muối?
A. 10 gam;
B. 21,2 gam;
C. 20,3 gam;
D. 18,1 gam.
Lời giải:
Đáp án đúng là: D
Ta có:
→ Tạo 2 muối
Ca(OH)2 + CO2 → CaCO3 + H2O
x……………x………x (mol)
Ca(OH)2 + 2CO2 → Ca(HCO3)2
y……………2y………y (mol)
mmuối = 0,1.100 + 0,05.162 = 18,1 (g).
A. Liên kết của X với Y là liên kết cộng hoá trị;
B. Nguyên tố X thuộc chu kì 2, nhóm VIA;
C. Hợp chất khí của Y với hiđro chứa 5,88% khối lượng hiđro;
D. Oxit cao nhất của Y chứa 40% khối lượng oxi.
Lời giải:
Đáp án đúng là: D
Giả sử trong nguyên tử X: số p = số e = Z và số n = N
X + 2e → X2-
→ Số hạt trong ion X2- là: Số p = Z; Số e = Z + 2; Số n = N
Theo đề bài:
+ Ion X2- có tổng số hạt p, n, e là 26 → Z + Z + 2 + N = 26
+ Số hạt mang điện nhiều hơn số hạt không mang điện là 10
→ Z + Z + 2 - N = 10
Giải hệ trên ta được Z = 8 và N = 8 → X là oxi.
Nguyên tử X có số hạt mang điện là 2Z = 16.
Nguyên tử Y có số hạt mang điện nhiều hơn số hạt mang điện của nguyên tử X là 16 nên số hạt mang điện của nguyên tử Y là 16 + 16 = 32
Suy ra số hạt proton = số hạt electron của nguyên tử Y bằng 32 : 2 = 16.
Vậy nguyên tố Y là nguyên tố lưu huỳnh.
Phát biểu A. Liên kết của X với Y là liên kết cộng hóa trị là phát biểu đúng.
Phát biểu B. Nguyên tố X thuộc chu kì 2, nhóm VIA đúng vì X có cấu hình electron nguyên tử là 1s22s22p4. X thuộc chu kì 2 vì có 2 lớp electron, nhóm VIA vì có 6 e ở lớp ngoài cùng.
Phát biểu C. Hợp chất khí của Y với hiđro chứa 5,88% khối lượng hiđro đúng vì công thức hợp chất khí với H của S là H2S.
Ta có %mH = 2.100%/34 = 5,88%
Phát biểu D. Oxit cao nhất của Y chứa 40% khối lượng oxi là phát biểu sai vì công thức oxit cao nhất của Y là SO3 có %mO = 60%.
Lời giải:
Gọi x (mol) là số mol của CO2
⇒ = M.n = 44x gam
CO2 + Ca(OH)2 → CaCO3 + H2O
⇒ = x mol ⇒ = M.n =100x (g)
Ta có: mkết tủa - = mdd giảm
⇔ 100x - 44x = 5,6 ⇔ x = 0.1
⇒ V = = 0.1.22.4 = 2.24 lít
⇒ a = = 100.0.1 = 10 g
A. 8,96 lít;
B. 7,84 lít;
C. 8,4 lít;
D. 6,72 lít.
Lời giải:
Đáp án đúng là: B
Nhận xét: kết tủa là BaCO3, dung dịch có thể chứa muối Na2CO3, NaHCO3 và Ba(HCO3)2
- Biện luận: Nếu dung dịch chỉ có muối Na2CO3 và NaHCO3 thì (khoảng giá trị khi coi muối chỉ có Na2CO3 và NaHCO3), điều này vô lý theo đề bài. Vậy muối sẽ gồm , , (đã có thì không thể có trong dung dịch)
→ a = 0,05; b = 0,2
BTNT (Ba):
BTNT (C):
V = 0,35.22,4 = 7,84 (l).
Lời giải:
Phương trình hoá học:
H3PO4 + 2NaOH → Na2HPO4 + 2H2O
0,05……..0,1………0,05
Xem thêm các câu hỏi ôn tập Hóa học chọn lọc, hay khác:
1000 câu hỏi ôn tập môn Hóa có đáp án (Phần 12)
1000 câu hỏi ôn tập môn Hóa có đáp án (Phần 13)
1000 câu hỏi ôn tập môn Hóa có đáp án (Phần 14)
1000 câu hỏi ôn tập môn Hóa có đáp án (Phần 15)
1000 câu hỏi ôn tập môn Hóa có đáp án (Phần 17)
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)
