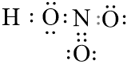1000 câu hỏi ôn tập môn Hóa có đáp án (Phần 12)
Bộ 1000 câu hỏi ôn tập môn Hóa có đáp án Phần 12 hay nhất được biên soạn và chọn lọc giúp bạn ôn luyện và đạt kết quả cao trong bài thi môn Hóa.
1000 câu hỏi ôn tập Hóa (Phần 12)
Câu 1: Viết công thức cấu tạo các ankin có tên gọi sau đây:
Lời giải:
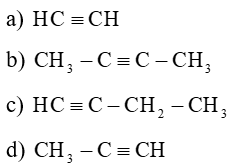
Câu 2: Hoàn thành sơ đồ phản ứng sau:
Butan → metan → axetilen → etilen → polietilen (nhựa P.E)
Lời giải:
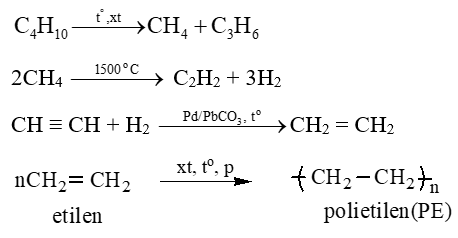
Câu 3: Viết phương trình hóa học thực hiện chuỗi chuyển hóa sau (ghi rõ điều kiện nếu có):
C → CO → CO2 → NaHCO3 → Na2CO3 → NaCl → Cl2 → FeCl3 → Fe
Lời giải:
C + CO2 →t° 2CO
2CO + O2 2CO2
CO2 + NaOH → NaHCO3
NaHCO3 + NaOH → Na2CO3 + H2O
Na2CO3 + BaCl2 → BaCO3↓ + 2NaCl
2NaCl 2Na + Cl2
3Cl2 + 2Fe 2FeCl3
2FeCl2 + 3Zn → 3ZnCl2 + 2Fe
Câu 4: Hoàn thành các chuỗi phản ứng sau:
CH4 → C2H2 → Vinyl clorua → PVC
Lời giải:
2CH4 C2H2 + 3H2
CH ≡ CH + HCl CH2 = CHCl
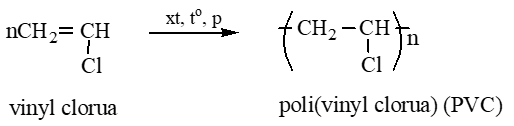
Câu 5: Cho biết loại liên kết trong các phân tử MgCl2, CO2, C2H4?
Lời giải:
- Hiệu độ âm điện của Mg và Cl là: 3,16 - 1,31 = 1,85 nên liên kết trong phân tử MgCl2 là liên kết ion.
- Hiệu độ âm điện của C và O là: 3,44 - 2,55 = 0,89 nên liên kết trong phân tử CO2 là liên kết cộng hóa trị phân cực.
- Hiệu độ âm điện của C và H là: 2,55 - 2,2 = 0,35 nên liên kết trong phân từ C2H4 là liên kết cộng hóa trị không phân cực.
Câu 6: Giữa C2H4 và C2H2 thì hidrocacbon nào làm mất màu dung dịch nước brom nhanh hơn?
Lời giải:
Cùng một lượng brom, ankin sẽ làm mất màu dung dịch brom nhanh hơn anken.
C2H2 + 2Br2 → C2H2Br4
C2H4 + Br2 → C2H4Br2.
Câu 7: Phương trình từ C2H4 ra nhựa PE?
Lời giải:
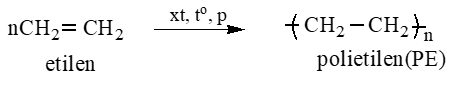
Câu 8: Số đồng phân chứa dẫn xuất brom C3H6Br2 và C3H7Br?
Lời giải:
Số đồng phân chứa dẫn xuất brom C3H6Br2 là 3 đồng phân:
CH3 – CH2– CHBr2
CH3 – CBr2 – CH3
CH3 – CHBr – CH2Br
CH2Br – CH – CH2Br
Số đồng phân chứa dẫn xuất brom C3H7Br là 2 đồng phân:
CH3 – CH2 – CH2Br
CH3 – CHBr – CH3
Câu 9: Chất C4H6O2 có bao nhiêu đồng phân là axit mạch hở?
Lời giải:
Đáp án đúng là: C
C4H6O2 có trong đó 1 ở nhóm chức – COOH, còn 1 ở trong gốc hiđrocacbon.
Chất C4H6O2 có số đồng phân là axit mạch hở là:
1. CH2 = CH – CH2 - COOH
2. CH3 – CH = CH – COOH
3. CH2 = C(CH3) - COOH
Câu 10: Ứng với công thức phân tử C4H6O2 có số đồng phân cấu tạo este mạch hở là:
Lời giải:
Đáp án đúng là: C
C4H6O2 có
→ este không no, có chứa liên kết đôi C = C, đơn chức, mạch hở
→ Các đồng phân este mạch hở của C4H6O2 là:
1. HCOOCH = CH – CH3
2. HCOOCH2CH = CH2
3. HCOOC(CH3) = CH2
4. CH3COOCH = CH2
5. CH2 = CHCOOCH3
→ Có 5 đồng phân este.
Câu 11: Cho AgNO3 tác dụng với C6H12O6 (xúc tác NH3 dư), cho biết sản phẩm tạo thành?
Lời giải:
HOCH2[CHOH]4CHO + 2AgNO3 + 3NH3 + H2O HOCH2[CHOH]4COONH4 + 2Ag↓ + 2NH4NO3
Sản phẩm gồm: Ag, NH4NO3, HOCH2[CHOH]4COONH4.
Lời giải:
Đáp án đúng là: D
Chất lưỡng tính là : Ca(HCO3)2, (NH4)2CO3, Al(OH)3, Zn(OH)2
Câu 13: Ca3(PO4)2 có phải kết tủa không?
Lời giải:
Ca3(PO4)2 có kết tủa. Nó sẽ xuất hiện kết tủa trắng Ca3(PO4)2 trong dung dịch.
Câu 14: Cân bằng phương trình phản ứng sau bằng phương pháp thăng bằng electron:
Mg + HNO3 → Mg(NO3)2 + NO + H2O
Tổng các hệ số trong phuơng trình hoá học là:
Lời giải:
Đáp án đúng là: D
3Mg + 8HNO3 → 3Mg(NO3)2 + 2NO + 4H2O
Tổng các hệ số trong phuơng trình hoá học là: 20.
Câu 15: Cân bằng phương trình bằng phương pháp thăng bằng electron:
Mg + HNO3 → Mg(NO3)2 + NO + NO2 + H2O
Lời giải:
2Mg + 6HNO3 → 2Mg(NO3)2 + NO + NO2 + 3H2O
Câu 16: Các cách viết sau có ý nghĩ gì: 3 Zn, 2 Fe, 4 Ag, 5 K, 6 Ca, 3 N, 2 S, 9 Pb, 8 Cl, 7 Mg.
Lời giải:
3 Zn: Ba nguyên tử kẽm (zinc)
2 Fe: Hai nguyên tử sắt (iron)
4 Ag: Bốn nguyên tử bạc (silver)
5 K: Năm nguyên tử kali (potassium)
6 Ca: Sáu nguyên tử canxi (calcium)
3 N: Ba nguyên tử nitơ (nitrogen)
2 S: Hai nguyên tử lưu huỳnh (sulfur)
9 Pb: Chín nguyên tử chì (lead)
8 Cl: Tám nguyên tử clo (chlorine)
7 Mg: Bảy nguyên tử magie (magnessium).
Câu 17: Chỉ dùng một hoá chất tuỳ ý, hãy nhận biết chất sau: Mg, K, BaCl2, MgCl2.
Lời giải:
Trích các mẫu thử
Hoà tan mẫu các chất cần nhận biết vào nước ở nhiệt độ thường:
- Chất rắn nào tan và tạo khí là K
2K + 2H2O → 2KOH + H2↑
- Chất rắn nào tan trong nước là BaCl2 hoặc MgCl2.
- Chất rắn nào không tan trong nước là Mg
Cho KOH vừa thu được vào nhóm tan trong nước
- Dung dịch nào xuất hiện kết tủa là MgCl2
MgCl2 + 2KOH → Mg(OH)2↓ + 2KCl
- Dung dịch còn lại không có hiện tượng gì là BaCl2.
Câu 18: Cho kim loại M và các chất X, Y, Z thỏa mãn sơ đồ phản ứng sau:
Lời giải:
Đáp án đúng là: A
Kim loại M là Al, các phương trình phản ứng tương ứng xảy ra theo sơ đồ là:
2AlCl3 + 4Ba(OH)2 → Ba(AlO2)2 (Y) + 3BaCl2 + 4H2O
Ba(AlO2)2 + 2CO2 + 4H2O → Ba(HCO3)2 + 2Al(OH)3↓ (Z).
Lời giải:
Quá trình sản xuất axit sunfuric từ lưu huỳnh gồm 3 công đoạn:
- Sản xuất SO2 bằng cách đốt S (hoặc quặng pirit) trong không khí:
4FeS2 + 11O2 2Fe2O3 + 8SO2
- Sản xuất SO3 từ SO2:
- Sản xuất H2SO4 từ SO3: SO3 + H2O → H2SO4.
A. Dùng H2O và dung dịch HCl;
B. Dùng dung dịch NaOH và dung dịch HCl;
C. Dùng dung dịch HCl và dung dịch AgNO3;
D. Dùng dung dịch NaOH và dung dịch AgNO3.
Lời giải:
Đáp án đúng là: B
|
Thuốc thử |
(Al + Al2O3) |
(Fe + Fe2O3) |
(FeO + Fe2O3) |
|
Dung dịch NaOH |
Khí bay lên |
- |
- |
|
Dung dịch HCl |
- |
Khí bay lên |
- |
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Fe + 2HCl → FeCl2 + H2↑
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
FeO + 2HCl → FeCl2 + H2O
Câu 21: Cách biểu diễn 4 H2 có nghĩa là:
Lời giải:
Đáp án đúng là: C
H2 là 1 phân tử hiđro
4 H2 là 4 phân tử hiđro.
Câu 22: Điều kiện phát sinh sự cháy và các biện pháp dập tắt sự cháy?
Lời giải:
- Điều kiện phát sinh sự cháy:
+ Chất phải nóng đến nhiệt độ cháy ;
+ Phải đủ khí oxi (oxygen) cho sự cháy.
- Muốn dập tắt sự cháy phải thực hiện một hoặc đồng thời cả hai biện pháp :
+ Hạ nhiệt độ của chất cháy xuống dưới nhiệt độ cháy.
+ Cách li chất cháy với oxi (oxygen).
Câu 23: Nêu cách nhận biết 4 dung dịch: K2CO3, KOH, KCl, K2SO4.
Lời giải:
Trích các mẫu thử
Cho quỳ tím vào các mẫu thử:
- K2CO3, KOH làm quỳ tím xanh (1)
- KCl, K2SO4 không làm quỳ tím đổi màu (2)
Cho dung dịch BaCl2 vào phần (1) và (2) lần lượt nhận ra:
+ Ở phần (1) K2CO3 tác dụng với BaCl2 tạo kết tủa còn KOH không phản ứng.
+ Ở phần (2) K2SO4 tác dụng với BaCl2 tạo kết tủa còn KCl không phản ứng.
K2CO3 + BaCl2 → BaCO3↓ + 2KCl
K2SO4 + BaCl2 → BaSO4↓ + 2KCl.
Câu 24: Cách nhận biết K2SO4, H2SO4, KOH, KCl?
Lời giải:
- Trích mẫu thử và đánh số thứ tự mỗi mẫu thử.
- Cho quỳ tím vào mỗi mẫu thử nhận ra H2SO4 làm quỳ hóa đỏ; KOH làm quỳ hóa xanh. K2SO4 và KCl không làm đổi màu quỳ tím.
- Cho BaCl2 lần lượt vào hai mẫu không làm đổi màu quỳ tím nhận ra K2SO4 do có xuất hiện kết tủa trắng
BaCl2 + K2SO4 → BaSO4↓ + 2KCl
Câu 25:
a) Liên kết cộng hóa trị là gì?
b) Liên kết cộng hóa trị khác với liên kết ion như thế nào?
c) Liên kết cộng hóa trị và liên kết ion có điểm gì tương tự nhau?
Lời giải:
a) Liên kết cộng hóa trị là liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron dùng chung. Mỗi cặp electron dùng chung tạo nên một liên kết cộng hóa trị.
b) Liên kết cộng hóa trị khác với liên kết ion như sau: Trong liên kết cộng hóa trị, các nguyên tử góp chung electron để tạo liên kết; trong liên kết ion, các electron được chuyển hẳn từ nguyên tử này sang nguyên tử kia để tạo thành các ion mang điện tích trái dấu hút nhau.
c) Liên kết cộng hóa trị và liên kết ion đều là liên kết hóa học, các nguyên tử sau khi hình thành liên kết thì bền hơn trước khi hình thành liên kết.
Câu 26: Để tách CO2 ra khỏi hỗn hợp gồm CO2, HCl và hơi nước, có thể cho hỗn hợp lần lượt qua các bình đựng:
Lời giải:
Đáp án đúng là: D
Để tách CO2 ra hỏi hỗn hợp thì ta không dùng các hóa chất phản ứng được với CO2 như các dung dịch kiềm (KOH, NaOH...) và các muối cacbonat như Na2CO3, K2CO3 → Chọn đáp án D vì:
Dẫn hỗn hợp khí và hơi nước qua NaHCO3 thì HCl tan trong nước tạo thành dung dịch HCl, dung dịch HCl phản ứng với NaHCO3 tạo khí CO2:
NaHCO3 + HCl → NaCl + H2O + CO2↑
Khí đi ra khỏi bình gồm CO2 và H2O. Dẫn các khí đó qua bình đựng P2O5 dư thì hơi H2O được giữ lại, ta thu được khí CO2.
Câu 27: Cách tính số liên kết xích ma ( )?
Lời giải:
Số liên kết xích ma ( ) = Số nguyên tử - 1.
VD: CH4 (có 5 nguyên tử nên số liên kết xích ma ( ) = 4);
CH2 = CH – CH = CH2 ((C4H6), 10 nguyên tử, số liên kết xích ma ( ) = 9).
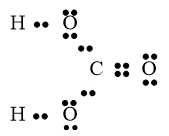
Câu 28: Viết công thức cấu tạo và công thức eletron của CH3OH?
Lời giải:
Công thức cấu tạo của CH3OH
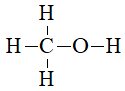
Công thức electron của CH3OH
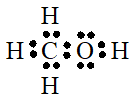
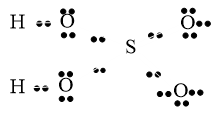
Câu 29: Viết công thức electron của: SO2, H2SO4, H2CO3, HNO3, H3PO4.
Lời giải:
|
SO2 |
|
|
H2SO4 |
|
|
H2CO3 |
|
|
HNO3 |
|
|
H3PO4 |
|
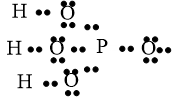
Câu 30: Viết công thức electron và công thức cấu tạo của các phân tử sau: C2H6, SO3, H2CO3, HNO3
Lời giải:
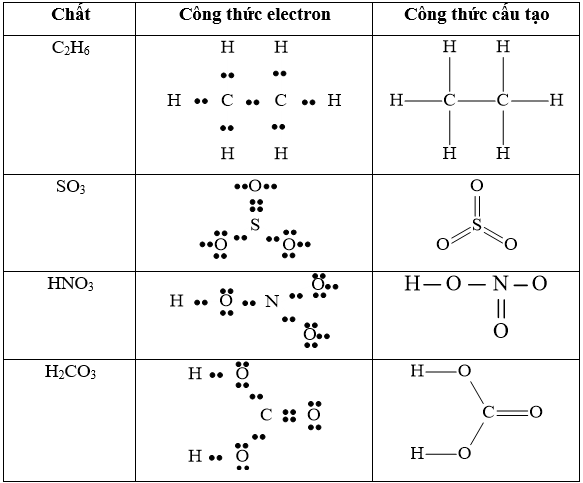
Câu 31: CaCO3 có tác dụng với NaOH không?
Lời giải:
CaCO3 không tác dụng với NaOH.
a) Axit tác dụng với bazơ.
b) Axit tác dụng với kim loại.
c) Muối tác dụng với muối.
d) Oxit bazơ tác dụng với oxit axit.
Viết các phương trình hoá học.
Lời giải
a) Muối được điều chế bằng cách cho axit tác dụng với bazơ: CuSO4, MgCl2.
Cu(OH)2 + H2SO4 → CuSO4 + 2H2O
Mg(OH)2 + 2HCl → MgCl2 + 2H2O
b) Muối được điều chế bằng cách cho axit tác dụng với kim loại: MgCl2, CuSO4.
Mg + 2HCl → MgCl2 + H2↑
Cu + 2H2SO4 (đặc) CuSO4 + SO2↑ + H2O
c) Muối được điều chế bằng cách cho muối tác dụng với muối: CaCO3, CuSO4, MgCl2.
CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl
CuCl2 + Ag2SO4 → CuSO4 + 2AgCl↓
BaCl2 + MgSO4 → BaSO4↓ + MgCl2
d) Muối được điều chế bằng cách cho oxit bazơ tác dụng với oxit axit: CaCO3.
Lời giải:
- Trích các chất thành các mẫu thử đựng trong các ống nghiệm riêng biệt. Đánh số thứ tự
- Hoà tan các mẫu thử vào nước:
+ Tan: CaO, P2O5, Na2O, NaCl (nhóm I)
+ Không tan: CaCO3
CaO + H2O → Ca(OH)2
P2O5 + 3H2O → 2H3PO4
Na2O + H2O → 2NaOH
- Nhúng quỳ tím vào sản phẩm hoà tan của nhóm I vào nước:
+ Quỳ tím hoá đỏ → chất ban đầu là P2O5
+ Quỳ tím hoá xanh → chất ban đầu là CaO, Na2O (nhóm II)
+ Không đổi màu → NaCl
- Cho sản phẩm hoà tan vào nước của P2O5 vào sản phẩm vào hoà tan của CaO, Na2O vào nước:
+ Tan → chất ban đầu là CaO
+ Không tan → chất ban đầu là Na2O
3Ca(OH)2 + 2H3PO4 → Ca3(PO4)2↓ + 6H2O
Lời giải:
Giả sử ban đầu có x mol CaCO3 và y mol MgCO3
→mhh ban đầu = 100x + 84y (g)
→ mhh sau = 56x + 40y (g)
→ 56x + 40y = 50%(100x + 84y) = 50x + 42y
→ 6x = 2y
→ y = 3x
Vậy
Câu 35: Hãy giải thích vì sao:
a. Khi nung nóng đá vôi (CaCO3) thì thấy khối lượng giảm đi.
b. Khi nung nóng miếng đồng trong không khí (có oxi) thì thấy khối lượng tăng lên.
Lời giải:
a) Khí CO2 bay đi nên chất rắn còn lại là CaO nên khối lượng giảm đi
PTHH:
b) Khi nung nóng, đồng tác dụng với oxi trong không khí tạo thành đồng (II) oxit nên khối lượng tăng lên
PTHH:
Câu 36: Viết phương trình điện li Ca(HCO3)2?
Lời giải:
Câu 37: Phương trình phân tử, phương trình ion thu gọn, phương trình ion đầy đủ:
1.Ca(HCO3)2 + HCl
2.Ca(HCO3)2 + NaOH
3.Ca(HCO3)2 + Ca(OH)2
4.Cu(NO3)2 + Na2SO4
5.CaCl2 + Na3PO4
Lời giải:
1.Phương trình phân tử:
Phương trình ion đầy đủ:
Phương trình ion rút gọn:
2. Phương trình phân tử:
Phương trình ion đầy đủ:
Phương trình ion rút gọn:
4. Không phản ứng
5. Phương trình phân tử:
Phương trình ion đầy đủ:
Phương trình ion rút gọn:
A. chuyển màu xanh;
B. chuyển màu đỏ;
C. không đổi màu;
D. mất màu.
Lời giải:
Đáp án đúng là: B
PTHH: CaO + H2O → Ca(OH)2
Ca(OH)2 có tính bazơ, mà bazơ làm dung dịch phenolphtalein chuyển sang màu đỏ
Câu 39: Viết công thức electron và công thức cấu tạo các phân tử sau: Cl2, CH4, C2H2, C2H4, NH3.
Lời giải:
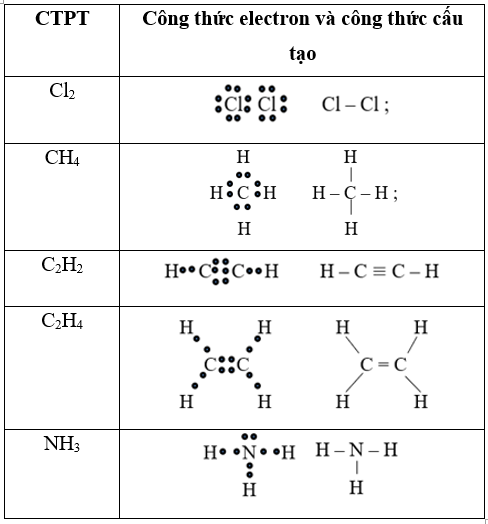
Câu 40: Cặp chất khi phản ứng tạo ra chất khí là:
A. Na2CO3 và HCl;
B. AgNO3 và BaCl2;
C. K2SO4 và BaCl2;
D. NaOH và Fe(NO3)3.
Lời giải:
Đáp án đúng là: A
Phương trình phản ứng xảy ra:
Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑
Câu 41: Cặp chất nào sau đây không phải là đồng phân của nhau?
A. Metyl fomat và axit axetic;
B. Mantozơ và saccarozơ;
C. Fructozơ và glucozơ;
D. Tinh bột và xenlulozơ.
Lời giải:
Đáp án đúng là: D
Metyl fomat và axit axetic có CTPT: C2H4O2.
Mantozơ và saccarozơ có CTPT: C12H22O11.
Fructozơ và glucozơ có CTPT: C6H12O6.
Tinh bột và xenlulozơ đều có CTPT tổng quát là (C6H10O5)n nhưng hệ số n ở tinh bột và xenlulozơ khác nhau → chúng không phải đồng phân của nhau.
Lời giải:
Bảo toàn N:
Mà H = 25% →
Bảo toàn H:
Mà H = 25% →
KMnO4 + KNO2 + H2SO4 → MnSO4 + KNO3 + K2SO4 + H2O
Tổng hệ số cân bằng (tối giản) của phản ứng là?
A. 21;
B. 23;
C. 25;
D. 27.
Lời giải:
Đáp án đúng là: A
2KMnO4 + 5KNO2 + 3H2SO4 → 2MnSO4 + 5KNO3 + K2SO4 + 3H2O
Tổng hệ số khi cân bằng các chất là 21.
Câu 44: Cân bằng phản ứng oxi hóa khử sau: KOH + Cl2 → KCl + KClO3 + H2O
Lời giải:
6KOH + 3Cl2 → 5KCl + KClO3 + 3H2O
Câu 45: Cân bằng phương trình oxi hoá khử sau:
1) Cu(NO3)2 → CuO + NO2 + O2
2) NH4NO2 → N2 + H2O
3) NH4NO3 → N2O + H2O
Lời giải:
1) Cu(NO3)2 → CuO + NO2 + O2
2Cu(NO3)2 2CuO + 4NO2 + O2
2) NH4NO2 → N2 + H2O
NH4NO2 N2 + 2H2O
3) NH4NO3 → N2O + H2O
NH4NO3 N2O + 2H2O
Câu 46: Cân bằng phản ứng oxi hóa khử:
a) Fe3O4 + Al → Al2O3 + Fe
b) FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + K2SO4 + MnSO4 + H2O
Lời giải
a) Fe3O4 + Al → Al2O3 + Fe
3Fe3O4 + 8Al → 4Al2O3 + 9Fe
b) FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + K2SO4 + MnSO4 + H2O
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Câu 47: Cân bằng các phương trình bằng phương pháp oxi hóa khử:
Mg + H2SO4 → MgSO4 + SO2 + H2O
Mg + H2SO4 → MgSO4 + S + H2O
Zn + H2SO4 → ZnSO4 + H2S + H2O
M + HNO3 → M(NO3)2 + NO2 + H2O
M + HNO3 → M(NO3)2 + NO + H2O
M + HNO3 → M(NO3)2 + N2O + H2O
Lời giải:
a) Mg + H2SO4 → MgSO4 + SO2 + H2O
Mg + 2H2SO4 → MgSO4 + SO2 + 2H2O
b) Mg + H2SO4 → MgSO4 + S + H2O
3Mg + 4H2SO4 → 3MgSO4 + S + 4H2O
c) Zn + H2SO4 → ZnSO4 + H2S + H2O
4Zn + 5H2SO4 → 4ZnSO4 + H2S + 4H2O
d) M + HNO3 → M(NO3)2 + NO2 + H2O
M + 4HNO3 → M(NO3)2 + 2NO2 + 2H2O
e) M + HNO3 → M(NO3)2 + NO + H2O
3M + 8HNO3 → 3M(NO3)2 + 2NO + 4H2O
g) M + HNO3 → M(NO3)2 + N2O + H2O
4M + 10HNO3 → 4M(NO3)2 + N2O + 5H2O
Câu 48: Cân bằng phương trình oxi hoá – khử:
I2 + Na2S2O3 → Na2S4O6 + NaI
Lời giải:
I2 + 2Na2S2O3 → Na2S4O6 + 2NaI
Câu 49: Cân bằng phương trình phản ứng bằng phương pháp thăng bằng electron:
Cl2 + Ca(OH)2 → Ca(OCl)2 + CaCl2 + H2O
Lời giải:
2Cl2 + 2Ca(OH)2 → Ca(OCl)2 + CaCl2 + 2H2O
a) Cl2 + KOHnóng → KCl + KClO3 + H2O
b) FeS2 + H2SO4 đặc nóng → Fe2(SO4)3 + SO2 + H2O
Lời giải:
a)
Cl2 vừa là chất khử, vừa chất oxi hoá
: quá trình oxi hoá
: quá trình khử
3Cl2 + 6KOHnóng → 5KCl + KClO3 + 3H2O
b)
FeS2 là chất khử, H2SO4 là chất oxi hoá
: quá trình oxi hoá
: quá trình khử
2FeS2 + 14H2SO4 đặc nóng → Fe2(SO4)3 + 15SO2 + 14H2O
Xem thêm các câu hỏi ôn tập Hóa chọn lọc, hay khác:
1000 câu hỏi ôn tập môn Hóa có đáp án (Phần 9)
1000 câu hỏi ôn tập môn Hóa có đáp án (Phần 10)
1000 câu hỏi ôn tập môn Hóa có đáp án (Phần 11)
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)