1000 câu hỏi ôn tập môn Hóa có đáp án (Phần 11)
Bộ 1000 câu hỏi ôn tập môn Hóa có đáp án Phần 11 hay nhất được biên soạn và chọn lọc giúp bạn ôn luyện và đạt kết quả cao trong bài thi môn Hóa.
1000 câu hỏi ôn tập Hóa (Phần 11)
a) Tính nguyên tử khối, cho biết tên và kí hiệu hóa học của nguyên tố X.
b) Tính phần trăm về khối lượng của nguyên tố X trong hợp chất.
Lời giải:
a) Phân tử gồm 1X và 4H
Phân tử khối của hợp chất trên: MX + 4 = 16.
Nguyên tử khối của X = 16 – 4 = 12 đvC.
Vậy X là nguyên tố cacbon: C
b) Phần trăm về khối lượng cacbon có trong CH4 là:
%mC=1212+4.100%=75%
Lời giải:
- Trích mẫu thử, đánh số thứ tự.
- Cho các mẫu thử trên vào nước:
+ Nếu mẫu thử nào không tan là CaCO3
+ Nếu mẫu thử nào tan tạo dung dịch đục là: CaO
+ Nếu mẫu thử nào tan tạo dung dịch trong suốt là Na2O, P2O5
PTHH: Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
P2O5 + 3H2O → 2H3PO4
- Nhỏ các dung dịch trong suốt thu được vào mẫu giấy quì tím:
+ Nếu dung dịch nào làm quì tím đổi màu đỏ: H3PO4 → Chất rắn ban đầu là P2O5
+ Nếu dung dịch nào làm quì tím đổi màu xanh: NaOH → Chất rắn ban đầu là Na2O.
Câu 3: Hãy nhận biết 3 dung dịch không màu HCl, H2SO4 loãng, Na2SO4?
Lời giải:
Trích các mẫu thử và có đánh số lần lượt:
- Cho quỳ tím vào lần lượt các mẫu thử:
+ Mẫu thử làm quỳ tím hoá đỏ là HCl, H2SO4
+ Mẫu thử không làm quỳ tím chuyển màu là Na2SO4
- Cho dung dịch BaCl2 vào 2 mẫu thử làm quỳ tím hoá đỏ:
+ Dung dịch nào có kết tủa trắng là dung dịch chứa H2SO4
+ Dung dịch nào không có hiện tượng gì là HCl
PTHH: BaCl2 + H2SO4 → 2HCl + BaSO4↓
Lời giải:
Hợp chất A gồm nguyên tử nguyên tố Y liên kết với 3 nguyên tử oxi:
→ CTHH của hợp chất A là: YO3
YxO3 nặng gấp 5 lần nguyên tử oxi:
→MYO3MO=5→MY+16.316=5→MY=32(g/mol)
→ Y là lưu huỳnh
→ CTHH: SO3.
Lời giải:
Đáp án đúng là: B
nCO2=8,9622,4=0,4(mol), nH2O=8,6418=0,48(mol)X:CnH2n+1COOH(k1=1)Y:CxHyOH(k2≥0)Z:CnH2n+1COOCxHy(k3≥1)(X,Y,Z)+O2t°→CO2+H2O
Ta có:
(1−1)nX+(k2−1)nY+(k3−1)⏟≥0nZ=nCO2⏟0,4−nH2O⏟0,48⇒{k2=0;k3=1nZ=0,08
Câu 6: Phân tử A gồm 2 nguyên tử nguyên tố X liên kết với 1 nguyên tử oxi và nặng hơn phân tử hidro 47 lần.
a) Tính phân tử khối của chất A
Lời giải:
a) Phân tử A nặng hơn phân tử hidro 47 lần nên PTK của A bằng 47. 2. 1 = 94 (đvC)
b) Phân tử A gồm 2 nguyên tử nguyên tố X liên kết với 1 nguyên tử oxi nên A có công thức hoá học là X2O.
→ 2. NTK X + 16 = 94 → NTK X = 39 (đvC)
Vậy X là kali, kí hiệu hoá học là K.
c) Chất A là hợp chất vì được tạo nên từ 2 nguyên tố hoá học là kali và oxi.
CTHH của A là K2O.
Câu 7: Cân bằng phản ứng hoá học:
CH3CH2OH + KMnO4 + H2SO4 → CH3COOH + MnSO4 + H2O + K2SO4
Lời giải:
CH3−1CH2OH + K+7MnO4+ H2SO4→ CH3+3COOH ++2 MnSO4+ H2O + K2SO4
Chất khử: CH3CH2OH; chất oxi hoá: KMnO4.
Ta có các quá trình:
5×4×|−1C→+3C+4e+7Mn+5e→+2Mn
Phương trình hoá học:
5CH3CH2OH + 4KMnO4 + 6H2SO4 → 5CH3COOH + 4MnSO4 +11H2O + 2K2SO4
Lời giải:
Đáp án đúng là: C
nHCl = 0,2. 1 = 0,2 (mol); nHCl = 0,2. 1 = 0,2 (mol)
nH+=nHCl=0,2(mol)nNa+=nNaCl=0,2(mol)nCl−=nHCl+nNaCl=0,2+0,2=0,4(mol)
Câu 9: Nung 1kg đá vôi chứa 80% CaCO³ thu được 112 dm³ (đkct). Tính hiệu suất phân hủy đá vôi?
Lời giải:
1 kg = 1000 g
112 dm3 = 112 lít
→nCO2=11222,4=5(mol)
mCaCO3trong đá vôi = 1000.80100=800(g)
PTHH: CaCO3t°→CaO+CO2
Theo PTHH: nCaCO3=nCO2=5(mol)
mCaCO3phân huỷ = 5. 100 = 500 (g)
H=mCaCO3phanhuymCaCO3davoi.100%=500800.100%=62,5%
Câu 10: Khí metan có phân tử gồm 1 nguyên tử C và 4 nguyên tử H. Phân tử khối của metan bằng bao nhiêu?
Lời giải:
Đáp án đúng là: C
Khí metan có phân tử gồm 1 nguyên tử C và 4 nguyên tử H nên CTHH của metan là CH4.
Phân tử khối của metan bằng 12 + 1. 4 = 16 đvC.
Lời giải:
Đáp án đúng là: A
A+HCl→ACl+12H2x.............................0,5x(mol)B+2HCl→BCl2+H2y.................................y(mol)nH2=0,5x+y=0,25(mol)
→ 0,25 < x + y < 0,5
→7,10,5<ˉM<7,10,25→14,2<ˉM<28,4
Chỉ có cặp nghiệm A = 23 (Na), B = 24 (Mg) thoả mãn.
Câu 12: Hiện tượng hoá học khác với hiện tượng vật lý là:
C. Chỉ biến đổi về trạng thái;
Lời giải:
Đáp án đúng là: B
Hiện tượng hoá học khác với hiện tượng vật lý là có sinh ra chất mới.
a) Viết phương trình chữ của phản ứng trên?
c) Tính khối lượng khí hiđro thu được?
Lời giải:
a) Phương trình chữ:
Kẽm + axit clohidric → Kẽm clorua + khí hiđro
b) Phương trình hoá học:
Zn + 2HCl → ZnCl2 + H2
c) Áp dụng định luật bảo toàn khối lượng, ta có:
mZn+mHCl=mZnCl2+mH2→mH2=mZn+mHCl−mZnCl2→mH2=6,5+7,2−13=0,7(g)
Lời giải:
Khối lượng muối có trong 400 gam dung dịch nước muối 20% là: 400.20100=80(g)
Khối lượng dung dịch sau khi đổ thêm nước lã là: 80.10010=800(g)
Số gam nước lã cần đổ thêm là: 800 – 400 = 400 (g)
Câu 15: Điều nào sau đây không đúng cho phản ứng của khí CO và O2?
C. Phản ứng kèm theo sự giảm thể tích;
D. Phản ứng không xảy ra ở điều kiện thường.
Lời giải:
Đáp án đúng là: A
Phát biểu A sai vì phản ứng giữa CO và O2 là phản ứng toả nhiệt.
Lời giải:
Đáp án đúng là: C
Số khối của đồng vị thứ nhất là: 79
Số khối của đồng vị thứ hai là: 79 + 2 = 81.
Một cách gần đúng, coi số khối xấp xỉ nguyên tử khối.
Nguyên tử khối trung bình của X là: 79.27+81.2350=79,92
Câu 17: Trong các phản ứng sau:
(4) dung dịch NaHCO3 + Ba(OH)2
(5) dung dịch (NH4)2SO4 + Ca(OH)2
Số phản ứng có tạo đồng thời cả kết tủa và khí bay ra
Lời giải:
Đáp án đúng là: D
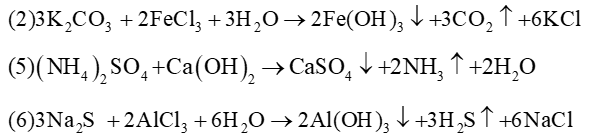
Lời giải:
nH2=1,45622,4=0,065(mol)2+1H+2e→0H20O2+4e→2−2OnO2=2.0,0654=0,0325(mol)
moxit = 2,292+0,0325.32=2,185(g)
Lời giải:
Gọi ZA, ZB lần lượt là số proton của A, B (ZA, ZB > 0)
Hợp chất X có dạng A2B5
Ta có:
Tổng số hạt proton trong phân tử là 70 → 2ZA + 5ZB = 70 (1)
Số hạt mang điện trong A nhiều hơn số hạt mang điện trong B là 14
→ 2ZA - 2ZB = 14 (2)
Giải (1), (2), ta được: ZA = 15, ZB = 8.
Câu 20: Cho kim loại M tạo ra hợp chất MSO4 . Biết phân tử khối là 120. Xác định kim loại M:
Lời giải:
Đáp án đúng là: A
Vì phân tử khối của hợp chất là 120 nên:
NTK M + 32 + 16. 4 = 120 → NTK M = 24 đvC
Vậy M là magie.
Câu 21: Trong nguyên tử hạt mang điện tích âm là:
Lời giải:
Đáp án đúng là: A
Trong phân từ hạt mang điện tích âm là electron
Hạt mang điện tích dương là proton.
Hạt không mang điện là nơtron.
Lời giải:
Đáp án đúng là: C
Trong công thức hoá học của sắt (III) oxit là Fe2O3 có sắt hoá trị III.
Trong công thức hoá học của hidro clorua là HCl có clo hoá trị I vì có 1 nguyên tử Cl liên kết với 1 nguyên tử H.
Goị CTHH đúng của sắt (III) clorua là IIIFexICly
Áp dụng quy tắc hoá trị, ta có: III. x = I. y
→xy=IIII=13→{x=1y=3
Vậy CTHH đúng của sắt (III) clorua là FeCl3.
Lời giải:
Đáp án đúng là: B
Đơn chất là chất được tạo nên từ 1 nguyên tố hoá học
Ví dụ: Mg, K, S, C, N2,….
Câu 24: Từ công thức hóa học của CuSO4 có thể suy ra được những gì?
A. CuSO4 do 3 nguyên tố Cu, O, S tạo nên;
B. Có 3 nguyên tử oxi trong phân tử;
Lời giải:
Đáp án đúng là: A
Từ công thức hóa học của CuSO4 có thể suy ra được:
- CuSO4 do 3 nguyên tố Cu, O, S tạo nên
- Trong phân tử có 1 nguyên tử Cu, 1 nguyên tử S, 4 nguyên tử O
- Phân tử khối CuSO4 là: 64 + 32 + 16. 4 = 160 đvC.
Lời giải:
Gọi p, n và e lần lượt là số proton, neutron và electron của nitrogen. Trong đó p = e.
Số hạt không mang điện chiếm 33,33%
⇒ số neutron = n=33,33100.21=7 (1)
Lại có: p + e + n = 21 ⇒ 2p + n = 21 (2)
Thế n = 7 vào (2) được p = 7.
Vậy nguyên tử nitrogen có số đơn vị điện tích hạt nhân là 7.
Câu 26: Trong hợp chất của lưu huỳnh, hàm lượng lưu huỳnh chiếm 50%. Hợp chất đó có công thức là:
Lời giải:
Đáp án đúng là: D
Hợp chất có dạng SxOy
→MSxOy=xMS+yMO=32x+16y→%mS=32x32x+16y.100%=50%→32x+16y=64x→y=2x→x:y=1:2
Vậy hợp chất là SO2.
Câu 27: Để phân biệt 3 mẫu hợp kim riêng biệt Mg – Al; Mg – K; Mg – Ag cần dùng tối thiểu mấy hoá chất?
Lời giải:
Để phân biệt 3 mẫu hợp kim riêng biệt Mg – Al; Mg – K; Mg – Ag cần dùng thêm tối thiểu 1 hoá chất là H2O:
Mg−K+H2O→Mg+KOH+12H2
Các hợp kim còn lại không tác dụng với H2O
Cho các hợp kim còn lại vào dung dịch KOH vừa thu được:
2Mg−Al+2KOH+6H2O→2Mg+2K[Al(OH)4]+3H2↑
Còn hợp kim Mg – Ag không có hiện tượng gì.
Lời giải:
Đáp án đúng là: C
dEste/O2=3,125 → Meste = 3,125. 32 = 100 (C5H8O2)
Xà phòng hóa X thu được andehit
→ X có thể là HCOOCH = CH - CH2 - CH3; HCOOCH = C(CH3) - CH3;
CH3COOCH = CH - CH3; C2H5COOCH = CH2
Có 4 CTCT thỏa mãn.
Lời giải:
nFe2O3=16160=0,1(mol)nH2SO4=150.2,94%98=0,045(mol)
Phương trình: Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
Ta thấy:
nFe2O3:1>nH2SO4:3 nên Fe2O3 dư
nFe2(SO4)3=13nH2SO4=0,015(mol)mFe2(SO4)3=0,015.400=6(g)
Lời giải:
Đáp án đúng là: C
Giả sử trong 1 mol hỗn hợp có x mol CO và y mol CO2
Ta có hệ:
{x+y=128x+44y=18,2.2.1→{x=0,475y=0,525
Trong cùng điều kiện tỉ lệ thể tích chính là tỉ lệ mol
%VCO2=0,525.100%1=52,50%
Lời giải:
Theo đề bài ta có phương trình:
MM(OH)3=107⇒MM+(16+1).3=107
→ MM = 56 đvC.
Lời giải:
Gọi P, N và E lần lượt là số proton, neutron và electron của X. Trong đó P = E.
Nguyên tử X có tổng số các loại hạt bằng 52 nên:
P + N + E = 52 hay 2P + N = 52 (1)
Trong nguyên tử X, số hạt mang điện nhiều hơn số hạt không mang điện là 16 hạt nên:
(P + E) – N = 16 hay 2P – N = 16 (2)
Từ (1) và (2) ta có hệ phương trình:
{2P+N=522P−N=16⇒{P=17N=18
Vậy trong X có 17 proton; 17 electron và 18 neutron.
Lời giải:
Đưa nam châm mạnh lại gần hỗn hợp. Sắt bị nam châm hút nên tách được bột sắt khỏi hỗn hợp.
Hoà tan hỗn hợp còn lại vào nước. Lọc dung dịch thu được cát không tan và dung dịch muối. Cô cạn dung dịch muối thu được muối ăn khan.
Câu 34: Số ml dung dịch NaOH có pH = 12 cần để trung hoà 10ml dung dịch HCl có pH = 1 là:
Lời giải:
Đáp án đúng là: C
nNaOH=nHCl=10−3(mol)→VNaOH=10−310−2=10−1(l)=100(ml)
Câu 35: Thực hiện các thí nghiệm sau:
(a) Cho dung dịch NaHCO3 vào dung dịch BaCl2, đun nóng.
(b) Cho kim loại Na vào dung dịch CuSO4.
(c) Nhỏ từ từ dung dịch Ba(OH)2 đến dư vào dung dịch Al2(SO4)3.
(d) Cho hỗn hợp Cu và Fe2O3 (tỉ lệ mol 2 : 1) vào dung dịch HCl dư.
(e) Sục khí CO2 (dư) vào dung dịch NaAlO2.
(f) Cho dung dịch HCl vào dung dịch Na2SiO3 cho đến dư.
Sau khi các phản ứng kết thúc, số thí nghiệm thu được chất kết tủa là:
Lời giải:
Đáp án đúng là: C
(a) 2NaHCO3 + BaCl2 t°→ 2NaCl + BaCO3↓ + CO2↑ + H2O
⟹ Kết tủa BaCO3.
(b) 2Na + 2H2O → 2NaOH + H2 ↑
2NaOH + CuSO4 → Cu(OH)2 ↓ + Na2SO4
⟹ Kết tủa Cu(OH)2
(c) Ba(OH)2 + Al2(SO4)3 → BaSO4 ↓ + Al(OH)3 ↓
Ba(OH)2 + 2Al(OH)3 → Ba(AlO2)2 + 4H2O
⟹ Kết tủa BaSO4
(d) Fe2O3 + 6HCl → 2FeCl3 + 3H2O
1…………………2 mol
Cu + 2FeCl3 → CuCl2 + 2FeCl2
1 ← 2 mol
⟹ Kết tủa là Cu dư
(e) CO2 + NaAlO2 + 2H2O → NaHCO3 + Al(OH)3↓
⟹ Kết tủa Al(OH)3
(f) 2HCl + Na2SiO3 → 2NaCl + H2SiO3↓
⟹ Kết tủa H2SiO3
Vậy có 6 thí nghiệm thu được kết tủa sau phản ứng.
Câu 36: Cho sơ đồ phản ứng sau: BaCO3 + HCl → BaCl2 + H2O + CO2
Chọn nhận định đúng, sau khi lập phương trình hóa học:
A. Tỉ lệ phân tử BaCO3 : HCl = 2 : 1;
B. Tỉ lệ phân tử BaCO3 : HCl = 1 : 2;
C. Tỉ lệ phân tử BaCO3 : HCl = 1 : 3;
D. Tỉ lệ phân tử BaCO3 : HCl = 3 : 1.
Lời giải:
Đáp án đúng là: B
Phương trình hoá học khi cân bằng là BaCO3 + 2HCl → BaCl2 + H2O + CO2
Tỉ lệ phân tử BaCO3 : HCl là 1: 2.
Câu 37: Nêu phương pháp hoá học tách riêng từng kim loại ra khỏi hỗn hợp rắn gồm: Na2CO3, BaCO3, MgCO3?
Lời giải:
- Hoà tan hoàn toàn hỗn hợp vào nước, lọc thu được dung dịch Na2CO3 và hỗn hợp chất rắn gồm BaCO3 và MgCO3. Cho dung dịch Na2CO3 tác dụng với dung dịch HCl dư, sau đó cô cạn dung dịch rồi điện phân nóng chảy thu được Na:
Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
2NaCldpnc→2Na+Cl2
- Hoà tan hỗn hợp rắn gồm BaCO3 và MgCO3 trong dung dịch HCl dư thu được dung dịch chứa MgCl2, BaCl2 và HCl dư:
BaCO3 + 2HCl → BaCl2 + H2O + CO2↑
MgCO3 + 2HCl → MgCl2 + H2O + CO2↑
- Thêm dung dịch Ba(OH)2 dư vào dung dịch sau phản ứng, lọc thu được kết tủa Mg(OH)2:
MgCl2 + Ba(OH)2 → BaCl2 + Mg(OH)2↓
- Lọc kết tủa hoà tan vào dung dịch HCl, cô cạn dung dịch thu được muối khan MgCl2 rồi điện phân nóng chảy thu được kim loại Mg:
Mg(OH)2 + 2HCl → MgCl2 + 2H2O
MgCl2dpnc→Mg+Cl2
- Cho dung dịch còn lại sau khi lọc kết tủa Mg(OH)2 tác dụng với HCl dư. Cô cạn ta được muối khan BaCl2 rồi điện phân nóng chảy thu được Ba:
Ba(OH)2 + 2HCl → BaCl2 + 2H2O
BaCl2dpnc→Ba+Cl2
Câu 38: Ba(HCO3)2 có kết tủa không?
Lời giải:
Ba(HCO3)2 không kết tủa nhưng nếu đem Ba(HCO3)2 nung thì có kết tủa trắng của BaCO3 theo phương trình: Ba(HCO3)2t°→BaCO3↓+H2O+CO2
Câu 39: Dãy gồm các muối đều tan trong nước là:
A. CaCO3, MgCO3, Mg(HCO3)2, K2CO3;
B. CaCO3, NaHCO3, Mg(HCO3)2, Na2CO3;
C. CaCO3, Na2CO3, NaHCO3, MgCO3;
D. Na2CO3, Ca(HCO3)2, Ba(HCO3)2, K2CO3.
Lời giải:
Đáp án đúng là: D
Dãy gồm các muối đều tan trong nước là: Na2CO3, Ca(HCO3)2, Ba(HCO3)2, K2CO3.
Lời giải:
Gọi số proton và nơtron trong nguyên tử Y lần lượt là P, N
Nguyên tử Y có tổng số electron, proton, nơtron là 46, số proton = số electron nên:
2P + N = 46 → N = 46 – 2P (1)
Mà 1≤NP≤1,5(2)
Thay (1) vào (2), ta có:
1≤46−2PP≤1,5⇔P≤46−2P≤1,5P⇔3P≤46≤3,5P⇔463,5≤P≤463⇔13,1≤P≤15,3
→ P = 14 hoặc P = 15
Nếu P = 14 → N = 46 – 2.14 = 18
→ P + N = 14 + 18 = 32 (Loại vì nguyên tử khối của Y bé hơn 32 đvC)
Suy ra P = 15 → N = 46 – 2.15 = 16
→ P + N = 15 + 16 = 31 (Nhận)
Vậy Y là photpho (P).
Câu 41: Cho sơ đồ các phản ứng sau.
e, Na2CO3 + CaCl2 → CaCO3 + NaCl
Lập phương trình hóa học và cho biết tỉ lệ số nguyên tử, số phân tử của các chất trong mỗi phản ứng?
Lời giải:
a, 4Na + O2 t°→ 2Na2O
Số nguyên tử Na : số phân tử O2 : số phân tử Na2O = 4 : 1 : 2
b, P2O5 + 3H2O → 2H3PO4
Số phân tử P2O5 : số phân tử H2O : số phân tử H3PO4 = 1 : 3 : 2
c, 2HgO t°→ 2Hg + O2
Số phân tử HgO : số nguyên tử Hg : số phân tử O2 = 2 : 2 : 1
d, 2Fe(OH)3 t°→ Fe2O3 + 3H2O
Số phân tử Fe(OH)3 : số phân tử Fe2O3 : số phân tử H2O = 2 : 1 : 3
e, Na2CO3 + CaCl2 → CaCO3 + 2NaCl
Số phân tử Na2CO3 : số phân tử CaCl2 : số phân tử CaCO3 : số phân tử NaCl = 1 : 1 : 1 : 2.
Lời giải:
Đáp án đúng là: B
Oxit cao nhất là RO3 → R thuộc nhóm VIA
Hợp chất với hiđro có dạng RH2
MR2MH=94,125,88→MR=32(g/mol)
Đó là nguyên tố lưu huỳnh (S).
Lời giải:
Các công thức viết sai là: Al(NO3)2, HCl2, Ca2Cl, Na2O3.
Sửa:
Al(NO3)2: Vì Al hoá trị III, NO3 hoá trị I → Al(NO3)3
HCl2: Vì H hoá trị I, Cl hoá trị I → HCl
Ca2Cl: Vì Ca hoá trị II, Cl hoá trị I → CaCl2
Na2O3: Vì Na hoá trị I, O hoá trị II → Na2O
Câu 44:
1. Base không tan + Acid → ….. + …..
2. Base không tan bị nhiệt phân huỷ
Lời giải:
1. Base không tan + Acid → Muối + H2O
→ VD: Ba(OH)2 + H2SO4 → BaSO4↓ + 2H2O
2. Base không tan t°→ Basic oxide + H2O
→ VD: Cu(OH)2 t°→ CuO + H2O
Câu 45: Bazơ nào sau đây bị nhiệt phân hủy?
Lời giải:
Đáp án đúng là: A
Bazơ bị nhiệt phân hủy là: Cu(OH)2
Phương trình phản ứng:
Cu(OH)2 t°→ CuO (màu đen) + H2O
Câu 46: Benzen có làm đổi màu quỳ tím không?
Lời giải:
Benzen không làm đổi màu quỳ tím.
Lời giải:
MNa=38,1643.10−271,6605.10−27≈22,98u
Câu 48: Biết S có hoá trị II, hoá trị của magie trong hợp chất MgS là?
Lời giải:
Đáp án đúng là: B
Gọi hoá trị của Mg trong hợp chất MgS là x (x > 0)
Áp dụng quy tắc hoá trị, ta có:
x. 1 = II. 1 → x = II
Vậy hoá trị của Mg trong hợp chất MgS là II.
Câu 49: Cho dãy biến hóa sau :
Ca3(PO4)2+H2SO4→H3PO4+Ca3(PO4)2→Ca(H2PO4)2
Lời giải:
Đáp án đúng là: A
Ca3(PO4)2 + 3H2SO4 → 2H3PO4 + 3CaSO4
Ca3(PO4)2 + 4H3PO4 → 3Ca(H2PO4)2
nH2SO4=2nCa(H2PO4)2=468234.70%.2=5,714(mol)mdd=5,714.9870%≈800(g)
Lời giải:
Gọi p, n và e lần lượt là số proton, neutron và electron của nitrogen. Trong đó p = e.
Số hạt không mang điện chiếm 33,33%
⇒ số neutron = n = 33,33100.2133,33100.21 = 7(1)
Lại có tổng số hạt là 21: p + e + n = 21 ⇒ 2p + n = 21 (2)
Thế n = 7 vào (2) được p = 7.
Vậy nguyên tử nitrogen có số đơn vị điện tích hạt nhân là 7.
Xem thêm các câu hỏi ôn tập Hóa chọn lọc, hay khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)
