50 bài tập về Điều chế các dẫn xuất hiđrocacbon (có đáp án 2024) và cách giải
Với điều chế các dẫn xuất hiđrocacbon và cách giải môn Hóa học lớp 11 gồm phương pháp giải chi tiết, bài tập minh họa có lời giải và bài tập tự luyện sẽ giúp học sinh biết cách làm bài tập điều chế các dẫn xuất hiđrocacbon và cách giải. Mời các bạn đón xem:
Điều chế các dẫn xuất hiđrocacbon và cách giải – Hóa học lớp 11
A. Lý thuyết cần nắm vững
1. Điều chế ancol
- Trong công nghiệp, người ta tổng hợp etanol từ etilen:
- Ngoài ra có thể tổng hợp etanol bằng phương pháp lên men tinh bột, đường.
Tổng quát: (C6H5OH)n C6H12O6 C2H5OH
- Glixerol (C3H5(OH)3) được tổng hợp từ propilen hoặc thủy phân chất béo.
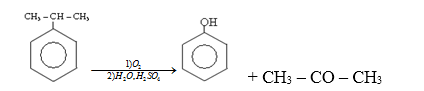
2. Điều chế phenol
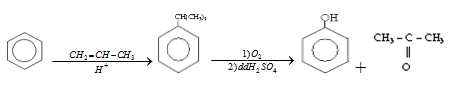
- Cách 1: Oxi hóa cumen theo sơ đồ:
+ 
- Cách 2: Đi từ benzen theo sơ đồ:
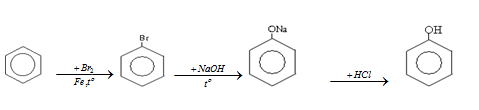
3. Điều chế anđehit
- Từ ancol: oxi hoá ancol bậc I → anđehit
R – CH2OH + CuO R – CHO + H2O + Cu
- Từ hiđrocacbon:
+ Oxi hoá metan: CH4 + O2 HCHO + H2O
+ Oxi hoá hoàn toàn etilen: 2CH2 = CH2 + O2 2CH3CHO
+ Từ C2H2 : CH ≡ CH + H2O CH3CHO
4. Điều chế xeton
- Từ ancol: ancol bậc II Xeton
CH3–CH(OH)–CH3 + CuOCH3–CH–CH3 + Cu + H2O
TQ: R – CH(OH) – R’ + CuOR – CO – R’ + Cu + H2O
- Từ hiđrocacbon:
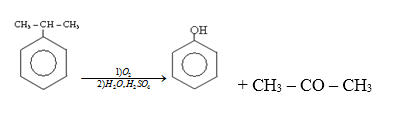
5. Điều chế axit cacboxylic
- Phương pháp lên men giấm: C2H5OH + O2 CH3COOH + H2O
- Oxi hoá anđehit axetic: CH3CHO + O2 2CH3COOH
- Oxi hoá ankan – butan:
2CH3CH2CH2CH3 + 5O2 4CH3COOH + 2H2O
- Từ metanol: CH3OH + CO CH3COOH
6. Điều chế dẫn xuất halogen
Khi thay thế nguyên tử hiđro của phân tử hiđrocacbon bằng nguyên tử halogen ta được dẫn xuất halogen của hiđrocacbon.
Ví dụ: CH4 + Cl2 CH3Cl + HCl.
C2H5OH + HBr C2H5Br + H2O
7. Một số phương pháp giải bài toán điều chế
Phối hợp triệt để các phương pháp:
- Định luật bảo toàn khối lượng.
- Phương pháp tăng giảm khối lượng.
- Phương pháp bảo toàn nguyên tố.
B. Ví dụ minh họa
Ví dụ 1: Dãy gồm các chất đều điều chế trực tiếp (bằng một phản ứng) tạo ra anđehit axetic là
A. CH3COOH, C2H2, C2H4.
B. C2H5OH, C2H4, C2H2.
C. C2H5OH, C2H2, CH3COOC2H5.
D. HCOOC2H3, C2H2, CH3COOH.
Hướng dẫn giải:
CH3– CH2OH + CuO CH3 – CHO + H2O + Cu
2CH2 = CH2 + O2 2CH3CHO
CH ≡ CH + H2O CH3CHO
Đáp án B
Ví dụ 2: Quá trình nào sau đây không tạo ra anđehit axetic?
A. CH2=CH2 + H2O (to, xúc tác HgSO4)
B. CH2=CH2 + O2 (to, xúc tác)
C. CH3-CH2OH +CuO (to).
D. CH3-COOCH=CH2 + dung dịch NaOH (to).
Hướng dẫn giải:
2CH2 = CH2 + O2 2CH3CHO
CH3– CH2OH + CuO CH3 – CHO + H2O + Cu
CH3-COOCH=CH2 + NaOH CH3COONa + CH3CHO.
Đáp án A
Ví dụ 3: Trong công nghiệp, axeton được điều chế từ
A. xiclopropan.
B. propan – 1 – ol.
C. propan – 2 – ol.
D. cumen
Hướng dẫn giải:
Trong công nghiệp, axeton được điều chế bằng cách oxi hóa không hoàn toàn cumen.
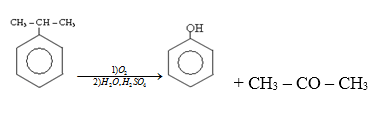
Đáp án D
C. Luyện tập
Câu 1: Khối lượng axit axetic thu được khi lên men 1 lít ancol etylic 8o là bao nhiêu? Biết d = 0,8 g/ml và hiệu suất phản ứng đạt 92%.
A. 58,88 gam.
B. 73,6 gam.
C. 76,8 gam.
D. 90,8 gam.
Hướng dẫn giải:
46g 60g
64g x g
Đáp án C
Câu 2: Khi oxi hóa hoàn toàn 2,2 gam một anđehit đơn chức thu được 3 gam axit tương ứng. Công thức của anđehit là
A. HCHO.
B. CH3CHO.
C. C2H3CHO.
D. C2H5CHO.
Hướng dẫn giải:
Phương trình phản ứng:
RCHO + O2 RCOOH
Theo phương trình hóa học ta có:
nRCHO = nRCOOH
Suy ra: =
Anđehit là CH3CHO.
Đáp án B
Câu 3: Axeton được điều chế bằng cách oxi hóa cumen nhờ oxi, sau đó thủy phân trong dung dịch H2SO4 loãng. Để thu được 145 gam axeton thì lượng cumen cần dùng là bao nhiêu? Biết hiệu suất của phản ứng là 75%.
A. 300 gam.
B. 400 gam.
C. 500 gam.
D. 600 gam.
Hướng dẫn giải:
naxeton = 145 : 58 = 2,5 mol
2,5 2,5 mol
Suy ra khối lượng của cumen là 2,5. 120 = 300 g
Do hiệu suất của phản ứng là 75% nên khối lượng của cumen cần dùng là:
300 : 0,75= 400 g
Đáp án B
Câu 4: Lên men 1 lít ancol etylic 46o thu được giấm ăn. Biết hiệu suất của phản ứng lên men là 100% và khối lượng riêng của ancol etylic là 0,8 g/ml. Khối lượng axit axetic trong giấm là bao nhiêu?
A. 240 g.
B. 280g.
C. 400g.
D. 480g.
Hướng dẫn giải:
Vancol nguyên chất = 1000.0,46 = 460 ml
46g → 60g
368g m=?
Đáp án D
Câu 5: Cho 360 gam glucozơ lên men thành rượu etylic. Cho tất cả khí CO2 sinh ra hấp thụ hoàn toàn vào 2 lít dung dịch NaOH 1M thì thu được 137 gam muối. Hiệu suất của phản ứng lên men rượu là
A. 37,5%.
B. 50%.
C. 75%.
D. 80%.
Hướng dẫn giải:
nglucozơ = 360:180= 2 mol; nNaOH = 2 mol
2 4 mol
CO2 tác dụng với dung dịch kiềm tạo 2 muối là NaHCO3 a (mol) và Na2CO3 b (mol)
Ta có hệ phương trình:
Bảo toàn nguyên tố C ta có:
Hiệu suất phản ứng là:
Đáp án A
Câu 6: Khi lên men 180 gam glucozơ với hiệu suất 100%. Khối lượng ancol etylic thu được là
A. 92 g.
B. 123 g.
C. 145 g.
D. 110 g.
Hướng dẫn giải:
Ta có:
Phương trình phản ứng:
1 2 mol
Đáp án A
Câu 7: Cho m gam một ancol (rượu) no, đơn chức, mạch hở X qua bình đựng CuO (dư), nung nóng. Sau khi phản ứng hoàn toàn, khối lượng chất rắn trong bình giảm 0,32 gam. Hỗn hợp hơi thu được có tỉ khối với hiđro là 15,5. Giá trị của m là
A. 0,32.
B. 0,46.
C. 0,64.
D. 0,92.
Hướng dẫn giải:
Phản ứng của X với CuO:
CnH2n+1OH +CuO CnH2nO + Cu + H2O
Sau phản ứng với CuO, chất rắn ban đầu là CuO chuyển thành Cu nên lượng chất rắn giảm là lượng oxi có trong CuO: mgiảm = moxi = 0,32 gam.
Từ phương trình phản ứng:
nancol = nCnH2nO = nnước = nCuO = nO = 0,32 : 16 = 0,02 mol
Hỗn hợp hơi sau phản ứng gồm H2O, CnH2nO
nhh = nnước + nCnH2nO = 0,02 + 0,02 = 0,04 mol
Vì hỗn hợp có tỉ khối hơi so với H2 là 15,5 nên Mhh = 15,5 . 2 = 31
Suy ra mhh = 31. 0,04 = 1,24 gam
Áp dụng ĐLBTKL:
mancol + mCuO = mhh + mCu
Suy ra mancol = mhh - mgiảm = 1,24 – 0,32 = 0,92 gam
Đáp án D
Câu 8: Cho m gam hỗn hợp X gồm hai rượu (ancol) no, đơn chức, kế tiếp nhau trong dãy đồng đẳng tác dụng với CuO (dư) nung nóng, thu được một hỗn hợp rắn Z và một hỗn hợp hơi Y (có tỉ khối hơi so với H2 là 13,75). Cho toàn bộ Y phản ứng với một lượng dư Ag2O (hoặc AgNO3) trong dung dịch NH3 đun nóng, sinh ra 64,8 gam Ag. Giá trị của m là
A. 7,4.
B. 7,8.
C. 8,8.
D. 9,2.
Hướng dẫn giải:
nAg = 64,8 : 108 = 0,6 mol
RCH2OH +CuO RCHO + Cu + H2O
x x x mol
Ta thấy: nRCHO =
R1 < R < R2 nên R1 = 1 và R2 = 15
2 anđehit là HCHO và CH3CHO và 2 ancol là CH3OH và C2H5OH.
Đáp án B
Câu 9: Oxi hóa 0,08 mol một ancol đơn chức, thu được hỗn hợp X gồm một axit cacboxylic, một anđehit, ancol dư và nước. Ngưng tụ toàn bộ X rồi chia thành hai phần bằng nhau. Phần một cho tác dụng hết với Na dư, thu được 0,504 lít khí H2 (đktc). Phần hai cho phản ứng tráng bạc hoàn toàn thu được 9,72 gam Ag. Phần trăm khối lượng ancol bị oxi hóa là
A. 31,25%.
B. 40%.
C. 50%.
D. 62,5%.
Hướng dẫn giải:
Gọi công thức tổng quát của ancol là RCH2OH
- TH1: R=H
Ta có:
z 0,5z mol
x+y 0,5(x+y) mol
HCOOH + Na HCOONa +
y 0,5y mol
Ta có hệ phương trình:
TH2 : R#H
Ta có hệ phương trình:
loại
Đáp án D
Câu 10: Lên men m gam glucozơ với hiệu suất 72%. Lượng CO2 sinh ra được hấp thu hoàn toàn vào 500 ml hỗn hợp gồm NaOH 0,1 M và Ba(OH)2 0,2 M, sinh ra 9,85 gam kết tủa. Giá trị của m là
A. 25 g.
B. 15 g.
C. 12,96 g.
D. 13 g.
Hướng dẫn giải:
nOH = 0,25 mol; nBa2+ = 0,1 mol; nkết tủa = 0,05 mol
Gọi số mol glucozơ là x mol
Phương trình phản ứng:
x 2x.0,72 mol
+ TH1: OH- dư
Ta có:
+ TH2: Kết tủa tan 1 phần
Đáp án A
Xem thêm các dạng bài tập Hóa học lớp 11 có đáp án và lời giải chi tiết khác:
Dạng 4: Bài tập về phản ứng oxi hóa của anđehit và cách giải
Bài tập về phản ứng este hóa và cách giải
Bài tập về tính axit của axit cacboxylic và cách giải
Bài tập xác định công thức phân tử, công thức cấu tạo, gọi tên axit cacboxylic và cách giải
Bài tập hỗn hợp Ancol, Anđehit, Axit cacboxylic và cách giải
Xem thêm các chương trình khác:
- Tóm tắt tác phẩm Ngữ văn 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Soạn văn 11 (hay nhất) | Để học tốt Ngữ Văn 11 (sách mới)
- Soạn văn 11 (ngắn nhất) | Để học tốt Ngữ văn 11 (sách mới)
- Tác giả tác phẩm Ngữ văn 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Văn mẫu 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Toán 11 | Giải bài tập Toán 11 Học kì 1, Học kì 2 (sách mới)
- Các dạng bài tập Toán lớp 11
- Lý thuyết Toán lớp 11 (sách mới) | Kiến thức trọng tâm Toán 11
- Giáo án Toán lớp 11 mới nhất
- Bài tập Toán lớp 11 mới nhất
- Chuyên đề Toán lớp 11 mới nhất
- Giải sgk Tiếng Anh 11 (thí điểm)
- Giải sgk Tiếng Anh 11 | Giải bài tập Tiếng anh 11 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Tiếng Anh 11 (sách mới) | Sách bài tập Tiếng Anh 11
- Giải sbt Tiếng Anh 11 (thí điểm)
- Giải sgk Lịch sử 11 | Giải bài tập Lịch sử 11 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Lịch Sử 11(sách mới) | Kiến thức trọng tâm Lịch Sử 11
- Giải Tập bản đồ Lịch sử 11
- Giải sgk Vật Lí 11 | Giải bài tập Vật lí 11 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 11 (sách mới) | Sách bài tập Vật Lí 11
- Lý thuyết Vật Lí 11 (sách mới) | Kiến thức trọng tâm Vật Lí 11
- Các dạng bài tập Vật Lí lớp 11
- Giáo án Vật lí lớp 11 mới nhất
- Giải sgk Sinh học 11 | Giải bài tập Sinh học 11 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Sinh học 11 (sách mới) | Kiến thức trọng tâm Sinh 11
- Giải sgk Giáo dục công dân 11
- Lý thuyết Giáo dục công dân 11
- Lý thuyết Địa Lí 11 (sách mới) | Kiến thức trọng tâm Địa lí 11
- Giải Tập bản đồ Địa Lí 11
- Giải sgk Giáo dục quốc phòng - an ninh 11
