50 bài tập về Phản ứng thế, phản ứng cộng của các hiđrocacbon thơm (có đáp án 2025) và cách giải
Với bài tập về phản ứng thế, phản ứng cộng của các hiđrocacbon thơm và cách giải môn Hóa học lớp 11 gồm phương pháp giải chi tiết, bài tập minh họa có lời giải và bài tập tự luyện sẽ giúp học sinh biết cách làm bài tập về phản ứng thế, phản ứng cộng của các hiđrocacbon thơm và cách giải. Mời các bạn đón xem:
Dạng 1: Bài tập về phản ứng thế, phản ứng cộng của các hiđrocacbon thơm và cách giải
A. Lý thuyết và phương pháp giải
1. Phản ứng thế (phản ứng clo hóa, brom hóa, nitro hóa)
- Một số phản ứng hay gặp:
C6H6 + Br2 Fe,to→ C6H5Br + HBr
C6H6 + HNO3 H2SO4,to→ C6H5NO2 + H2O
- Do ảnh hưởng của nhân thơm đối với mạch nhánh, nên khi chiếu sáng toluen tham ra phản ứng thế nguyên tử hiđro ở nhóm CH3.
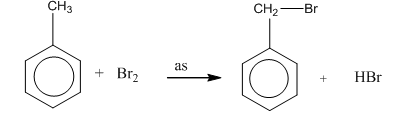
- Toluen tham gia phản ứng brom khi có mặt bột sắt tạo thành hỗn hợp sản phẩm:
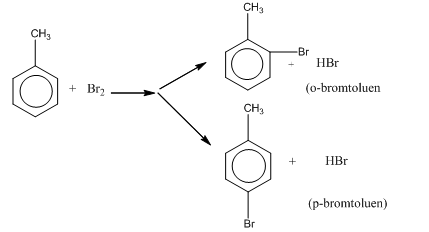
- Phản ứng clo hóa, brom hóa (to, Fe) hoặc phản ứng nitro hóa (to, H2SO4 đặc) đối với hiđrocacbon thơm phải tuân theo quy tắc thế trên vòng benzen.
- Quy tắc thế vào vòng benzen:
+ Nếu vòng benzen đã có sẵn nhóm thế loại I (-OH, ankyl, -NH2 …) thì phản ứng thế xảy ra dễ hơn so với benzen và ưu tiên thế vào vị trí o- và p-.
+ Nếu vòng benzen đã có sẵn nhóm thế loại II (-COOH, -CHO, -CH=CH2) thì phản ứng thế xảy ra khó hơn so với benzen và ưu tiên thế vào vị trí m-.
- Phản ứng clo hóa, brom hóa có thể xảy ra ở phần mạch nhánh no của vòng benzen trong điều kiện có ánh sáng và nhiệt độ.
2. Phản ứng cộng
C6H6+3H2to,Ni→C6H12
C6H6+3Cl2as→C6H6Cl6
- Đối với một số hợp chất có phần mạch nhánh không no có thể tham gia phản ứng cộng ở nhánh.
B. Ví dụ minh họa
Ví dụ 1: Lượng clobenzen thu được khi cho 15,6 gam C6H6 tác dụng hết với clo (có mặt bột Fe) với hiệu suất đạt 80% là
A. 14 gam.
B. 16 gam.
C. 18 gam.
D. 20 gam.
Hướng dẫn giải:
nC6H6pu=15,878.80%=0,16mol
Phương trình phản ứng:
C6H6+Cl2t0,Fe→C6H5Cl+HCl0,16→ 0,16 mol
mC6H5Cl=0,16.112,5=18g
Đáp án C
Ví dụ 2: Hỗn hợp C6H6 và Cl2 có tỉ lệ số mol 1:1,5. Trong điều kiện có mặt bột Fe, to và hiệu suất 100%. Sau phản ứng thu được chất gì với số mol bao nhiêu?
A. 1 mol C6H5Cl; 1 mol HCl; 1 mol C6H4Cl2.
B. 1,5 mol C6H5Cl; 1,5 mol HCl; 0,5 mol C6H4Cl2.
C. 1 mol C6H5Cl; 1,5 mol HCl; 0,5 mol C6H4Cl2.
D. 0,5 mol C6H5Cl; 1,5 mol HCl; 0,5 mol C6H4Cl2.
Hướng dẫn giải:
Tỉ lệ số mol:nCl2nC6H6=1,5→ Phản ứng tạo ra hỗn hợp hai sản phẩm là C6H5Cl và C6H4Cl2.
Phương trình phản ứng:
C6H6+Cl2t0,Fe→C6H5Cl+HClx (1)
(2)
Giả sử có 1 mol C6H6 và 1,5 mol Cl2
Ta có:
Vậy sau phản ứng thu được 0,5 mol C6H5Cl; 1,5 mol HCl; 0,5 mol C6H4Cl2.
Đáp án D
Ví dụ 3: Hiđro hóa 49 gam hỗn hợp A gồm benzen và naphtalen bằng H2 xúc tác thích hợp thu được 39,72 gam hỗn hợp sản phẩm B gồm xiclohexan và đecalin. Biết hiệu suất hiđro hóa benzen và naphtalen lần lượt bằng 70% và 80%. Thành phần % khối lượng của xiclohexan trong B là
A. 29,6%.
B. 33,84 %.
C. 44,41 %.
D. 50,76%.
Hướng dẫn giải:
Gọi số mol benzen và naphtalen lần lượt là x và y
Phương trình phản ứng:
Do hiệu suất của phản ứng là 70% nên số mol xiclohexan là 0,7x (mol)
Do hiệu suất của phản ứng là 80% nên số mol đecalin là 0,8y (mol)
Ta có hệ phương trình:
mxiclohexan = 0,3.0,7. 84 = 17,64 g
% xiclohexan =
Đáp án C
C. Bài tập tự luyện
Câu 1: TNT (2,4,6- trinitrotoluen) được điều chế bằng phản ứng của toluen với hỗn hợp gồm HNO3 đặc và H2SO4 đặc, trong điều kiện đun nóng. Biết hiệu suất của toàn bộ quá trình tổng hợp là 80%. Tính lượng TNT (2,4,6- trinitrotoluen) tạo thành từ 230 gam toluen?
A. 454 gam.
B. 567,5 gam.
C. 397,25 gam.
D. 227 gam.
Hướng dẫn giải:
Số mol toluen tham gia phản ứng: ntoluen = 230 : 94 = 2,5 mol
Phương trình phản ứng:
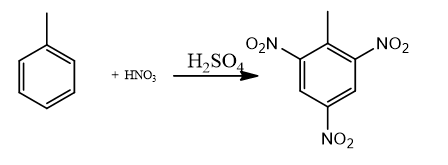
Lượng TNT (2,4,6- trinitrotoluen) tạo thành từ 230 gam toluen:
mTNT = = 454 gam
Đáp án A
Câu 2: Một hợp chất hữu cơ X có vòng benzen có CTĐGN là C3H2Br và M = 236. Gọi tên hợp chất này biết rằng hợp chất này là sản phẩm chính trong phản ứng giữa C6H6 và Br2 (có mặt Fe).
A. o- hoặc p-đibrombenzen.
B. o- hoặc p-đibromuabenzen.
C. m-đibromuabenzen.
D. m-đibromben
Hướng dẫn giải:
Đặt CTPT của hợp chất X là (C3H2Br)n suy ra (12.3+2+80).n = 236 → n = 2.
Do đó công thức phân tử của X là C6H4Br2.
Vì hợp chất X là sản phẩm chính trong phản ứng giữa C6H6 và Br2 (xúc tác Fe) nên theo quy tắc thế trên vòng benzen ta thấy X có thể là o- đibrombenzen hoặc p-đibrombenzen.
Đáp án A
Câu 3: Cho benzen vào 1 lọ đựng clo dư rồi đưa ra ánh sáng. Sau khi phản ứng xảy ra hoàn toàn thu được 5,82 kg chất sản phẩm. Tên của sản phẩm và khối lượng benzen tham gia phản ứng là
A. clohexan; 1,56 kg.
B. hexacloran; 1,56 kg.
C. hexaclobenzen; 6,15kg.
D. hexaclobenzen; 1,65 kg.
Hướng dẫn giải:
Sản phẩm thu được là hexacloran; nhexacloran = 0,02 mol
Suy ra khối lượng của benzen là 0,02.78 = 1,56 g
Đáp án B
Câu 4: Đề hiđro hóa etylbenzen ta được stiren; trùng hợp stiren ta được polistren với hiệu suất chung 80%. Khối lượng etylbenzen cần dùng để sản xuất 10,4 tấn polisitren là
A. 8,48 tấn.
B. 10,6 tấn.
C. 13,25 tấn.
D. 13, 52 tấn.
Hướng dẫn giải:
Sơ đồ phản ứng:
106n 104n gam
x.80% 10,4 tấn
Vậy khối lượng etylbenzen cần dùng là tấn
Đáp án C
Câu 5: A là hiđrocacbon thơm có %C (theo khối lượng) là 92,3%. A tác dụng với dung dịch brom dư cho sản phẩm có %C (theo khối lượng) là 36,36%. Biết MA < 120. Vậy A có công thức phân tử là
A. C2H2.
B. C4H4.
C. C6H6.
D. C8H8.
Hướng dẫn giải:
CTĐGN là CH ⟹ CTPT có dạng CnHn
Theo đề bài, MA < 120 ⟹ 13n < 120 ⟹ n < 9,23
Mặt khác A là hiđrocacbon thơm nên có tối thiểu 6C ⟹ 6 ≤ n < 9,23
Trong phân tử hiđrocacbon, số nguyên tử H là số chẵn nên n = 6 hoặc n = 8
- Nếu n = 6 ⟹ A là C6H6
C6H6 + nBr2 → C6H6-nBrn + nHBr
Ta có phương trình:
n=1,52 (loại)
- Nếu n = 8 ⟹ A là C8H8
C6H5CH=CH2 + Br2 → C6H5CHBr-CH2Br
Ta có phương trình: → Thỏa mãn
Vậy A là C8H8.
Đáp án A
Câu 6: Khi cho clo tác dụng với 78 gam benzen (có mặt bột sắt) người ta thu được 78 gam clobenzen. Hiệu suất của phản ứng là
A. 69,33%.
B. 71%.
C. 72,33%.
D. 79,33.
Hướng dẫn giải:
nbenzen= 1 mol; nclobenzen mol
Hiệu suất của phản ứng là
Đáp án A
Câu 7: Hiđrocacbon X là đồng đẳng của benzen có phần trăm khối lượng cacbon bằng 90,56%. Biết khi X tác dụng với brom có hoặc không có mặt bột sắt trong mỗi trường hợp chỉ thu được một dẫn xuất monobrom duy nhất. Tên của X là:
A. Toluen.
B. 1,3,5-trimetyl benzen.
C. 1,4-đimetylbenzen.
D. 1,2,5-trimetyl benzen.
Hướng dẫn giải:
Đặt công thức phân tử của X là CnH2n-6 (n>6)
Theo giả thiết ta có: %mC = . Suy ra n = 8
Vậy X có công thức phân tử là C8H10.
Vì X tác dụng với brom có hoặc không có mặt bột sắt trong mỗi trường hợp chỉ thu được một dẫn xuất monobrom duy nhất nên tên của X là: 1,4-đimetylbenzen.
Đáp án C
Câu 8: A là dẫn xuất benzen có công thức đơn giản nhất là CH. 1 mol A cộng tối đa 4 mol H2 hoặc 1 mol dung dịch Br2. Tên gọi của A là
A. etylbenzen.
B. metylbenzen.
C. vinylbenzen.
D. ankylbenzen.
Hướng dẫn giải:
A là etylbenzen.
Đáp án A
Câu 9: Hai hiđrocacbon A và B đều có công thức phân tử C6H6 và A có mạch cacbon không nhánh. A làm mất màu dung dịch nước brom và dung dịch thuốc tím ở điều kiện thường. B không tác dụng với 2 dung dịch trên ở điều kiện thường nhưng tác dụng được H2 dư tạo ra D có công thức C6H12. A tác dụng với dung dịch AgNO3 trong NH3 dư tạo ra C6H4Ag2. A và B là
A. hex-1,4-điin và benzen.
B. hex-1,4- điin và toluen.
C. benzen và hex-1,5-điin.
D. hex-1.5-điin và benzen.
Hướng dẫn giải:
- C6H6 có độ bất bão hòa
- A làm mất màu dd brom và dd thuốc tím ở đk thường nên A có cấu trúc mạch hở và các liên kết bội.
- A tác dụng với AgNO3 trong NH3 dư tạo ra C6H4Ag2 nên A có 2 liên kết 3 ở đầu mạch.
- Vì A có cấu tạo mạch không phân nhánh nên CTCT của A là
- B không tác dụng với các dung dịch trên và có thể tác dụng với H2 nên B là benzen.
Đáp án D
Câu 10: Cho 100 ml benzen (d=0,879 g/ml) tác dụng với một lượng vừa đủ brom lỏng (có mặt bột sắt, đun nóng) thu được 80 ml brombenzen (d=1,495g/ml). Hiệu suất brom hóa đạt là
A. 65,35%.
B. 67,6%
C. 73,49%.
D. 85,3%.
Hướng dẫn giải:
Phương trình phản ứng:
Đáp án B
Xem thêm các dạng bài tập Hóa học lớp 11 có đáp án và lời giải chi tiết khác:
Dạng 2: Bài tập về phản ứng oxi hóa của các hiđrocacbon thơm và cách giải
Các dạng toán về Hidrocacbon thơm và cách giải
Phương pháp tăng giảm số mol trong giải toán hiđrocacbon và cách giải
Bảo toàn mol pi trong giải toán hiđrocacbon và cách giải
Bảo toàn khối lượng, bảo toàn nguyên tố trong giải toán hiđrocacbon và cách giải
Xem thêm các chương trình khác:
- Tóm tắt tác phẩm Ngữ văn 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Soạn văn 11 (hay nhất) | Để học tốt Ngữ Văn 11 (sách mới)
- Soạn văn 11 (ngắn nhất) | Để học tốt Ngữ văn 11 (sách mới)
- Tác giả tác phẩm Ngữ văn 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Văn mẫu 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Toán 11 | Giải bài tập Toán 11 Học kì 1, Học kì 2 (sách mới)
- Các dạng bài tập Toán lớp 11
- Lý thuyết Toán lớp 11 (sách mới) | Kiến thức trọng tâm Toán 11
- Giáo án Toán lớp 11 mới nhất
- Bài tập Toán lớp 11 mới nhất
- Chuyên đề Toán lớp 11 mới nhất
- Giải sgk Tiếng Anh 11 (thí điểm)
- Giải sgk Tiếng Anh 11 | Giải bài tập Tiếng anh 11 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Tiếng Anh 11 (sách mới) | Sách bài tập Tiếng Anh 11
- Giải sbt Tiếng Anh 11 (thí điểm)
- Giải sgk Lịch sử 11 | Giải bài tập Lịch sử 11 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Lịch Sử 11(sách mới) | Kiến thức trọng tâm Lịch Sử 11
- Giải Tập bản đồ Lịch sử 11
- Giải sgk Vật Lí 11 | Giải bài tập Vật lí 11 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 11 (sách mới) | Sách bài tập Vật Lí 11
- Lý thuyết Vật Lí 11 (sách mới) | Kiến thức trọng tâm Vật Lí 11
- Các dạng bài tập Vật Lí lớp 11
- Giáo án Vật lí lớp 11 mới nhất
- Giải sgk Sinh học 11 | Giải bài tập Sinh học 11 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Sinh học 11 (sách mới) | Kiến thức trọng tâm Sinh 11
- Giải sgk Giáo dục công dân 11
- Lý thuyết Giáo dục công dân 11
- Lý thuyết Địa Lí 11 (sách mới) | Kiến thức trọng tâm Địa lí 11
- Giải Tập bản đồ Địa Lí 11
- Giải sgk Giáo dục quốc phòng - an ninh 11
