50 bài tập về Phenol (có đáp án 2024) và cách giải
Với bài tập trọng tâm về Phenol và cách giải môn Hóa học lớp 11 gồm phương pháp giải chi tiết, bài tập minh họa có lời giải và bài tập tự luyện sẽ giúp học sinh biết cách làm bài tập trọng tâm về Phenol và cách giải. Mời các bạn đón xem:
Bài tập trọng tâm về Phenol và cách giải – Hóa học lớp 11
A. Lý thuyết và phương pháp giải
- Phenol tác dụng với Na hoặc NaOH
*Chú ý: Trong hợp chất X chứa a nhóm -OH gắn trực tiếp với vòng benzen thì:
+ nNaOH = a.nX
+ nNa = a.nX
+ nX =
- Phenol tác dụng với Br2
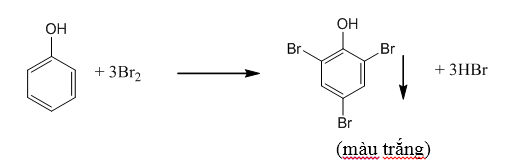
- Phenol tác dụng với HNO3
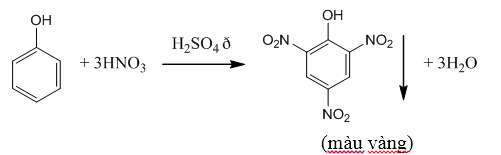
B. Ví dụ minh họa
Ví dụ 1: Cho a gam phenol tác dụng với Na (dư) thu được 11,2 lít H2 (đktc). Mặt khác, cho a gam phenol tác dụng với dung dịch brom (dư) thu được b gam kết tủa. Giá trị của b là
A. 331.
B. 165,5.
C. 662.
D. 124,125.
Hướng dẫn giải
= nkết tủa
mkết tủa = b = 1.331 = 331 g
Đáp án A
Ví dụ 2: Cho 47 gam phenol tác dụng với hỗn hợp 75 gam H2SO4 98% và 175 gam HNO3 63%. Biết rằng phản ứng xảy ra hoàn toàn. Khối lượng axit picric thu được là
A. 11,45 gam.
B. 13,36 gam.
C. 114,5 gam.
D. 133,6 gam.
Hướng dẫn giải
*Chú ý: H2SO4 đặc đóng vai trò xúc tác
→ HNO3 dư
→ naxit picric = nphenol = 0,5 mol → maxit picric = 0,5.229 = 114,5 gam
Đáp án C
Ví dụ 3: X là đồng đẳng của phenol đơn chức. Cho 5,4 gam dung dịch X phản ứng với dung dịch brom dư, thu được 17,25 gam hợp chất Y. Biết rằng Y chứa 3 nguyên tử brom trong phân tử và phản ứng xảy ra hoàn toàn. Công thức phân tử của X là
A. C8H9OH.
B. C9H11OH.
C. C7H7OH.
D. C10H13OH.
Hướng dẫn giải
Giả sử (mol) → nHBr = x (mol)
Áp dụng định luật bảo toàn khối lượng, ta có:
5,4 + 160x = 17,25 + 81x
→ x = 0,15 mol
→ (mol) →→X là C7H7OH
Đáp án C
C. Bài tập tự luyện
Câu 1: Hóa chất nào sau đây được sử dụng để phân biệt dung dịch phenol không màu và ancol etylic?
A. Na.
B. Dung dịch brom.
C. Quỳ tím.
D. Đá vôi.
Hướng dẫn giải
Phenol tác dụng với dung dịch brom tạo kết tủa trắng
Ancol etylic không tác dụng với dung dịch brom.
Đáp án B
Câu 2: Cho các phát biểu sau:
(1) Phenol tan nhiều trong dung dịch HCl.
(2) Phenol có tính axit nhưng không làm đổi màu quỳ tím.
(3) Phenol có khả năng tác dụng với dung dịch brom tạo kết tủa trắng.
(4) Có thể phân biệt phenol với ancol etylic bằng dung dịch brom.
Số phát biểu đúng là:
A. 1.
B. 2.
C. 3.
D. 4.
Hướng dẫn giải
(1) Sai. Phenol không tan trong dung dịch HCl.
(2) Đúng. Phenol có tính axit rất yếu nên không làm đổi màu quỳ tím.
(3) Đúng.
(4) Đúng. Phenol tác dụng với dung dịch brom tạo kết tủa trắng, còn ancol etylic không tác dụng với dung dịch brom.
Đáp án C
Câu 3: Dãy gồm với các chất đều tác dụng với phenol là
A. dung dịch NaCl, dung dịch NaOH, kim loại Na.
B. ancol etylic, dung dịch brom, kim loại Na.
C. dung dịch brom, kim loại Na, dung dịch NaOH.
D. dung dịch NaOH, khí metan, ancol etylic.
Hướng dẫn giải
Phenol có khả năng tác dụng với
+ kim loại Na → khí H2
+ dung dịch NaOH
+ dung dịch brom → kết tủa trắng
Đáp án C
Câu 4: Cho dung dịch brom dư vào a gam dung dịch phenol (C6H5OH), thu được 33,1 gam kết tủa. Giá trị của a là
A. 4,7 gam.
B. 9,4 gam.
C. 47 gam.
D. 94 gam.
Hướng dẫn giải
nkết tủa = nphenol = 0,1 mol → mphenol = a = 0,1.94 = 9,4 gam
Đáp án B
Câu 5: Hỗn hợp X gồm ancol etylic, benzen và phenol. Chia 142,2 gam hỗn hợp X thành 2 phần bằng nhau.
Phần 1: tác dụng vừa đủ với 20g NaOH.
Phần 2: tác đụng với kim loại Na (dư) thu được 6,72 lít H2 (đktc).
Thành phần % khối lượng của phenol và benzen trong hỗn hợp X lần lượt là
A. 27,43% và 66,10%.
B. 66,10% và 27,43%.
C. 6,47% và 27,43%.
D. 27,43% và 6,47%.
Hướng dẫn giải
Gọi số mol của ancol etylic và phenol trong mỗi phần lần lượt là a và b.
- Phần 1 + NaOH: chỉ phenol tác dụng với NaOH
nNaOH = 0,5 mol→ b = nNaOH = 0,5 mol
- Phần 2 + Na → H2
→
Mà b = 0,5 mol → a = 0,1 mol
Vậy %mphenol =
%mancol etylic =
%mbenzen = 100 – 6,47 – 66,10 = 27,43%
Đáp án C
Câu 6: Hợp chất hữu cơ X có công thức phân tử là CxHyO2, trong đó oxi chiến 29,09% về khối lượng. Biết rằng X có khả năng tác dụng với dung dịch NaOH theo tỉ lệ mol nX : nNaOH = 1:2. Mặc khác, X có thể tác dụng với hỗn hợp HNO3/H2SO4 đặc theo tỉ lệ mol . Công thức cấu tạo của X là
A. C6H5OH.
B. CH3COOC2H5.
C. CH3COOH.
D. m-OH-C6H4-OH.
Hướng dẫn giải
→ 12x + y = 78
|
x |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
y |
66 |
54 |
42 |
30 |
18 |
6 |
-6 |
|
|
Loại |
Loại |
Loại |
Loại |
Loại |
Thỏa mãn |
Loại |
Vì X tác dụng với tác dụng với dung dịch NaOH theo tỉ lệ mol nX : nNaOH = 1:2 và tác dụng với hỗn hợp HNO3/H2SO4 đặc theo tỉ lệ mol
→ X có 2 nhóm OH đính trực tiếp vào vòng thơm
→ X là m-OH-C6H4-OH
Đáp án D
Câu 7: Cho 14,1 gam phenol tác dụng với HNO3 đặc/H2SO4 đặc dư. Biết rằng lượng axit HNO3 đã lấy dư 15% so với lượng cần thiết. Khối lượng axit HNO3 cần dùng là
A. 189 gam.
B. 28,35 gam.
C.126 gam.
D. 44,75 gam.
Hướng dẫn giải
nphenol = 0,15 mol →
Đáp án A
Câu 8: Cho 4,6 gam hỗn hợp X gồm phenol và crezol tác dụng vừa đủ với 40ml dung dịch NaOH 1M thu được m gam muối. Giá trị của m là
A. 5,48 gam.
B. 6,2 gam.
C. 5,32 gam.
D. 6,92 gam.
Hướng dẫn giải
Phenol: C6H5OH Crezol: CH3-C6H4-OH
Cả 2 chất này đều tác dụng với NaOH theo tỉ lệ mol 1:1
Ta có
→
Áp dụng định luật bảo toàn khối lượng, ta có:
mX + mNaOH = + mmuối
→ mmuối = 4,6 + 0,04.40 – 0,04,18 = 5,48 gam
Đáp án A
Câu 9: Hỗn hợp X gồm 2 phenol A và B là đồng đẳng kế tiếp. Biết rằng 15,5 gam X tác dụng vừa đủ với 500ml dung dịch NaOH 0,3M. Công thức phân tử của 2 phenol lần lượt là
A. C7H7OH và C8H9OH
B. C6H5OH và C7H7OH
C. C8H9OH và C9H11OH
D. C6H5OH và C8H9OH
Hướng dẫn giải
Gọi công thức phân tử chung của 2 phenol là
nNaOH = 0,15mol
0,15 ← 0,15 (mol)
Vậy 2 phenol lần lượt là C6H5OH và C7H7OH
Đáp án B
Câu 10: Cho a gam hỗn hợp X gồm ancol etylic và phenol tác dụng với kim loại Na dư thu được 25,2 gam hỗn hợp hai muối. Mặt khác, a gam hỗn hợp X tác dụng vừa đủ với 100ml dung dịch NaOH 1M. Thể tích khí H2 thoát ra (đktc) là
A. 3,36 lít.
B. 5,376 lít.
C. 2,24 lít.
D. 4,48 lít.
Hướng dẫn giải
Giả sử số mol của ancol etylic và phenol trong X lần lượt là x và y
C2H5OH + Na → C2H5ONa + 1/2 H2
x x 0,5x (mol)
C6H5OH + Na → C6H5ONa + 1/2 H2
y y 0,5y (mol)
mmuối = 68x + 116y = 25,2 gam
Mặt khác, chỉ có phenol tác dụng với dung dịch NaOH
C6H5OH + NaOH → C6H5ONa + H2O
→ = nNaOH = y = 0,1 mol
⇒ x = 0,2 mol → = 22,4.0,5.(x+y) = 3,36 lít
Đáp án A
Xem thêm các dạng bài tập Hóa học lớp 11 có đáp án và lời giải chi tiết khác:
Trắc nghiệm lý thuyết Hóa 11 Chương 9 Anđehit Xeton Axit cacboxylic
Bài tập trọng tâm về Andehit và cách giải
Dạng 2: Bài tập về phản ứng cộng của anđehit và cách giải
Dạng 3: Bài tập về phản ứng tráng gương của anđehit và cách giải
Xem thêm các chương trình khác:
- Tóm tắt tác phẩm Ngữ văn 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Soạn văn 11 (hay nhất) | Để học tốt Ngữ Văn 11 (sách mới)
- Soạn văn 11 (ngắn nhất) | Để học tốt Ngữ văn 11 (sách mới)
- Tác giả tác phẩm Ngữ văn 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Văn mẫu 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Toán 11 | Giải bài tập Toán 11 Học kì 1, Học kì 2 (sách mới)
- Các dạng bài tập Toán lớp 11
- Lý thuyết Toán lớp 11 (sách mới) | Kiến thức trọng tâm Toán 11
- Giáo án Toán lớp 11 mới nhất
- Bài tập Toán lớp 11 mới nhất
- Chuyên đề Toán lớp 11 mới nhất
- Giải sgk Tiếng Anh 11 (thí điểm)
- Giải sgk Tiếng Anh 11 | Giải bài tập Tiếng anh 11 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Tiếng Anh 11 (sách mới) | Sách bài tập Tiếng Anh 11
- Giải sbt Tiếng Anh 11 (thí điểm)
- Giải sgk Lịch sử 11 | Giải bài tập Lịch sử 11 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Lịch Sử 11(sách mới) | Kiến thức trọng tâm Lịch Sử 11
- Giải Tập bản đồ Lịch sử 11
- Giải sgk Vật Lí 11 | Giải bài tập Vật lí 11 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 11 (sách mới) | Sách bài tập Vật Lí 11
- Lý thuyết Vật Lí 11 (sách mới) | Kiến thức trọng tâm Vật Lí 11
- Các dạng bài tập Vật Lí lớp 11
- Giáo án Vật lí lớp 11 mới nhất
- Giải sgk Sinh học 11 | Giải bài tập Sinh học 11 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Sinh học 11 (sách mới) | Kiến thức trọng tâm Sinh 11
- Giải sgk Giáo dục công dân 11
- Lý thuyết Giáo dục công dân 11
- Lý thuyết Địa Lí 11 (sách mới) | Kiến thức trọng tâm Địa lí 11
- Giải Tập bản đồ Địa Lí 11
- Giải sgk Giáo dục quốc phòng - an ninh 11
