TOP 40 câu Trắc nghiệm Hợp chất của cacbon (có đáp án 2023) – Hóa 11
Bộ 40 bài tập trắc nghiệm Hóa lớp 11 Bài 16: Hợp chất của cacbon có đáp án đầy đủ các mức độ giúp các em ôn trắc nghiệm Hóa 11 Bài 16.
Trắc nghiệm Hóa 11 Bài 16: Hợp chất của cacbon
Bài giảng Hóa 11 Bài 16: Hợp chất của cacbon
Câu 1: Nung 13,4g hỗn hợp muối cacbonat của hai kim loại hóa trị II. Sau khi phản ứng xảy ra hoàn toàn thu được 6,8g chất rắn và khí X. Lượng khí X sinh ra cho hấp thụ vào 75 ml dung dịch NaOH 1M. Khối lượng muối khan thu được sau phản ứng là:
A. 4,2g.
B. 5,8g.
C. 6,3g.
D. 6,5g.
Đáp án: C
Giải thích:
Gọi công thức chung của hai muối cacbonat là RCO3.
RCO3 RO + CO2↑
→ Tạo muối axit, NaOH hết.
CO2 + NaOH NaHCO3
→ nmuối = nNaOH = 0,075 mol
→ mmuối = 0,075.84 = 6,3 gam
Câu 2: Sục 1,12 lít CO2 (đktc) vào 200ml dung dịch Ba(OH)2 0,2M. Khối lượng kết tủa thu được là:
A. 5,91g.
B. 19,7g.
C. 78,8g.
D. 98,5g.
Đáp án: A
Giải thích:
→ Tạo hỗn hợp 2 muối.
Câu 3: Để tạo xốp cho một số loại bánh, có thể dùng muối nào sau đây?
A. (NH4)3PO4.
B. NH4HCO3.
C. CaCO3.
D. NaCl.
Đáp án: B
Giải thích:
NH4HCO3 NH3↑ + CO2↑ + H2O
Khi sử dụng bột nở này, khí NH3 và CO2 thoát ra làm cho bánh căng phồng và xốp.
Câu 4: Khi đun nóng dung dịch canxi hiđrocacbonat thì có kết tủa xuất hiện. Tổng các hệ số tỉ lượng trong phương trình hóa học của phản ứng là:
A. 4.
B. 5.
C. 6.
D. 7.
Đáp án: A
Giải thích:
Ca(HCO3)2CaCO3↓ + CO2 + H2O
→ Tổng các hệ số là 4.
Câu 5: Cặp chất nào sau đây không bị nhiệt phân?
A. CaCO3, BaCO3.
B. Ca(HCO3)2, Ba(HCO3)2.
C. Na2CO3, K2CO3.
D. NaHCO3, KHCO3.
Đáp án: C
Giải thích: Muối cacbonat của kim loại kiềm bền với nhiệt.
Câu 6: Chất khí nào sau đây, được tạo ra từ bình chữa cháy và dùng để sản xuất thuốc giảm đau dạ dày?
A. CO2.
B. N2.
C. CO.
D. CH4.
Đáp án: A
Giải thích:
Chất khí được tạo ra từ bình chữa cháy là CO2.
Thuốc giảm đau dạ dày là NaHCO3.
NaOH + CO2 → NaHCO3.
Câu 7: Cho dãy các chất sau: CO2, CO, SiO2, NaHCO3, NH4Cl. Số chất trong dãy tác dụng với dung dịch NaOH loãng ở nhiệt độ thường là:
A. 2.
B. 3.
C. 4.
D. 5.
Đáp án: B
Giải thích:
Các chất thỏa mãn là CO2, NaHCO3 và NH4Cl.
CO2 + 2NaOH → Na2CO3 + H2O
NaHCO3 + NaOH → Na2CO3 + H2O
NH4Cl + NaOH → NH3↑ + NaCl + H2O
Chú ý: SiO2 chỉ phản ứng với dung NaOH đặc nóng hoặc NaOH nóng chảy.
Câu 8: Cho 5,6 lít CO2 (đktc) đi qua 164ml dung dịch NaOH 20% (d = 1,22g/ml) thu được dung dịch X. Cô cạn dung dịch X thì thu được khối lượng chất rắn là:
A. 15,5g.
B. 26,5g.
C. 31g.
D. 46,5g.
Đáp án: D
Giải thích:
→ NaOH dư
→ Chất rắn gồm NaOH dư và muối Na2CO3.
Bảo toàn nguyên tố C:
Bảo toàn nguyên tố Na:
nNaOH dư = 1 – 0,25.2 = 0,5 mol
→ mchất rắn = 0,25.106 + 0,5.40 = 46,5 gam
Câu 9: Hấp thụ hoàn toàn 0,16 mol CO2 vào 2 lít dung dịch Ca(OH)2 0,05M được kết tủa X và dung dịch Y. Khi đó khối lượng dung dịch Y so với khối lượng dung dịch Ca(OH)2 ban đầu sẽ là:
A. tăng 3,04g.
B. tăng 7,04g.
C. giảm 3,04g.
D. giảm 7,04g.
Đáp án: A
Giải thích:
→ Dung dịch Y chỉ có muối Ca(HCO3)2 và kết tủa X là CaCO3
→ Dung dịch sau phản ứng tăng 3,04 gam.
Câu 10: Cho luồng khí CO dư đi qua hỗn hợp gồm CuO, Al2O3, ZnO, Fe2O3, nung nóng, đến khi các phản ứng xảy ra hoàn toàn thu được hỗn hợp rắn có chứa đồng thời
A. Al2O3, Zn, Fe, Cu
B. Al2O3, ZnO, Fe, Cu
C. Al, Zn, Fe, Cu
D. Cu, Al, ZnO, Fe
Đáp án: A
Giải thích:
CO khử các oxit của kim loại sau Al trong dãy hoạt động hóa học.
→ Hỗn hợp rắn thu được gồm: Cu, Al2O3, Zn, Fe.
Câu 11: Hình vẽ sau đây mô tả thí nghiệm điều chế và thu khí Y từ hỗn hợp rắn gồm CaCO3 và CaSO3:
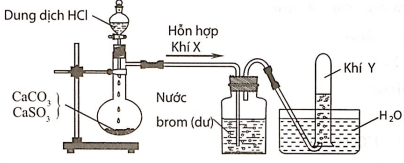
Khí Y là
A. CO2.
B. SO2.
C. H2.
D. Cl2.
Đáp án: A
Giải thích:
Hỗn hợp khí X gồm CO2 và SO2. Khí SO2 khi đi qua bình đựng nước brom đã bị giữ lại, còn khí Y thoát ra là CO2.
Câu 11: Dẫn từ từ CO2 đến dư vào dung dịch Ca(OH)2, hiện tượng quan sát được là
A. có kết tủa, lượng kết tủa tăng dần, kết tủa không tan.
B. không có hiện tượng gì trong suốt quá trình thực hiện.
C. lúc đầu không thấy hiện tượng, sau đó có kết tủa xuất hiện.
D. có kết tủa, lượng kết tủa tăng dần, sau đó kết tủa tan.
Đáp án: D
Giải thích:
Dẫn từ từ CO2 đến dư vào dung dịch Ca(OH)2 xảy ra phản ứng:
CO2 + Ca(OH)2 → CaCO3 + H2O
CO2 + CaCO3 + H2O → Ca(HCO3)2
Hiện tượng quan sát được: Dung dịch xuất hiện kết tủa trắng tăng dần đến cực đại, sau đó kết tủa tan dần đến hết.
Câu 12: Tro thực vật được sử dụng như một loại phân bón cung cấp nguyên tố kali cho cây trồng do chứa muối kali cacbonat. Công thức của kali cacbonat là
A. KCl.
B. KOH.
C. NaCl
D. K2CO3
Đáp án: D
Giải thích: Công thức của kali cacbonat là K2CO3.
Câu 13: Chất nào sau đây tác dụng với dung dịch NaHCO3 sinh ra khí CO2?
A. NaCl.
B. KNO3.
C. KCl.
D. HCl.
Đáp án: D
Giải thích:
HCl + NaHCO3 → CO2↑ + NaCl + H2O
Câu 14: “Nước đá khô” không nóng chảy mà dễ thăng hoa nên được dùng để tạo môi trường lạnh và khô, rất tiện cho việc bảo quản thực phẩm. “Nước đá khô” là
A. SO2 rắn.
B. CO2 rắn.
C. CO rắn.
D. H2O rắn.
Đáp án: B
Giải thích: Nước đá khô là CO2 rắn.
Câu 15: Hấp thụ hoàn toàn 1,568 lít CO2 (đktc) vào 500 ml dung dịch NaOH 0,16M thu được dung dịch X. Thêm 250 ml dung dịch Y gồm BaCl2 0,16M và Ba(OH)2 aM vào dung dịch X thu được 3,94g kết tủa và dung dịch Z. Giá trị của a là:
A. 0,015.
B. 0,02.
C. 0,03.
D. 0,04.
Đáp án: B
Giải thích:
Nhận thấy:
→ Dung dịch Z chứa
Bảo toàn nguyên tố C:
Câu 16: Hấp thụ toàn bộ 0,3 mol CO2 vào dung dịch chứa 0,25 mol Ca(OH)2. Khối lượng dung dịch sau phản ứng tăng hay giảm bao nhiêu gam?
A. tăng 13,2g.
B. tăng 20g.
C. giảm 6,8g.
D. giảm 16,8g.
Đáp án: C
Giải thích:
Ta có:
→ Sau phản ứng thu được hai muối CaCO3 và Ca(HCO3)2
→ Khối lượng dung dịch sau phản ứng giảm 6,8 gam.
Câu 17: Cho 3,36 lít khí CO2 (đktc) vào dung dịch chứa 500 ml KOH 0,1M và Ba(OH)2 0,12M kết thúc phản ứng thu được m gam kết tủa. Giá trị của m là
A. 2,55.
B. 3,94.
C. 1,97.
D. 4,925.
Đáp án: B
Giải thích:
Câu 18: Cho luồng khí CO đi qua ống sứ đựng m gam hỗn hợp X gồm Fe và FexOy, nung nóng. Sau khi phản ứng xảy ra hoàn toàn, thu được 64 gam chất rắn Y trong ống sứ và 11,2 lít hỗn hợp khí có tỉ khối so với hiđro là 20,4. Giá trị của m là
A. 65,6.
B. 72,0.
C. 70,4.
D. 66,5.
Đáp án: C
Giải thích:
Sử dụng phương pháp đường chéo:
và nhỗn hợp khí = 0,5 mol
→
→ nO oxit =
→ mX = 64 + 0,4.16 = 70,4 gam
Câu 19: Cho 10 gam CaCO3 vào dung dịch HCl dư, sau khi phản ứng xảy ra hoàn toàn thu được V lít CO2 (đktc). Giá trị của V là
A. 2,80.
B. 2,24.
C. 1,12.
D. 3,36.
Đáp án: B
Giải thích:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Bảo toàn nguyên tố C ta có:
lít
Câu 20: Cho khí CO2 vào lượng dư dung dịch nào sau đây sẽ tạo kết tủa?
A. MgCl2.
B. Ca(OH)2.
C. Ca(HCO3)2.
D. NaOH.
Đáp án: B
Giải thích:
A và C không phản ứng → loại.
D. CO2 + 2NaOHdư → Na2CO3 + H2O → loại.
B. CO2 + Ca(OH)2 dư → CaCO3↓ + H2O
Câu 21: Cho 8,96 lít CO2 (đktc) sục vào dung dịch chứa 100 ml dung dịch chứa hỗn hợp Ca(OH)2 2M và NaOH 1,5M thu được a gam kết tủa và dung dịch X. Đun nóng kĩ dung dịch X thu được thêm b gam kết tủa. Giá trị (a + b) là
A. 5 gam
B. 15 gam
C. 20 gam
D. 40 gam
Đáp án: C
Giải thích:
Theo bài → dung dịch X gồm các ion
→ dung dịch X
Bảo toàn điện tích →
Câu 22: Khí sinh ra trong trường hợp nào sau đây không gây ô nhiễm không khí ?
A. Quá trình đun nấu, đốt lò sưởi trong sinh hoạt.
B. Quá trình quang hợp của cây xanh.
C. Quá trình đốt nhiên liệu trong động cơ ô tô.
D. Quá trình đốt nhiên liệu trong lò cao.
Đáp án: B
Giải thích:
A. Khi đun nấu, đốt lò sưởi trong sinh hoạt sinh ra khí CO, CO2
→ gây ô nhiễm không khí
B. Quá trình quang hợp của cây xanh sinh ra khí oxi:
6CO2 + 6H2O > C6H12O6 + 6O2
→ không gây ô nhiễm không khí
C. Đốt nhiên liệu trong động cơ ô tô sinh ra khí SO2, H2S, CO2, NOx, …
→ gây ô nhiễm không khí
D. Đốt nhiên liệu trong lò cao sinh ra khí SO2, H2S, CO2, NOx,…
→ gây ô nhiễm không khí
Câu 23: Dẫn 8,96 lít khí CO (đktc) qua 13,44 gam hỗn hợp rắn gồm Fe3O4, Fe2O3 và CuO nung nóng, đến khi phản ứng xảy ra hoàn toàn, thu được m gam rắn X và hỗn hợp khí Y có tỉ khối so với He bằng 9. Giá trị của m là
A. 9,68 gam.
B. 10,24 gam.
C. 9,86 gam.
D. 10,42 gam.
Đáp án: B
Giải thích:
Ta có: hỗn hợp khí Y gồm khí CO và CO2
→ mol
Bảo toàn khối lượng ta có:
mhỗn hợp chất rắn =
→ mX = 0,4.28 + 13,44 – 0,4.9.4 = 10,24 gam
Câu 24: Cho 5,6 lít CO2 (đktc) tan hết trong 200ml dung dịch NaOH nồng độ a M; dung dịch thu được có khả năng tác dụng tối đa 100 ml dung dịch KOH 1M. Giá trị của a là:
A. 0,75.
B. 1,5.
C. 2.
D. 2,5.
Đáp án: C
Giải thích:
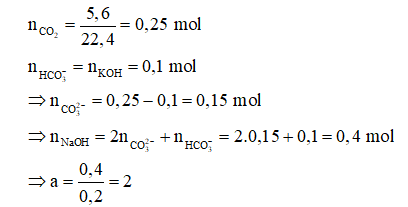
Câu 25: “Hiệu ứng nhà kính” là hiện tượng Trái Đất ấm dần lên do các bức xạ có bước sóng dài trong vùng hồng ngoại bị khí quyển giữ lại mà không bức xạ ra ngoài vũ trụ. Khí nào dưới đây là nguyên nhân chính gây ra hiệu ứng nhà kính?
A. CO2
B. CFC
C. SO2
D. NO2
Đáp án: A
Giải thích: CH4, CO2 là nguyên nhân gây ra hiệu ứng nhà kính.
Câu 26: Về mùa đông, một số người quen dùng bếp than tổ ong để sưởi ấm ở trong phòng kín dẫn đến bị tử vong. Hỏi khí nào chủ yếu gây nên hiện tượng đó?
A. Cl2
B. CO
C. CO2
D. SO2, Cl2 và SO2
Đáp án: B
Giải thích:
CO là sản phẩm tạo thành khi đốt cháy than (C) trong điều kiện thiếu không khí. CO gây độc do nó cạnh tranh với nguyên tử oxi trong hồng cầu.
→ Khi hít phải 1 lượng lớn khí CO sẽ gây tử vong.
Câu 27: Để phòng nhiễm độc CO, là khí không màu, không mùi, rất độc người ta dùng chất hấp thụ là
A. đồng(II) oxit và mangan oxit.
B. đồng(II) oxit và than hoạt tính.
C. than hoạt tính.
D. đồng(II) oxit và magie oxit.
Đáp án: B
Giải thích:
- CuO loại bỏ CO bằng cách tác dụng trực tiếp CO:
CuO + CO → Cu + CO2
- Than hoạt tính loại bỏ CO bằng cách hấp thụ mạnh CO.
Câu 28: CO2 không cháy và không duy trì sự cháy nhiều chất nên được dùng để dập tắt các đám cháy. Tuy nhiên, CO2 không dùng để dập tắt đám cháy nào dưới đây?
A. đám cháy do xăng, dầu.
B. đám cháy nhà cửa, quần áo.
C. đám cháy do magie hoặc nhôm.
D. đám cháy do khí ga.
Đáp án: C
Giải thích:
Các kim loại mạnh như Mg, Al,.. có thể cháy trong khí CO2
2Mg + CO22MgO + C
4Al + 3CO2 2Al2O3 + 3C
Do đó không dùng CO2 để dập tắt đám cháy do Mg, Al.
Câu 29: Natri cacbonat là hóa chất quan trọng trong công nghiệp thủy tinh, bột giặt, phẩm nhuộm, giấy, sợi. Công thức của natri cacbonat là
A. Na2CO3.
B. NaHCO3.
C. MgCO3.
D. CaCO3.
Đáp án: A
Giải thích: Công thức của natri cacbonat là Na2CO3.
Câu 30: Nung CaCO3 ở nhiệt độ cao, thu được chất khí X. Chất X là
A. CaO.
B. H2.
C. CO.
D. CO2.
Đáp án: D
Giải thích:
Khí X là CO2:
CaCO3CaO (rắn) + CO2 (khí)
Các câu hỏi trắc nghiệm Hóa lớp 11 có đáp án, chọn lọc khác:
Trắc nghiệm Silic và hợp chất của silic có đáp án
Trắc nghiệm Công nghiệp silicat có đáp án
Trắc nghiệm Luyện tập: Tính chất của cacbon, silic và các hợp chất của chúng có đáp án
Xem thêm các chương trình khác:
- Trắc nghiệm Sinh học lớp 7 có đáp án
- Trắc nghiệm Toán lớp 7 có đáp án
- Trắc nghiệm Ngữ văn lớp 7 có đáp án
- Trắc nghiệm Sinh học 8 có đáp án
- Trắc nghiệm Toán lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn 8 có đáp án
- Trắc nghiệm Hóa học lớp 8 có đáp án
- Trắc nghiệm Địa Lí lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Tiếng Anh lớp 8 có đáp án
- Trắc nghiệm GDCD lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Lịch sử lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Vật Lí lớp 8 có đáp án
- Trắc nghiệm Công nghệ lớp 8 có đáp án
- Trắc nghiệm Tin học lớp 8 có đáp án
- Trắc nghiệm Sinh học lớp 9 có đáp án
- Trắc nghiệm Toán lớp 9 có đáp án
- Trắc nghiệm Ngữ văn 9 có đáp án
- Trắc nghiệm Hóa học lớp 9 có đáp án
- Trắc nghiệm Địa lí lớp 9 có đáp án
- Trắc nghiệm Tiếng Anh lớp 9 có đáp án
- Trắc nghiệm GDCD lớp 9 có đáp án
- Trắc nghiệm Lịch sử lớp 9 có đáp án
- Trắc nghiệm Vật lí lớp 9 có đáp án
- Trắc nghiệm Công nghệ lớp 9 có đáp án
- Trắc nghiệm Sinh học lớp 10 có đáp án
- Trắc nghiệm Toán lớp 10 có đáp án
- Trắc nghiệm Hóa học lớp 10 có đáp án
- Trắc nghiệm Ngữ văn lớp 10 có đáp án
- Trắc nghiệm Vật Lí lớp 10 có đáp án
- Trắc nghiệm Tiếng Anh lớp 10 có đáp án
- Trắc nghiệm Toán lớp 12 có đáp án
- Trắc nghiệm Sinh học lớp 12 có đáp án
- Trắc nghiệm Hóa học lớp 12 có đáp án
- Trắc nghiệm Ngữ văn lớp 12 có đáp án
- Trắc nghiệm Tiếng Anh lớp 12 có đáp án
- Trắc nghiệm Địa lí lớp 12 có đáp án
- Trắc nghiệm Vật Lí lớp 12 có đáp án
- Trắc nghiệm Công nghệ lớp 12 có đáp án
- Trắc nghiệm Giáo dục công dân lớp 12 có đáp án
- Trắc nghiệm Lịch sử lớp 12 có đáp án
- Trắc nghiệm Giáo dục quốc phòng - an ninh lớp 12 có đáp án
