TOP 40 câu Trắc nghiệm Nitơ (có đáp án 2023) – Hóa 11
Bộ 40 bài tập trắc nghiệm Hóa lớp 11 Bài 7: Nitơ có đáp án đầy đủ các mức độ giúp các em ôn trắc nghiệm Hóa 11 Bài 7.
Trắc nghiệm Hóa 11 Bài 7: Nitơ
Bài giảng Hóa 11 Bài 7: Nitơ
Câu 1: Trong công nghiệp, người ta thường điều chế N2 từ
A. NH4NO2.
B. HNO3.
C. không khí.
D. NH4NO3.
Đáp án: C
Giải thích: Trong công nghiệp, nitơ được điều chế bằng phương pháp chưng cất phân đoạn không khí lỏng.
Câu 2: Trong phòng thí nghiệm, có thể điều chế khí N2 bằng cách đun nóng dung dịch nào dưới đây ?
A. NH3
B. NaNO2
C. NH4Cl
D. NH4NO2
Đáp án: D
Giải thích:
Trong phòng thí nghiệm, điều chế 1 lượng nhỏ nitơ tinh khiết bằng cách đun nóng nhẹ dung dịch bão hòa muối amoni nitrit:
NH4NO2 N2↑ + 2H2O
Câu 3: Ứng dụng nào sau đây không phải của nitơ ?
A. Làm môi trường trơ trong một số ngành công nghiệp.
B. Bảo quản máu và các mẫu vật sinh học.
C. Sản xuất axit nitric.
D. Sản xuất phân lân.
Đáp án: D
Giải thích: Sản xuất phân lân là ứng dụng của axit H3PO4.
Câu 4: Hỗn hợp khí X gồm N2 và H2 có tỉ khối so với H2 là 3,6. Nung nóng X một thời gian trong bình kín (có bột Fe làm xúc tác), thu được hỗn hợp khí Y có tỉ khối đối với H2 là 4. Hiệu suất của phản ứng tổng hợp NH3 là
A. 36%.
B. 25%.
C. 50%.
D. 40%.
Đáp án: B
Giải thích:
Phương trình hóa học:
N2 + 3H2
Xét hỗn hợp X
→ Hiệu suất tính theo N2.
Giả sử nX = 5 mol →
hản ứng = x mol →phản ứng = 3x mol;
→
Câu 5: Khí nitơ có thể được tạo thành bằng phản ứng hoá học nào sau đây ?
A. Nhiệt phân NH4NO2
B. Nhiệt phân AgNO3
C. Nhiệt phân NH4NO3
D. Đốt cháy NH3 trong oxi khi có mặt chất xúc tác Pt
Đáp án: A
Giải thích:
NH4NO2 N2 + 2H2O.
Câu 6: Vị trí của nitơ (N) trong bảng hệ thống tuần hoàn là:
A. ô 14, chu kỳ 2, nhóm VA.
B. ô 14, chu kỳ 3, nhóm IIIA.
C. ô 7, chu kỳ 2, nhóm VA.
D. ô 7, chu kỳ 3, nhóm IIIA.
Đáp án: C
Giải thích: Nitơ nằm ở ô 7, chu kì 2, nhóm VA trong bảng tuần hoàn.
Câu 7: Nguyên tố hóa học nào sau đây thuộc nhóm VA ?
A. Nitơ
B. Clo
C. Cacbon
D. Oxi
Đáp án: A
Giải thích: Các nguyên tố thuộc nhóm VA trong bảng tuần hoàn: N, P, As, Sb,…
Câu 8: Cấu hình electron nguyên tử của nitơ là
A. 1s22s22p1.
B. 1s22s22p5.
C. 1s22s22p63s23p2.
D. 1s22s22p3.
Đáp án: D
Giải thích:
Nguyên tử nitơ có 7 electron
→ Cấu hình electron:
Câu 9: Ở nhiệt độ thường, khí nitơ khá trơ về mặt hóa học. Nguyên nhân là do
A. trong phân tử N2 có liên kết ba rất bền.
B. trong phân tử N2, mỗi nguyên tử nitơ còn 1 cặp electron chưa tham gia liên kết.
C. nguyên tử nitơ có độ âm điện kém hơn oxi.
D. nguyên tử nitơ có bán kính nhỏ.
Đáp án: A
Giải thích:
Phân tử nitơ gồm hai nguyên tử liên kết với nhau bởi một liên kết ba. Mà liên kết ba thì rất bền, ở 3000oC chưa phân hủy rõ rệt thành các nguyên tử.
→ Ở nhiệt độ thường, nitơ khá trơ về mặt hóa học.
Câu 10: Trong phản ứng nào sau đây, nitơ thể hiện tính khử ?
A. N2 + 3H2 2NH3
B. N2 + 6Li ® 2Li3N
C. N2 + O2 2NO
D. N2 + 3Mg Mg3N2
Đáp án: C
Giải thích:
Phản ứng của nitơ với oxi thì nitơ đóng vai trò là chất khử.
+ O2
Câu 11: Khí N2 tác dụng với dãy chất nào sau đây:
A. Li, CuO và O2
B. Al, H2 và Mg
C. NaOH, H2 và Cl2
D. HI, O3 và Mg
Đáp án: B
Giải thích:
Nitơ phản ứng được với một số loại kim mạnh, H2 và O2.
2Al + N2 2AlN
N2 + 3H2 2NH3
N2 + 3Mg Mg3N2
Câu 12: Một bình kín có thể tích là 0,5 lít chứa 0,5 mol H2 và 0,5 mol N2, ở nhiệt độ . Khi ở trạng thái cân bằng có 0,2 mol NH3 tạo thành. Hằng số cân bằng KC của phản ứng tổng hợp NH3 là :
A. 1,278
B. 3,125
C. 4,125
D. 6,75
Đáp án: B
Giải thích:
Trước phản ứng: [H2] = 1M, [N2] = 1M
Sau phản ứng: [NH3] = 0,4M
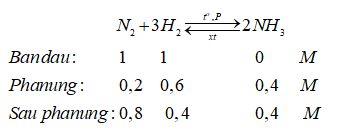
Câu 13: Có thể thu được nitơ từ phản ứng nào sau đây ?
A. Đun nóng dung dịch bão hòa natri nitrit với amoni clorua.
B. Nhiệt phân muối bạc nitrat.
C. Cho bột Cu vào dung dịch HNO3 đặc nóng.
D. Cho muối amoni nitrat vào dung dịch kiềm.
Đáp án: A
Giải thích: NaNO2 + NH4Cl N2↑ + NaCl + 2H2O
Câu 14: Khi có tia lửa điện hoặc ở nhiệt độ cao, nitơ tác dụng trực tiếp với oxi tạo ra hợp chất X. Công thức của X là
A. N2O.
B. NO2.
C. NO.
D. N2O5.
Đáp án: C
Giải thích:
N2 + O2 2NO
Câu 15: Nitơ thể hiện tính khử trong phản ứng với chất nào sau đây ?
A. H2.
B. O2.
C. Mg.
D. Al.
Đáp án: B
Giải thích:
+ O2 2
Trong phản ứng này, số oxi hóa của N tăng từ 0 lên +2 → N2 đóng vai trò là chất khử.
Câu 16: Nung nóng 4,8 gam Mg trong bình phản ứng chứa 1 mol khí N2. Sau một thời gian, đưa bình về nhiệt độ ban đầu, thấy áp suất khí trong bình giảm 5% so với áp suất ban đầu. Thành phần phần trăm Mg đã phản ứng là
A. 37,5%.
B. 25,0%.
C. 50%.
D. 75%.
Đáp án: D
Giải thích:
N2 + 3Mg Mg3N2
→phản ứng = 1- 0,95 = 0,05 mol
→ nMg = 3phản ứng = 0,15 mol
% Mg phản ứng =
Câu 17: Cho vào bình kín 0,2 mol N2 và 0,8 mol H2 với xúc tác thích hợp. Sau một thời gian thấy tạo ra 0,3 mol NH3. Hiệu suất phản ứng được tổng hợp là:
A. 75%
B. 56,25%
C. 75,8%
D. kết quả khác
Đáp án: A
Giải thích:
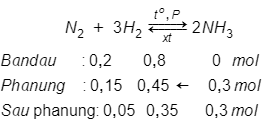
Nhận thấy: → Hiệu suất tính theo N2
→
Câu 18: Trong không khí chứa chủ yếu hai khí nào sau đây?
A.
B.
C.
D.
Đáp án: B
Giải thích: Không khí chứa 78,1% thể tích là N2, oxi chiếm 20,9% thể tích, 1% là hơi nước và các khí khác.
Câu 19: Thể tích N2 (đktc) thu được khi nhiệt phân 40 gam NH4NO2 là
A. 22,4 lít
B. 44,8 lít
C. 14 lít
D. 4,48 lít
Đáp án: C
Giải thích:
Phản ứng nhiệt phân: NH4NO2 N2 + 2H2O.
→
lít
Câu 20: Trong phòng thí nghiệm, để điều chế một lượng nhỏ khí N2, người ta đun nóng dung dịch muối X bão hòa. Muối X là
A. NH4NO2
B. NaNO3
C. NH4Cl
D. NH4NO3
Đáp án: A
Giải thích:
Trong phòng thí nghiệm, điều chế 1 lượng nhỏ nitơ tinh khiết bằng cách đun nóng nhẹ dung dịch bão hòa muối amoni nitrit:
NH4NO2 N2↑ + 2H2O
Câu 21: Khí không màu hóa nâu trong không khí là
A. N2O.
B. NO.
C. NH3.
D. NO2.
Đáp án: B
Giải thích:
Khí NO không màu hóa nâu ngay ngoài không khí.
2NO + O2 → 2NO2
Câu 22: Nitơ là chất khí phổ biến trong khí quyển trái đất và được sử dụng chủ yếu để sản xuất amoniac. Cộng hóa trị và số oxi hóa của nguyên tố N trong phân tử N2 là :
A. 3 và 0
B. 1 và 0
C. 0 và 0
D. 3 và 3
Đáp án: A
Giải thích:
N2 công thức cấu tạo là : N≡N N có cộng hóa trị là 3
N2 là đơn chất N có số oxi hóa là 0
Câu 23: Kim loại nào sau đây có thể tác dụng với khí N2 ở nhiệt độ thường.
A. Li
B. Cs
C. K
D. Ca
Đáp án: A
Giải thích:
Li có thể tác dụng với khí N2 ở nhiệt độ thường.
3Li + N2 → 2Li3N
Câu 24: Hỗn hợp A gồm N2 và H2 theo tỷ lệ thể tích 1:3, tạo phản ứng giữa N2 và H2 sinh ra NH3. Sau phản ứng được hỗn hợp khí B có tỉ khối so với khí A là 10/6. Hiệu suất phản ứng là
A. 80%
B. 50%
C. 70%
D. 85%
Đáp án: A
Giải thích:
Giả sử VA = 10 lít → VB = 6 lít
→ lít và lít
→
→ x = 2 lít
Do tỉ lệ thể tích của N2 và H2 là 1:3 → hiệu suất tính theo khí nào cũng được.
Câu 25: Người ta sản xuất khi nitơ trong công nghiệp bằng cách nào sau đây?
A. Chưng cất phân đoạn không khí lỏng.
B. Nhiệt phân dung dịch NH4NO2 bão hoà.
C. Dùng photpho để đốt cháy hết oxi không khí.
D. Cho không khí đi qua bột đồng nung nóng.
Đáp án: A
Giải thích: Trong công nghiệp, khí N2 được điều chế bằng phương pháp chưng cất phân đoạn không khí lỏng.
Câu 26: Hiệu suất của phản ứng giữa N2 và H2 tạo thành NH3 tăng nếu
A. giảm áp suất, tăng nhiệt độ.
B. giảm áp suất, giảm nhiệt độ.
C. tăng áp suất, tăng nhiệt độ.
D. tăng áp suất, giảm nhiệt độ.
Đáp án: D
Giải thích:
N2 + 3H2 2NH3
Phản ứng điều chế NH3 là phản ứng thuận nghịch và tỏa nhiệt.
→ Tuân thủ theo nguyên lí Lơ Sa-tơ-li-ê
→ Hiệu suất của phản ứng giữa N2 và H2 tạo thành NH3 tăng nếu tăng áp suất, giảm nhiệt độ.
Thực tế, thì điều kiện được áp dụng trong công nghiệp:
– Nhiệt độ: 450 – 500 Ở nhiệt độ thấp hơn, cân bằng hoá học trên chuyển dịch sang phải làm tăng hiệu suất phản ứng, nhưng lại làm giảm tốc độ phản ứng.
– Áp suất cao, từ 200 đến 300 atm.
– Chất xúc tác là sắt kim loại được trộn thêm Al2O3, K2O,…
Câu 27: Ở nhiệt độ thường, nitơ khá trơ về mặt hoạt động là do
A. Nitơ có bán kính nguyên tử nhỏ.
B. Nitơ có độ âm điện lớn nhất trong nhóm.
C. Phân tử nitơ có liên kết ba khá bền.
D. Phân tử nitơ không phân cực.
Đáp án: C
Giải thích: Ở nhiệt độ thường, nitơ khá trơ về mặt hóa học do phân tử nitơ có liên kết ba khá bền.
Câu 28: Khi có tia lửa điện hoặc nhiệt độ cao. Nitơ tác dụng trực tiếp với oxi tạo ra hợp chất X. X tiếp tục tác dụng với oxi trong không khí tạo thành hợp chất Y. Công thức của X, Y lần lượt là
A. N2O, NO.
B. NO2, N2O5.
C. NO, NO2.
D. N2O5, HNO3.
Đáp án: C
Giải thích:
N2 + O2 2NO
2NO + O2 → 2NO2
Câu 29: Để loại bỏ các khí HCl, Cl2, CO2 và SO2 có lẫn trong khí N2 người ta sử dụng lượng dư dung dịch
A. AgNO3.
B. Ca(OH)2.
C. H2SO4.
D. CuCl2.
Đáp án: B
Giải thích:
Để loại bỏ các khí HCl, Cl2, CO2 và SO2 có lẫn trong khí N2 người ta sử dụng lượng dư dung dịch Ca(OH)2 vì các tạp chất khí tác dụng với Ca(OH)2 bị giữ lại trong dung dịch, N2 không phản ứng sẽ thoát ra.
2HCl + Ca(OH)2 → CaCl2 + 2H2O
4Cl2 + 2Ca(OH)2 → CaCl2 + Ca(ClO)2 + 2H2O
CO2 + Ca(OH)2 → CaCO3↓ + H2O
SO2 + Ca(OH)2 → CaSO3↓ + H2O
Câu 30: Nitơ có số oxi hóa âm trong hợp chất với nguyên tố nào sau đây ?
A. H.
B. O.
C. Cl.
D. F.
Đáp án: A
Giải thích: Nitơ có số oxi hóa âm trong hợp chất với nguyên tố H ().
Bài 31: Nung nóng 4,8 gam Mg trong bình phản ứng chứa 1 mol khí N2. Sau một thời gian, đưa bình về nhiệt độ ban đầu, thấy áp suất khí trong bình giảm 5% so với áp suất ban đầu. Thành phần phần trăm Mg đã phản ứng là
A. 37,5%.
B. 25,0%.
C. 50%.
D. 75%.
Đáp án: D
Bài 32: Hỗn hợp N2 và H2 trong bình phản ứng ở nhiệt độ không đổi. Sau thời gian phản ứng, áp suất các khí trong bình thay đổi 5% so với áp suất ban đầu. biết rằng số mol N2 đã phản ứng là 10%. Thành phần phần trăm số mol N2 trong hỗn hợp ban đầu là
A. 20%.
B. 25%.
C. 10%.
D. 5%.
Đáp án: D
Bài 33: Hỗn hợp khi X gồm N2 và H2 có tỉ khối hơi so với He bằng 1,8. Đun nóng trong bình kín một thời gian (có bột Fe làm xúc tác) thu được hỗn hợp khí Y có tỉ khối hơn sô với He bằng 2. Hiệu suất phản ứng tổng hợp NH3 là
A. 10%.
B. 20%.
C. 25%.
D. 5%.
Đáp án: C
Bài 34: Người ta sản xuất khi nitơ trong công nghiệp bằng cách nào sau đây?
A. Chưng cất phân đoạn không khí lỏng.
B. Nhiệt phân dung dịch NH4NO2 bão hoà.
C. Dùng photpho để đốt cháy hết oxi không khí.
D. Cho không khí đi qua bột đồng nung nóng
Đáp án: A
Bài 35: Hiệu suất của phản ứng giữa N2 và H2 tạo thành NH3 tăng nếu
A. giảm áp suất, tăng nhiệt độ.
B. giảm áp suất, giảm nhiệt độ.
C. tăng áp suất, tăng nhiệt độ.
D. tăng áp suất, giảm nhiệt độ.
Đáp án: D
Bài 36: Trong phòng thí nghiệm có thể điều chế N2 bằng cách
A. nhiệt phân NaNO2
B. Đun hỗn hợp NaNO2 và NH4Cl
C. thủy phân Mg3N2
D. phân hủy khí NH3
Đáp án: B
Bài 37: Trong phản ứng nào sau đây, nitơ thể hiện tính khử ?
A. N2 + 3H2 → 2NH3
B. N2 + 6Li → 2Li3N
C. N2 + O2 → 2NO
D. N2 + 3Mg → Mg3N2
Đáp án: C
Bài 38: Khí N2 tác dụng với dãy chất nào sau đây:
A. Li, CuO và O2
B. Al, H2 và Mg
C. NaOH, H2 và Cl2
D. HI, O3 và Mg
Đáp án: B
Bài 39: Hỗn hợp X gồm N2 và H2 có MX = 12,4. Dẫn X đi qua bình đựng bột Fe rồi nung nóng biết hiệu suất tổng hợp NH3 đạt 40% thì thu được hỗn hợp Y. MY có giá trị là :
A. 15,12
B. 18,23
C. 14,76
D. 13,48
Đáp án: C
Bài 40: Một bình kín có thể tích là 0,5 lít chứa 0,5 mol H2 và 0,5 mol N2, ở nhiệt độ (toC). Khi ở trạng thái cân bằng có 0,2 mol NH3 tạo thành. Hằng số cân bằng KC của phản ứng tổng hợp NH3 là :
A. 1.278
B. 3,125
C. 4.125
D. 6,75
Đáp án: B
Các câu hỏi trắc nghiệm Hóa lớp 11 có đáp án, chọn lọc khác:
Trắc nghiệm Amoniac và muối amoni có đáp án
Trắc nghiệm Axit nitric và muối nitrat có đáp án
Xem thêm các chương trình khác:
- Trắc nghiệm Sinh học lớp 7 có đáp án
- Trắc nghiệm Toán lớp 7 có đáp án
- Trắc nghiệm Ngữ văn lớp 7 có đáp án
- Trắc nghiệm Sinh học 8 có đáp án
- Trắc nghiệm Toán lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn 8 có đáp án
- Trắc nghiệm Hóa học lớp 8 có đáp án
- Trắc nghiệm Địa Lí lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Tiếng Anh lớp 8 có đáp án
- Trắc nghiệm GDCD lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Lịch sử lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Vật Lí lớp 8 có đáp án
- Trắc nghiệm Công nghệ lớp 8 có đáp án
- Trắc nghiệm Tin học lớp 8 có đáp án
- Trắc nghiệm Sinh học lớp 9 có đáp án
- Trắc nghiệm Toán lớp 9 có đáp án
- Trắc nghiệm Ngữ văn 9 có đáp án
- Trắc nghiệm Hóa học lớp 9 có đáp án
- Trắc nghiệm Địa lí lớp 9 có đáp án
- Trắc nghiệm Tiếng Anh lớp 9 có đáp án
- Trắc nghiệm GDCD lớp 9 có đáp án
- Trắc nghiệm Lịch sử lớp 9 có đáp án
- Trắc nghiệm Vật lí lớp 9 có đáp án
- Trắc nghiệm Công nghệ lớp 9 có đáp án
- Trắc nghiệm Sinh học lớp 10 có đáp án
- Trắc nghiệm Toán lớp 10 có đáp án
- Trắc nghiệm Hóa học lớp 10 có đáp án
- Trắc nghiệm Ngữ văn lớp 10 có đáp án
- Trắc nghiệm Vật Lí lớp 10 có đáp án
- Trắc nghiệm Tiếng Anh lớp 10 có đáp án
- Trắc nghiệm Toán lớp 12 có đáp án
- Trắc nghiệm Sinh học lớp 12 có đáp án
- Trắc nghiệm Hóa học lớp 12 có đáp án
- Trắc nghiệm Ngữ văn lớp 12 có đáp án
- Trắc nghiệm Tiếng Anh lớp 12 có đáp án
- Trắc nghiệm Địa lí lớp 12 có đáp án
- Trắc nghiệm Vật Lí lớp 12 có đáp án
- Trắc nghiệm Công nghệ lớp 12 có đáp án
- Trắc nghiệm Giáo dục công dân lớp 12 có đáp án
- Trắc nghiệm Lịch sử lớp 12 có đáp án
- Trắc nghiệm Giáo dục quốc phòng - an ninh lớp 12 có đáp án
