Công thức xác định số oxi hóa | Lý thuyết, công thức, các dạng bài tập và cách giải
Với tài liệu về Công thức xác định số oxi hóa bao gồm: lý thuyết và bài tập cũng như những định nghĩa, tính chất, các dạng bài sẽ giúp bạn nắm vững kiến thức và học tốt môn Hóa học hơn.
Công thức xác định số oxi hóa
Để thuận tiện cho việc nghiên cứu phản ứng oxi hóa – khử, người ta dùng số oxi hóa. Vậy số oxi hóa được xác định như thế nào? Bài viết sau đây sẽ các giúp các em tìm hiểu vấn đề này.
1. Cách xác định số oxi hóa
a) Cách biểu diễn
- Số oxi hóa được viết bằng chữ số thường, dấu đặt phía trước và được đặt trên kí hiệu nguyên tố.
- Để biểu diễn số oxi hóa thì viết dấu trước - số sau.
b) Cách xác định: Dựa trên 4 quy tắc
Quy tắc 1: Trong đơn chất số oxi hóa của các nguyên tố bằng 0.
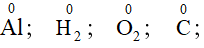
Quy tắc 4: Trong hầu hết các hợp chất:
- Số oxi hóa của H là +1 (trừ hiđrua kim loại NaH, CaH2, thì H có số oxi hóa –1).
- Số oxi hóa của O là -2 (trừ F2O có số oxi hóa +2; và peoxit H2O2, Na2O2 số oxi hóa là –1)
Quy tắc 2: Trong 1 phân tử, tổng số oxi hóa của các nguyên tố nhân với số nguyên tử của từng nguyên tố bằng 0
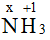 x.1 + (+1).3 = 0 → x = -3
x.1 + (+1).3 = 0 → x = -3
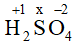 (+1).2 + x.1 + (-2).4 = 0 → x = +6
(+1).2 + x.1 + (-2).4 = 0 → x = +6
Quy tắc 3:
- Trong ion đơn nguyên tử, số oxi hóa của các nguyên tố bằng điện tích của ion đó.
VD: Số oxi hóa của các nguyên tố ở các ion Fe2+; Cl-; S2-; Al3+ lần lượt bằng +2; -1; -2; +3.
- Trong ion đa nguyên tử, tổng số số oxi hóa của các nguyên tố nhân với số nguyên tử của từng nguyên tố bằng điện tích của ion
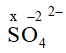 x.1 + (-2).4 = -2 → x = +6
x.1 + (-2).4 = -2 → x = +6
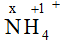 x.1 + (+1).4 = +1 → x = -3
x.1 + (+1).4 = +1 → x = -3
Lưu ý: Ở đây tác giả đảo lại thứ tự các quy tắc so với SGK để thuận tiện cho việc lấy ví dụ cho người đọc dễ hình dung.
Ví dụ: Xác định số oxi hóa của các nguyên tử nguyên tố S, N, Cl trong các chất và ion sau:
Na2SO4; NO3- ; HClO
Hướng dẫn giải:
+) Na2SO4
Na+ có số oxi hóa = +1 (quy tắc 3)
Số oxi hóa của oxi là -2 (quy tắc 4)
Gọi số oxi hóa của S trong Na2SO4 là x
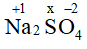 (+1).2 + x.1 + (-2).4 = 0 → x = +6 (quy tắc 2)
(+1).2 + x.1 + (-2).4 = 0 → x = +6 (quy tắc 2)
Vậy số oxi hóa của S trong Na2SO4 là +6
+) NO3-
Số oxi hóa của oxi là -2 (quy tắc 4)
Gọi số oxi hóa của N trong là x
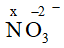 x.1 + (-2).3 = -1 → x = +5 (quy tắc 3)
x.1 + (-2).3 = -1 → x = +5 (quy tắc 3)
Vậy số oxi hóa của N trong là +5
+) HClO
Số oxi hóa của O là -2 (quy tắc 4)
Số oxi hóa của H là +1 (quy tắc 4)
Gọi số oxi hóa của Cl trong HClO là x
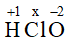 (+1).1 + x + (-2).1 = 0 → x = +1
(+1).1 + x + (-2).1 = 0 → x = +1
Vậy số oxi hóa của Cl trong HClO là +1
2. Bạn nên biết
- Số oxi hóa là điện tích của nguyên tử (điện tích hình thức) trong phân tử nếu giả định rằng các cặp electron chung coi như lệch hẳn về phía nguyên tử có độ âm điện lớn hơn.
- Đối với ion, số oxi hóa bằng chính số điện tích của ion. Quy tắc này áp dụng với cả ion tự do và ion trong các hợp chất.
VD: ion Cl- có số oxi hóa = -1;
ion Na+ có số oxi hóa = +1
→ Trong hợp chất NaCl thì Cl vẫn có số oxi hóa là -1và Na vẫn có số oxi hóa là +1.
3. Mở rộng
Dựa vào sự thay đổi số oxi hóa của nguyên tử trong phản ứng oxi hóa - khử mà ta xác định được sự cho nhận electron.
a) Phản ứng oxi hóa khử:
- Khái niệm: Phản ứng oxi hóa – khử là phản ứng hóa học trong đó có sự chuyển electron giữa các chất phản ứng.
- Dấu hiệu nhận biết: Phản ứng có sự thay đổi số oxi hóa của một nguyên tố.
b) Chất khử, chất oxi hóa
- Chất khử (chất bị oxi hóa): là chất nhường electron.
Dấu hiệu: Số oxi hóa tăng sau phản ứng
- Chất oxi hóa (chất bị khử): Là chất thu electron.
Dấu hiệu: Số oxi hóa giảm sau phản ứng
c) Sự khử, sự oxi hóa
- Sự khử (quá trình khử): là quá trình thu electron
Dấu hiệu: Quá trình làm giảm số oxi hóa.
- Sự oxi hóa: là quá trình nhường electron
Dấu hiệu: Quá trình làm tăng số oxi hóa.
VD: 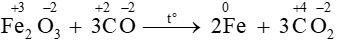
Số oxi hóa của Fe giảm từ +3 về 0 → Fe+3 là chất oxi hóa
Số oxi hóa của C tăng từ +2 lên +4 → C+2 là chất khử
Quá trình khử Fe+3 + 3e -> Fe0
Quá trình oxi hóa C+2 -> C+4 + 2e

4. Bài tập minh họa
Câu 1: Số oxi hóa của Mn trong hợp chất KMnO4 :
A. + 1
B. + 7
C. -7
D. -1
Hướng dẫn giải:
Số oxi hóa của O là -2 (quy tắc 4)
K+ có số oxi hóa = +1 (quy tắc 3)
Gọi số oxi hóa của Mn trong KMnO4 là x
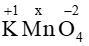 (+1).1 + x.1 + (-2).4 = 0 → x = +7
(+1).1 + x.1 + (-2).4 = 0 → x = +7
Vậy số oxi hóa của Mn trong KMnO4 là +7
Câu 2: Trong hợp chất NaCl và Na2S, clo và lưu huỳnh có số oxi hóa lần lượt bằng
A. -1 và -2.
B. +1 và -2.
C. +1 và +2.
D. -1 và +2
Hướng dẫn giải:
+) NaCl
ion Cl- có số oxi hóa = -1;
ion Na+ có số oxi hóa = +1
+) Na2S
ion Na+ có số oxi hóa = +1
ion S2- có số oxi hóa = -2
Câu 3: Trong phản ứng: 3NO2 + H2O → 2HNO3 + NO
NO2 đóng vai trò
A. là chất oxi hóa.
B. là chất khử.
C. là chất oxi hóa, nhưng đồng thời cũng là chất khử,
D. không là chất oxi hóa và cũng không là chất khử
Hướng dẫn giải:
- Xác định số oxi hóa của các nguyên tố có mặt trong phương trình phản ứng
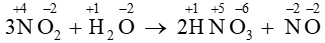
- Ta thấy số oxi hóa của N trong NO2 là +4
tăng lên +5 trong HNO3
giảm về -2 trong NO
→ NO2 là chất oxi hóa, đồng thời là chất khử.
Xem thêm các dạng bài tập và công thức Hoá học lớp 10 hay, chi tiết khác:
50 bài tập về tính chất hóa học, phương pháp điều chế Halogen
50 bài tập về cách nhận biết, tách chất Nhóm Halogen
Các dạng bài toán cách hoàn thành phương trình hóa học về Halogen
Xem thêm các chương trình khác:
- Giải sgk Vật Lí 10 | Giải bài tập Vật lí 10 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 10
- Tóm tắt tác phẩm Ngữ văn 10
- Soạn văn 10 (hay nhất) | Để học tốt Ngữ Văn 10 (sách mới)
- Soạn văn 10 (ngắn nhất) | Để học tốt Ngữ văn 10 (sách mới)
- Văn mẫu lớp 10 (cả ba sách) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Lịch sử 10 | Giải bài tập Lịch sử 10 Học kì 1, Học kì 2 (sách mới)
