Công thức tính hằng số cân bằng | Lý thuyết, công thức, các dạng bài tập và cách giải
Với tài liệu về Công thức tính hằng số cân bằng bao gồm: lý thuyết và bài tập cũng như những định nghĩa, tính chất, các dạng bài sẽ giúp bạn nắm vững kiến thức và học tốt môn Hóa học hơn.
Công thức tính hằng số cân bằng
1. Công thức tính hằng số cân bằng
Xét phản ứng thuận nghịch sau:
aA + bB ⇄ cC + dD
A, B, C, D là những chất khí hoặc những chất tan trong dung dịch.
Khi phản ứng ở trạng thái cân bằng, ta có:
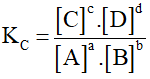
Trong đó:
Kc là hằng số cân bằng
[A], [B], [C], [D] là nồng độ mol của A, B, C, D
a, b, c, d là các hệ số trong phương trình hóa học cân bằng.
2. Bạn nên biết
- Tại trạng thái cân bằng, nồng độ các chất không đổi.
- Hằng số cân bằng Kc xác định chỉ phụ thuộc vào nhiệt độ.
- Hằng số cân bằng là đại lượng không thứ nguyên (không có đơn vị).
3. Mở rộng
Xét cân bằng trong hệ dị thể
Xét hệ cân bằng sau :
C(r) + CO₂ (k) ⇄ 2CO (k)
Nồng độ của chất rắn được coi là hằng số, nên nó không có mặt trong biểu thức hằng số cân bằng K. Đối với cân bằng trên ta có :
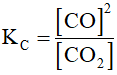
4. Ví dụ minh họa
Câu 1: Cho phản ứng sau: H2(k) + I2(k) ⇄ 2HI(k)
Nồng độ các chất lúc cân bằng ở nhiệt độ 430 như sau: [H2]=[I2]=0,107M; [HI]=0,768M. Hằng số cân bằng KC của phản ứng ở 430 là:
A. 51,96
B. 53,96
C. 51,52
D. 50,34
Hướng dẫn
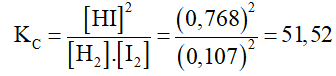
Đáp án C
Câu 2: Một bình phản ứng có dung tích không đổi, chứa hỗn hợp khí N2 và H2 với nồng độ tương ứng là 0,3M và 0,7M. Sau khi phản ứng tổng hợp NH3 đạt trạng thái cân bằng ở , H2 chiếm 50% thể tích hỗn hợp thu được. Hằng số cân bằng Kc ở của phản ứng có giá trị là:
A. 2,500
B. 3,125
C. 0,609
D. 0,500
Hướng dẫn
Ta có: 3H3 + N2 ⇄ 2NH3 (1).
Gọi a là [N2] phản ứng.
Vậy theo phản ứng (1): [H2] phản ứng là 3a; [NH3] phản ứng là 2a.
Khi đạt đến trạng thái cân bằng: [N2] = 0,3 – a, [H2] = 0,7 – 3a
Để đơn giản ta xét 1 lít hỗn hợp.
Sau khi phản ứng đạt cân bằng: 0,3 – a + 0,7 – 3a + 2a = 1 – 2a
Mặt khác %VH2= 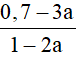 =0,5 -> a= 0,1 mol
=0,5 -> a= 0,1 mol
Khi đạt cân bằng [N2] = 0,3 – 0,1 = 0,2 (M)
[H2] = 0,7 – 0,3 = 0,4 (M)
[NH3] = 0,2 (M).
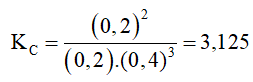
Đáp án B
Câu 3: Cho biết phản ứng sau: H₂O(k) + CO(k) ⇄ H₂(k) + CO₂(k)
Cho ở 700°C hằng số cân bằng Kc = 1,873. Tính nồng độ H2O và CO ở trạng thái cân bằng, biết rằng hỗn hợp ban đầu gồm 0,300 mol H2O và 0,300 mol CO trong bình 10 lít ở 700°C.
A. [H2O]=0,05mol/l; [CO]=0,05 mol/l
B. [H2O]=0,013mol/l; [CO]=0,013 mol/l
C. [H2O]=0,023mol/l; [CO]=0,023 mol/l
D. [H2O]=0,015mol/l; [CO]=0,015 mol/l
Hướng dẫn
Nồng độ các chất ban đầu là: [H2O]=0,03mol/l; [CO]=0,03 mol/l
H2O(k) + CO(k) 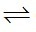 H2(k) + CO2(k)
H2(k) + CO2(k)
bd 0,03 0,03 mol/l
pu x x x x
spu 0,03-x 0,03-x x x
Ta có KC = 1,873
-> 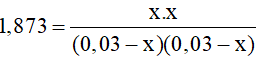
-> 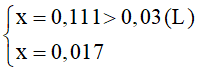
Nồng độ các chất sau phản ứng là:
[H2O]=0,013mol/l; [CO]=0,013 mol/l
Đáp án B
Xem thêm các dạng bài tập và công thức Hoá học lớp 10 hay, chi tiết khác:
Các dạng bài toán tính nồng độ các chất ở trạng thái cân bằng
50 bài tập về tốc độ phản ứng và cân bằng hóa học
Xem thêm các chương trình khác:
- Giải sgk Vật Lí 10 | Giải bài tập Vật lí 10 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 10
- Tóm tắt tác phẩm Ngữ văn 10
- Soạn văn 10 (hay nhất) | Để học tốt Ngữ Văn 10 (sách mới)
- Soạn văn 10 (ngắn nhất) | Để học tốt Ngữ văn 10 (sách mới)
- Văn mẫu lớp 10 (cả ba sách) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Lịch sử 10 | Giải bài tập Lịch sử 10 Học kì 1, Học kì 2 (sách mới)
