Công thức bảo toàn electron | Lý thuyết, công thức, các dạng bài tập và cách giải
Với tài liệu về Công thức bảo toàn electron bao gồm: lý thuyết và bài tập cũng như những định nghĩa, tính chất, các dạng bài sẽ giúp bạn nắm vững kiến thức và học tốt môn Hóa học hơn.
Công thức bảo toàn electron
Công thức bảo toàn electron giúp chúng ta tính toán nhanh gọn và chính xác các bài toán liên quan đến phản ứng oxi hóa - khử. Bài viết dưới đây sẽ giúp các em hiểu rõ vấn đề này.
1. Công thức bảo toàn electron
- Phát biểu định luật: Trong phản ứng oxi hóa khử, tổng số electron nhường luôn bằng tổng số electron nhận
∑enhường = ∑e nhận
Hệ quả: ∑nenhường = ∑nenhận
- Các bước áp dụng:
Bước 1: Viết sơ đồ phản ứng
Bước 2: Xác định chất khử, chất oxi hóa. Viết bán phản ứng. Tính số mol e nhường, nhận.
Bước 3: Áp dụng công thức bảo toàn electron:
∑e nhường = ∑e nhận
Tính toán theo yêu cầu đề bài.
Ví dụ: Cho 7,8g hỗn hợp bột kim loại Mg và Al tác dụng với dd HCl dư thu được 8,96l H2 ở đktc. Khối lượng các kim loại Mg và Al trong hỗn hợp lần lượt là
A. 2,4g và 5,4 g B. 5,4g và 2,4g
C. 1,2g và 5,4g D. 3,9g và 2,6g
Hướng dẫn giải:
Bước 1: Sơ đồ phản ứng 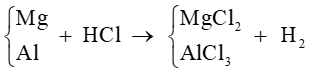
nH2 = 0,4 mol
Bước 2: Viết bán phản ứng
Quá trình oxi hóa: Quá trình khử:
Mg0 -> Mg+2 + 2e 2H+1 + 2e -> H02
x 2x 0,8 - > 0,4 mol
Al0 -> Al+3 + 3e
y 3y mol
∑ne nhường = 2x + 3y
∑nenhận = 0,8 mol
Bước 3: Áp dụng định luật bản toàn electron:
∑nenhường =∑nenhận
→ 2x + 3y = 0,8 (1)
mhỗn hợp = 7,8 gam
→ 24x + 27y = 7,8 (2)
Từ (1) và (2) → 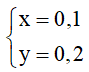 →
→ 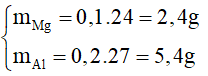
2. Bạn nên biết
Sử dụng linh hoạt định luật bảo toàn electron kết hợp với định luật bảo toàn nguyên tố và định luật bảo toàn khối lượng trong giải bài tập hóa học.
- Định luật bảo toàn khối lượng: “Trong một phản ứng hóa học, tổng khối lượng của các chất sản phẩm bằng tổng khối lượng của các chất tham gia phản ứng”.
Phương trình phản ứng: A + B → C + D
Áp dụng định luật bảo toàn khối lượng: mA + mB = mC + mD
- Định luật bảo toàn nguyên tố: “Tổng số mol nguyên tử của một nguyên tố X bất kỳ trước và sau phản ứng luôn bằng nhau”
3. Mở rộng
- Áp dụng định luật bảo toàn electron tính nhanh các bài toán kim loại phản ứng hết với dung dịch axit
∑ nKl..hóa trị= ∑nkhi(NH4+) . Số e nhận
Trong đó, các sản phẩm khử thường gặp:
|
Khí ( hoặc NH4+) |
NO2 |
NO |
N2O |
N2 |
NH4+ |
H2 |
SO2 |
H2S |
S |
|
Số e nhận |
1 |
3 |
8 |
10 |
8 |
2 |
2 |
8 |
6 |
4. Bài tập minh họa
Câu 1: Hòa tan 7,84 gam Fe vào 200 ml dung dịch hỗn hợp 2 axit HCl 0,15M và H2SO4 0,25M thấy thoát ra V lít khí H2 (đktc). Giá trị của V là
A. 1,456 lít B. 0,45 lít C. 0,75 lít D. 0,55 lít
Hướng dẫn giải:
nFe = 0,14 mol
nH+ = nHCL + 2nH2SO4 0,13 mol
Quá trình oxi hóa (nhường e) Quá trình khử: (nhận e)
Fe0 -> Fe+2 + 2e 2H+1 + 2e -> H02
bài ra: 0,14 -> 0,28 0,13 -> 0,13 -> 0,065
∑ne nhường tối đa = 0,28 mol ∑ne nhận tối đa= 0,13 mol
→ ∑ne nhường tối đa > ∑ne nhận tối đa
→ Fe dư, chuyển hết thành H2
→ nH2 = 0,065 mol → V = 1,456 lít
→ Chọn A
Câu 2: Đốt cháy hoàn toàn 7,2 gam kim loại M (có hóa trị n không đổi trong hợp chất) trong hỗn hợp khí Cl2 và O2. Sau phản ứng thu được 23,0 gam chất rắn và thể tích hỗn hợp khí đã phản ứng là 5,6 lít (đktc). Kim loại M là
A. Mg B. Ca C. Be D. Cu
Hướng dẫn giải:
n hỗn hợp khí = ncl2 + n02= 0,25 mol (1)
Áp dụng định luật bảo toàn khối lượng: mkim loại + mhỗn hợp khí = mrắn
→ mcl2 + mo2= 23 – 7,2 = 15,8 → = 15,8 (2)
Từ (1) và (2) → 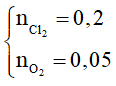
M0 → M+n + ne Cl20 + 2e -> 2Cl-1
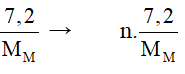 0,2 → 0,4
0,2 → 0,4
O02 + 4e -> 2O-2
0,05 → 0,2
∑ne nhường = 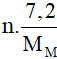 mol ∑ne nhận = 0,6 mol
mol ∑ne nhận = 0,6 mol
Áp dụng định luật bảo toàn electron: ∑nenhường = ∑nenhận
→ 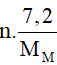 = 0,6 → MM = 12n
= 0,6 → MM = 12n
→ n = 2; MM = 24 (Mg)
→ Chọn A
Câu 3: Hòa tan hoàn toàn 19,2 gam Cu trong dung dịch HNO3 đặc, nóng thu được V lít khí NO2 (đktc). Giá trị của V là
A. 4,48
B. 13,44
C. 8,96
D. 6,72
Hướng dẫn giải:
nCu = 0,3 mol
∑nKl..Hóa trị=∑nkhi(NH4+) . Số e nhận
-> 0,3.2 = 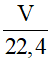 . 1
. 1
-> V = 13,44 lít
-> Chọn B
Xem thêm các dạng bài tập và công thức Hoá học lớp 10 hay, chi tiết khác:
50 bài tập về tính chất hóa học, phương pháp điều chế Halogen
50 bài tập về cách nhận biết, tách chất Nhóm Halogen
Các dạng bài toán cách hoàn thành phương trình hóa học về Halogen
Các dạng bài toán Kim loại tác dụng với Halogen
Các dạng bài toán Halogen tác dụng với muối của halogen yếu hơn
Xem thêm các chương trình khác:
- Giải sgk Vật Lí 10 | Giải bài tập Vật lí 10 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 10
- Tóm tắt tác phẩm Ngữ văn 10
- Soạn văn 10 (hay nhất) | Để học tốt Ngữ Văn 10 (sách mới)
- Soạn văn 10 (ngắn nhất) | Để học tốt Ngữ văn 10 (sách mới)
- Văn mẫu lớp 10 (cả ba sách) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Lịch sử 10 | Giải bài tập Lịch sử 10 Học kì 1, Học kì 2 (sách mới)
