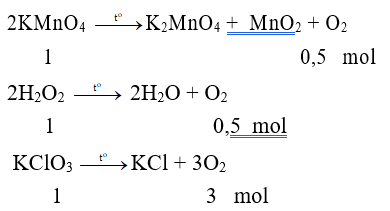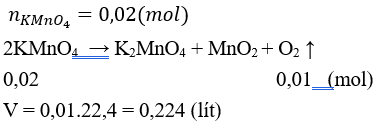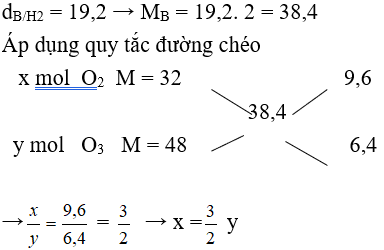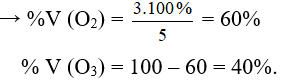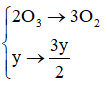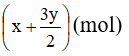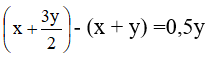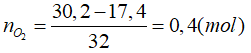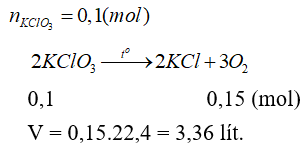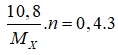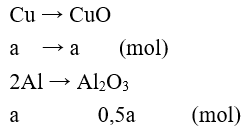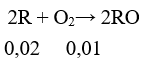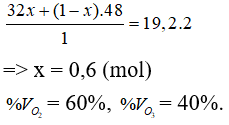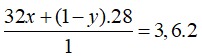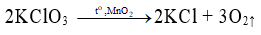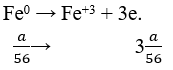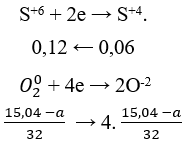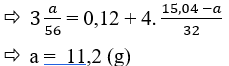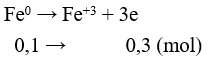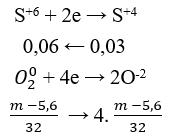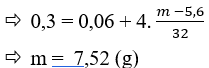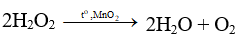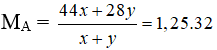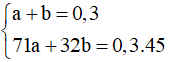50 bài tập về Oxi | Lý thuyết, phương pháp và cách giải mở rộng
Với tài liệu 50 bài tập về Oxi về bao gồm: lý thuyết và bài tập cũng như những định nghĩa, tính chất, các dạng bài sẽ giúp bạn nắm vững kiến thức và học tốt môn Hóa học hơn.
50 bài tập về Oxi
Câu 1: Vị trí của nguyên tố oxi (z = 8) trong bảng tuần hoàn hóa học là
A. Ô thứ 8, chu kì 3, nhóm VIA.
B. Ô thứ 8, chu kì 2, nhóm VIA.
C. Ô thứ 16, chu kì 3, nhóm VIA.
D. Ô thứ 16, chu kì 2, nhóm VIA.
Lời giải:
Đáp án B.
Cấu hình electron của oxi: 1s22s22p4
Oxi thuộc ô thứ 8 (do z = 8), chu kỳ 2 (do có 2 lớp e), nhóm VIA (do có 6e hóa trị, nguyên tố p).
Câu 2: Nguyên tử oxi có cấu hình electron là 1s22s22p4. Cấu hình electron của ion oxit O2- là
A. 1s22s22p2. B. 1s22s22p63s2.
C. 1s22s22p6. D. 1s22s22p43s2.
Lời giải:
Đáp án C.
O + 2e → O2-
→ Cấu hình electron của O2- là: 1s22s22p6.
Câu 3: Để phân biệt khí oxi và ozon, có thể dùng hóa chất là
A. hồ tinh bột.
B. dung dịch KOH và hồ tinh bột.
C. khí hiđro.
D. dung dịch KI và hồ tinh bột.
Lời giải:
Đáp án D.
2KI + O3 + H2O → I2 ↓ + 2KOH + O2 ↑
I2 làm xanh hồ tinh bột.
Câu 4: Oxi không tác dụng với kim loại nào sau đây?
A. Mg. B. Al.
C. Fe. D. Au.
Lời giải:
Đáp án D.
Oxi phản ứng với hầu hết các kim loại trừ Au, Pt ...
2Mg + O2 → 2MgO
4Al + 3O2 → 2Al2O3
3Fe + 2O2 → Fe3O4
Câu 5: Giữa cặp chất nào sau không xảy ra phản ứng hóa học?
A. NH3 và HCl. B. H2S và Cl2.
C. Cl2 và O2. D. H2S và O2.
Lời giải:
Đáp án C.
NH3 + HCl → NH4Cl
H2S + 4Cl2 + 4H2O → 8HCl + H2SO4
2H2S + O2 → 2S↓ + 2H2O
Cl2 không phản ứng trực tiếp với O2.
Câu 6: Hợp chất nào sau đây không phản ứng với O2?
A. SO3. B. CH4.
C. CO. D. SO2.
Lời giải:
Đáp án A.
CH4 + 2O2 → CO2 + 2H2O
2CO + O2 → 2CO2
2SO2 + O2 ⇆ 2SO3
Câu 7: Có thể điều chế O2 bằng cách phân huỷ KMnO4, KClO3, H2O2. Nếu lấy cùng một số mol các chất trên đem phân huỷ hoàn toàn thì thể tích oxi trong cùng điều kiện thu được
A. từ KMnO4 là lớn nhất
B. từ KClO3 là lớn nhất
C. từ H2O2 là lớn nhất
D. bằng nhau
Lời giải:
Đáp án B.
Phương trình hóa học:
Câu 8: Nhiệt phân hoàn toàn 3,16 gam KMnO4, thu được V lít O2 (đktc). Giá trị của V là
A. 0,224 B. 1,120
C. 4,480 D. 2,240
Lời giải:
Đáp án A.
Câu 9: Hãy chọn phát biểu đúng về oxi và ozon?
A. Oxi và ozon đều có tính oxi hoá mạnh như nhau.
B. Oxi và ozon đều có số proton và số notron giống nhau trong phân tử.
C. Oxi và ozon là các dạng thù hình của nguyên tố oxi.
D. Oxi và ozon đều phản ứng được với các chất như: Ag, KI, PbS ở nhiệt độ thường.
Lời giải:
Đáp án C.
Oxi và ozon là các dạng thù hình của nguyên tố oxi.
Câu 10: Oxi hóa hoàn toàn m gam kim loại X cần vừa đủ 0,25m gam khí O2. Kim loại X là
A. Al B. Fe
C. Cu D. Ca
Lời giải:
Đáp án C
Chọn m = 32 gam ⇒ nO2 = 0,25 mol
Bảo toàn electron ⇒ nX.n = 0,25.4 ⇒ X = 32n ⇒ n = 2; X = 64 (Cu)
Câu 11: Hỗn hợp khí B gồm O2 và O3 có tỉ khối hơi so với H2 là 19,2. % về thể tích của O2 và O3 trong B lần lượt là
A. 60% và 40%. B. 20% và 80%.
C. 40% và 60%. D. 80% và 20%.
Lời giải:
Đáp án A
Giả sử nO3 = y = 2 mol thì nO2 = x = 3 mol → nB = 2 + 3 = 5 mol
Mà ở cùng điều kiện nhiệt độ và áp suất % về thể tích = % về số mol
Câu 12: Có hỗn hợp khí là oxi và ozon. Sau một thời gian, ozon bị phân hủy hết, ta được một chất khí duy nhất có thể tích tăng thêm 2%. Biết các thể tích khí đo được ở cùng điều kiện nhiệt độ, áp suất. Phần trăm thể tích của oxi trong hỗn hợp ban đầu là
A. 90%. B. 10%.
C. 96%. D. 4%.
Lời giải:
Đáp án A
Đặt x và y lần lượt là số mol O2 và O3 trong hỗn hợp trước phản ứng
PTHH:
Số mol hỗn hợp khí trước khi phản ứng là: (x + y) (mol)
Sau phản ứng số mol khí oxi là:
Số mol khí tăng so với ban đầu là:
Ta có 0,5y ứng với 2% nên y ứng với 4%. Vậy O2 chiếm 96%.
Câu 13: Đốt cháy hoàn toàn 17,4 gam hỗn hợp Mg và Al trong khí oxi (dư) thu được 30,2 gam hỗn hợp oxit. Thể tích khí oxi (đktc) đã tham gia phản ứng là
A. 17,92 lít. B. 8,96 lít.
C. 11,20 lít. D. 4,48 lít.
Lời giải:
Đáp án B.
Bảo toàn khối lượng:
⇒ V = 0,4.22,4 = 8,96 (lít).
Câu 14: Nhiệt phân hoàn toàn 12,25 gam KClO3 sau phản ứng thấy thoát ra V lít khí oxi (đktc). Giá trị của V là
A. 4,48 lít. B. 6,72 lít.
C. 2,24 lít. D. 3,36 lít.
Lời giải:
Đáp án D
Câu 15: Oxi hóa hoàn toàn 10,8 gam kim loại X trong khí O2 (dư), thu được 20,4 gam oxit kim loại. X là kim loại
A. Al B. Fe
C. Mg D. Ca
Lời giải:
Đáp án A.
Bảo toàn khối lượng: nO2 = (20,4 - 10,8) : 32 = 0,3 mol
Bảo toàn electron:
⇒ MX = 9n ⇒ n = 3; MX = 27(Al).
Câu 16: Oxi hoá hoàn toàn m gam hỗn hợp X gồm Cu và Al có tỉ lệ mol 1:1 thu được 13,1 gam hỗn hợp Y gồm các oxit. Giá trị của m là
A. 7,4. B. 8,7.
C. 9,1. D. 10.
Lời giải:
Đáp án C.
Gọi nCu = nAl = a (mol)
Ta có: 80a + 102.0,5a = 13,1 ⇒ a = 0,1 (mol)
⇒ m = 27a + 64a = 9,1 g
Câu 17: Đốt 1,3g bột một kim loại R có hóa trị II trong oxi dư đến khối lượng không đổi thu được chất rắn X có khối lượng 1,62 g. Giả sử hiệu suất phản ứng là 100%, kim loại R là
A. Cu. B. Zn.
C. Fe. D. Ca.
Lời giải:
Đáp án B.
Bảo toàn khối lượng mOxi pư = 1,62 - 1,3 = 0,32 gam.
⇒ nO2 = 0,01 (mol)
MR = 1,3 : 0,02 = 65. Vậy R là Zn.
Câu 18: Hỗn hợp khí A gồm có O2 và O3, tỉ khối của hỗn hợp khí A đối với hiđro là 19,2. Hỗn hợp khí B gồm H2 và CO, tỉ khối của hỗn hợp khí B đối với hiđro là 3,6. Thành phần phần trăm theo thể tích của H2 và O2 lần lượt là?
A. 80%, 60%. B. 20%, 40%.
C. 80%, 60%. D. 20%, 60%.
Lời giải:
Đáp án A
Gọi số mol O2 trong 1 mol hỗn hợp A là x, thì số mol O3 trong hỗn hợp là (1 – x)
Gọi số mol H2 trong 1 mol hỗn hợp A là y, thì số mol CO trong hỗn hợp là (1 – y)
Giải được: y = 0,8 ⇒ %VH2 = 80%; VCO = 20%.
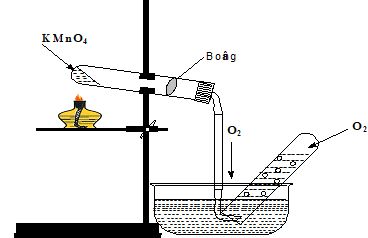
Câu 19: Điều chế oxi trong phòng thí nghiệm theo mô hình sau:
Có thể thay KMnO4 bằng chất nào sau đây ?
A. K2MnO4. B. NaHCO3.
C. KClO3 + MnO2. D. CaCO3.
Lời giải:
Đáp án C.
Câu 20: Phương pháp sản xuất oxi trong công nghiệp là
A. chưng cất phân đoạn không khí lỏng.
B. điện phân nước.
C. điện phân dung dịch muối ăn.
D. cả A và B đều đúng.
Lời giải:
Đáp án D.
Phương pháp sản xuất oxi trong công nghiệp là chưng cất phân đoạn không khí lỏng hoặc điện phân nước.
Câu 21: Nguyên tố oxi trong hợp chất nào sau đây có số oxi hóa khác với các hợp chất còn lại?
A. Na2O. B. OF2.
C. H2SO4. D. KClO3.
Lời giải:
Đáp án B.
Trong phân tử OF2 oxi có số oxi hóa +2.
Câu 22: Hỗn hợp khí gồm O2; Cl2; SO2; CO2 để thu được O2 tinh khiết người ta xử lý bằng cho hồn hợp khí trên tác dụng với lượng dư hóa chất thích hợp, hóa chất đó là
A. nước brom. C. dung dịch HCl.
B. dung dịch NaOH. D. nước clo.
Lời giải:
Đáp án B.
Cl2 + 2NaOH → NaCl + NaClO + H2O
CO2 + 2NaOH → Na2CO3 + H2O
SO2 + 2NaOH → Na2SO3 + H2O
Câu 23: Để a gam bột sắt trong không khí một thời gian thu được 15,04g hỗn hợp rắn X gồm Fe, FeO, Fe3O4, Fe2O3. Hòa tan hết X trong dung dịch H2SO4 đặc, nóng (dư) được 1,344 lít khí SO2 (sản phẩm khử duy nhất đo ở đktc) và dung dịch Y. Xác định giá trị của a là
A. 5,6. B. 11,2.
C. 6,5. D. 12,2.
Lời giải:
Đáp án B.
Ta có nSO2 = 0,06 (mol).
Áp dụng định luật bảo toàn e:
Quá trình nhường e:
Quá trình nhận e:
Áp dụng định luật bào toàn e có: Số mol e cho = số mol e nhận.
Câu 24: Để 5,6g bột Fe trong không khí một thời gian thu được m gam hỗn hợp rắn X gồm Fe, Fe3O4. Hòa tan hết X trong dung dịch H2SO4 đặc, nóng (dư) được 0,672 lít khí SO2 (sản phẩm khử duy nhất đo ở đktc) và dung dịch Y. Giá trị của m là
A. 7,52. B. 7,25.
C. 5,72. D. 5,27.
Lời giải:
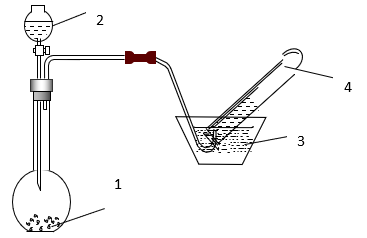
Đáp án A.
Ta có nSO2 = 0,03 (mol).
Áp dụng định luật bảo toàn e:
Quá trình nhường e:
Quá trình nhận e:
Áp dụng định luật bào toàn e có: Số mol e cho = số mol e nhận.
Câu 25: Người ta có thể điều chế oxi trong phòng thí nghiệm bằng thiết bị sau (hình ở dưới)
Hãy cho biết (1), (2), (3) và (4) lần lượt là những chất nào. Chọn đáp án đúng?
A. MnO2, H2O2, O2, H2O.
B. MnO2, O2, H2O, H2O2.
C. MnO2, H2O, H2O2, O2.
D. MnO2, H2O2, H2O, O2.
Lời giải:
Đáp án D.
Câu 26: Trong phòng thí nghiệm, người ta điều chế oxi bằng cách
A. nhiệt phân KClO3 có xúc tác MnO2.
B. nhiệt phân Cu(NO3)2.
C. điện phân nước.
D. chưng cất phân đoạn không khí lỏng.
Lời giải:
Đáp án A.
Trong PTN người ta điều chế khí O2 bằng cách phân hủy các hợp chất giàu oxi, kém bền với nhiệt như KMnO4 rắn, KClO3 rắn…
Câu 27: Chất nào sau đây có liên kết cộng hóa trị không cực:
A. H2S. B. O2.
C. Al2S3. D. SO2.
Lời giải:
Đáp án B.
Liên kết được hình thành giữa hai nguyên tử có độ âm điện giống nhau là liên kết cộng hóa trị không phân cực.
Câu 28: Thể tích của 4,8g khí O2 ở điều kiện tiêu chuẩn là
A. 4,48 lít. B. 3,36 lít.
C. 5,6 lít. D. 6,72 lít.
Lời giải:
Đáp án B.
noxi = 4,8 : 32 = 0,15 mol → V = 0,15.22,4 = 3,36 mol.
Câu 29: Đốt cháy m gam C trong V lít khí O2 (đktc), sau một thời gian thu được hỗn hợp khí A (gồm CO và CO2) có tỉ khối so với O2 là 1,25. % thể tích khí CO2 trong A là
A. 75%. B. 25%.
C. 70%. D. 50%.
Lời giải:
Đáp án A.
Hỗn hợp A: CO2 x mol ; CO y mol.
→ x = 3y → %VCO2 = 75%.
Câu 30: Cho 6,72 lít (đktc) hỗn hợp X gồm O2, Cl2 có dX/H2 = 22,5 tác dụng vừa đủ với m (g) hỗn hợp Y gồm Al và Zn thu được 31,9 gam hỗn hợp B gồm muối clorua và oxit của 2 kim loại. Giá trị của m là
A. 18,4. B. 14,8.
C. 9,2. D. 7,4.
Lời giải:
Gọi số mol Cl2 là a, số mol O2 là b. Theo bài ra ta có hệ PT:
Giải hệ tìm được a = 0,1; b = 0,2 .
Áp dụng bảo toàn khối lượng:
m = 31,9 - 45.0,3 = 18,4 gam.
Xem thêm các dạng bài tập và công thức Hoá học lớp 10 hay, chi tiết khác:
50 bài tập về Ozon (O3) và Hidropeoxit
50 bài tập về Axit Sunfuric (H2SO4) và muối Sunfat
Xem thêm các chương trình khác:
- Giải sgk Vật Lí 10 | Giải bài tập Vật lí 10 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 10
- Tóm tắt tác phẩm Ngữ văn 10
- Soạn văn 10 (hay nhất) | Để học tốt Ngữ Văn 10 (sách mới)
- Soạn văn 10 (ngắn nhất) | Để học tốt Ngữ văn 10 (sách mới)
- Văn mẫu lớp 10 (cả ba sách) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Lịch sử 10 | Giải bài tập Lịch sử 10 Học kì 1, Học kì 2 (sách mới)