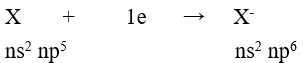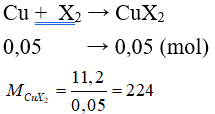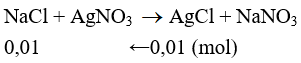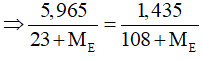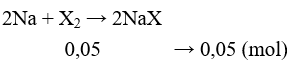50 bài tập về Flo, Brom | Lý thuyết, phương pháp và cách giải mở rộng
Với tài liệu về 50 bài tập về Flo, Brom bao gồm: lý thuyết và bài tập cũng như những định nghĩa, tính chất, các dạng bài sẽ giúp bạn nắm vững kiến thức và học tốt môn Hóa học hơn.
50 bài tập về Flo, Brom
Câu 1: Tính oxi hóa của Br2
A. mạnh hơn Flo nhưng yếu hơn Clo.
B. mạnh hơn Clo nhưng yếu hơn Iot.
C. mạnh hơn Iot nhưng yếu hơn Clo.
D. mạnh hơn Flo nhưng yếu hơn Iot.
Lời giải:
Đáp án C
Tính oxi hóa giảm dần theo thứ tự Flo → Clo → Brom → Iot.
Câu 2: Trong phản ứng hóa học sau: SO2 + Br2 + 2H2O → H2SO4 + 2HBr. Brom đóng vai trò là
A. chất khử.
B. vừa là chất oxi hóa vừa là chất khử.
C. chất oxi hóa.
D. không là chất oxi hóa không là chất khử.
Lời giải:
Đáp án C
Số oxi hóa của brom giảm từ 0 xuống -1, do đó Br2 là chất oxi hóa.
Câu 3: Chất khí có thể làm mất màu nước brom ở điều kiện thường là
A. SO2. B. CO2.
C. O2. D. HCl.
Lời giải:
Đáp án A.
Phản ứng xảy ra: SO2 + Br2 + 2H2O → H2SO4 + 2HBr
Trước phản ứng dung dịch brom có màu vàng nâu, các dung dịch thu được sau phản ứng không màu.
Câu 4: Trong hợp chất, nguyên tố Flo thể hiện số oxi hóa là
A. 0. B. +1.
C. -1. D. +3.
Lời giải:
Đáp án C
Nguyên tố Flo có độ âm điện lớn nhất nên phi kim có tính oxi hóa mạnh nhất. Trong hợp chất Flo chỉ thể hiện số oxi hóa -1.
Câu 5: Phát biểu nào sau đây là sai
A. Trong tự nhiên, flo chỉ có ở dạng hợp chất.
B. Trong hợp chất, các halogen đều có thể có số oxi hóa: -1, +1, +3, +5, +7.
C. Tính oxi hóa của các halogen giảm dần từ flo đến iot
D. Các halogen khá giống nhau về tính chất hóa học.
Lời giải:
Đáp án B
Trong hợp chất, flo chỉ thể hiện số oxi hóa là -1.
Câu 6: Cấu hình electron lớp ngoài cùng của các ion halogenua (X-) là
A. ns2np4 B. ns2np5
C. ns2np6 D. (n – 1)d10ns2np5
Lời giải:
Đáp án C
Câu 7: Đặc điểm nào dưới đây là đặc điểm chung của các đơn chất halogen?
A. Ở điều kịên thường là chất khí.
B. Tác dụng mạnh với nước.
C. Vừa có tính oxi hoá, vừa có tính khử.
D. Có tính oxi hoá mạnh.
Lời giải:
Đáp án D
Các đơn chất halogen đều có tính oxi hóa mạnh.
Câu 8: Phản ứng giữa hiđro và chất nào sau đây là phản ứng thuận nghịch?
A. Flo. B. Clo.
C. Iot. D. Brom.
Lời giải:
Đáp án C
Câu 9: Cho 1,12 lít (đktc) halogen X2 tác dụng vừa đủ với đồng kim loại thu được 11,2 gam CuX2. Nguyên tố halogen là
A. Flo. B. Clo.
C. Brom. D. Iot.
Lời giải:
Đáp án C
⇒ 64 + 2.MX = 224 ⇒ MX = 80. Vậy X là Brom.
Câu 10: Khi nung nóng, iot rắn chuyển ngay thành hơi, không qua trạng thái lỏng. Hiện tượng này được gọi là
A. sự thăng hoa. B. sự bay hơi.
C. sự phân hủy. D. sự ngưng tụ.
Lời giải:
Đáp án A
Quá trình chất chuyển từ trạng thái rắn sang trạng thái hơi, không qua trạng thái lỏng gọi là quá trình thăng hoa.
Câu 11: Số electron lớp ngoài cùng của các nguyên tử F, Br là
A. 7 B. 6
C. 5 D. 4
Lời giải:
Đáp án A
F, Br thuộc nhóm halogen (nhóm VIIA), do đó số electron lớp ngoài cùng là 7.
Câu 12: Thuốc thử để nhận ra iot là
A. hồ tinh bột. B. nước brom.
C. phenolphthalein. D. quì tím.
Lời giải:
Đáp án A
Iot làm xanh hồ tinh bột.
Câu 13: Dẫn từ từ clo vào dung dịch NaI có chứa sẵn một ít hồ tinh bột. Hiện tượng xảy ra là
A. Không hiện tượng.
C. Dung dịch chuyển sang màu xanh.
B. Dung dịch hóa đỏ.
D. Dung dịch xuất hiện kết tủa.
Lời giải:
Đáp án C
Cl2 + 2NaI → I2 + 2NaCl
I2 sinh ra làm xanh hồ tinh bột.
Câu 14: Để tinh chế brom bị lẫn tạp chất clo, người ta dẫn hỗn hợp qua
A. dung dịch NaBr.
B. dung dịch NaI.
C. dung dịch NaCl.
D.dung dịch H2SO4.
Lời giải:
Đáp án A.
Cl2 + 2NaBr → 2NaCl + Br2
Câu 15: Nguyên nhân gây ra bệnh fluorosis (bệnh chết răng) là
A. nguồn thực phẩm bị nhiễm độc thuốc trừ sâu.
B. nguồn nước bị ô nhiễm flo.
C. nước thải có hợp chất chứa oxi của clo vượt quá mức cho phép.
D. người dân không sử dụng kem đánh răng.
Lời giải:
Đáp án B
Câu 16: Cho biết các phản ứng xảy ra sau:
(1) 2FeBr2 + Br2 → 2FeBr3
(2) 2NaBr + Cl2 → 2NaCl + Br2. Phát biểu đúng là
A. Tính oxi hóa của Br2 mạnh hơn Cl2.
B. Tính khử của Cl− mạnh hơn của Br−.
C. Tính khử của Br− mạnh hơn Fe2+.
D. Tính oxi hóa của Cl2 mạnh hơn Fe3+.
Lời giải:
Đáp án D
Từ phương trình (2): 2NaBr + Cl2 → 2NaCl + Br2 ta suy ra tính oxi hóa của Cl2 mạnh hơn Br2.
Mặt khác từ (1): 2FeBr2 + Br2 → 2FeBr3 nên tính oxi hóa của Br2 mạnh hơn Fe3+.
Câu 17: Nguyên tố nào sau đây không thuộc nhóm halogen?
A. F. B. Br.
C. P. D. I.
Lời giải:
Đáp án C
P thuộc nhóm VA, không phải nhóm halogen.
Câu 18: Liên kết trong phân tử halogen (X2) có đặc điểm là
A. bền. B. rất bền.
C. không bền lắm. D. rất yếu.
Lời giải:
Đáp án C
Liên kết trong phân tử halogen không bền lắm, chúng dễ tách thành hai nguyên tử.
Câu 19: Tính chất hóa học cơ bản của các đơn chất halogen là
A. tính oxi hóa.
B. tính khử.
C. tính kim loại.
D. vừa có tính oxi hóa, vừa có tính khử.
Lời giải:
Đáp án C
Khi tham gia phản ứng hóa học, các nguyên tử halogen có xu hướng nhận thêm 1 electron để hình thành liên kết. Do đó tính chất hóa học cơ bản của các đơn chất halogen là tính oxi hóa.
Câu 20: Trong các chất sau, chất nào có tính khử mạnh nhất?
A. Flo. B. Clo.
C. Brom. D. Iot.
Lời giải:
Đáp án D
Iot có bán kính nguyên tử lớn hơn F, Cl, Br nhưng có độ âm điện nhỏ nhất so với các nguyên tố trên, do đó Iot có tính khử mạnh nhất.
Câu 21: Trong các chất sau, chất nào có tính oxi hóa mạnh nhất?
A. Flo. B. Clo.
C. Brom. D. Iot.
Lời giải:
Đáp án A
Nguyên tố Flo có độ âm điện lớn nhất nên phi kim có tính oxi hóa mạnh nhất.
Câu 22: Phản ứng nào sau đây là sai?
A. 2F2 + 2H2O → 4HF + O2.
B. Cl2 + H2O ⇆ HCl + HClO.
C. Br2 + H2O ⇆ HBr + HBrO.
D. F2 + H2O ⇆ HF + HFO.
Lời giải:
Đáp án D
Flo có tính oxi hóa rất mạnh, hơi nước có thể bốc cháy ngay khi gặp F2.
Câu 23: Phản ứng hóa học nào sau đây không xảy ra?
A. 2KOH + Cl2 → KClO + KCl + H2O.
B. 2KCl + Br2 → Cl2 + 2KBr.
C. Cl2 + 2KI → 2KCl + I2.
D. Cu + Cl2 → CuCl2.
Lời giải:
Đáp án B
Tính oxi hóa của Br2 yếu hơn Cl2.
Câu 24: Trong công nghiệp iot chủ yếu được sản xuất từ nguồn nguyên liệu nào?
A. Nước biển. B. Muối ăn.
C. Rong biển. D. Tro.
Lời giải:
Đáp án C
Trong công nghiệp, Iot chủ yếu sản xuất từ rong biển.
Câu 25: Halogen nào được ứng dụng để tạo hợp chất chống dính trong xoong, chảo, nồi cơm điện… ?
A. Flo. B. Iot.
C. Brom. D. Clo.
Lời giải:
Đáp án A
Hợp chất của Flo được ứng dụng để chế tạo hợp chất chống dính.
Câu 26: Trong các đơn chất halogen, chất ở trạng thái lỏng ở điều kiện thường là
A. Cl2. B. F2.
C. Br2. D. I2.
Lời giải:
Đáp án C
Điều kiện thường, brom tồn tại ở trạng thái lỏng.
Câu 27: Trong y tế, đơn chất halogen nào được hòa tan trong etanol để dùng làm chất sát trùng vết thương?
A. Cl2. B. F2.
C. I2. D. Br2.
Lời giải:
Đáp án C
I2 được dùng để sát trùng vết thương.
Câu 28: Liên kết trong phân tử halogen (X2) là liên kết
A. ion.
B. cộng hóa trị phân cực.
C. cho nhận.
D. cộng hóa trị không phân cực.
Lời giải:
Đáp án D
Liên kết trong phân tử đơn chất là liên kết cộng hóa trị không phân cực.
Câu 29: Cho 5,965 gam hỗn hợp A gồm: NaX, NaY (X,Y là hai halogen liên tiếp, nguyên tử khối của X < Y) vào dung dịch AgNO3 dư. Kết thúc phản ứng thu được 1,435 gam kết tủa. Hai nguyên tố X, Y lần lượt là
A. F và Cl. B. Cl và Br.
C. Br và I. D. Cl và F.
Lời giải:
Đáp án A
Trường hợp 1: X là Flo và Y là Clo. Ta có PTHH:
mNaCl = 0,01.58,5 = 0,585 < 5,965 (thỏa mãn)
Trường hợp 2: X khác F gọi X, Y là E (điều kiện: 35,5 < ME < 127). Ta có PTHH:
NaE + AgNO3 → AgE + NaNO3
Ta có số mol NaE = số mol AgE
Giải PT ⇒ ME < 0 (loại).
Câu 30: Cho 1,15 gam Na tác dụng vừa đủ với halogen (X2) thu được 5,15 gam muối. Nguyên tố halogen X là
A. Flo. B. Clo.
C. Brom. D. Iot.
Lời giải:
Đáp án A
MNaX = 5,15 : 0,05 = 103 ⇒ MX = 80. Vậy X là Br.
Xem thêm các dạng bài tập và công thức Hoá học lớp 10 hay, chi tiết khác:
50 bài tập về Axit clohidric HCl
50 bài tập về Hợp chất có oxi của clo
Công thức tính nhanh khối lượng muối clorua tạo thành sau phản ứng
Xem thêm các chương trình khác:
- Giải sgk Vật Lí 10 | Giải bài tập Vật lí 10 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 10
- Tóm tắt tác phẩm Ngữ văn 10
- Soạn văn 10 (hay nhất) | Để học tốt Ngữ Văn 10 (sách mới)
- Soạn văn 10 (ngắn nhất) | Để học tốt Ngữ văn 10 (sách mới)
- Văn mẫu lớp 10 (cả ba sách) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Lịch sử 10 | Giải bài tập Lịch sử 10 Học kì 1, Học kì 2 (sách mới)