Công thức tính nhanh số mol OH- khi cho SO2 với dung dịch kiềm | Lý thuyết, công thức, các dạng bài tập và cách giải
Với tài liệu về Công thức tính nhanh số mol OH- khi cho SO2 với dung dịch kiềm bao gồm: lý thuyết và bài tập cũng như những định nghĩa, tính chất, các dạng bài sẽ giúp bạn nắm vững kiến thức và học tốt môn Hóa học hơn.
Công thức tính nhanh số mol OH- khi cho SO2 với dung dịch kiềm
1. Công thức tính nhanh số mol OH- khi cho SO2 với dung dịch kiềm
TH1: Chỉ tạo muối HSO3-
nOH- = nSO2
TH2: Chỉ tạo muối SO32-
nOH-= 2 nSO2
TH3: Tạo hỗn hợp muối HSO3- và SO32-
nOH-= nSO32- + nSO2 = 2nSO2 - nHSO3-
2. Bạn nên biết
Khi cho khí SO2 tác dụng dung dịch NaOH hoặc KOH
SO2 + NaOH →NaHSO3 (1);
SO2 + 2NaOH →Na2SO3 + H2O (2)
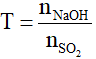
T ≤ 1: tạo muối NaHSO3 phản ứng (1), tính theo NaOH
1 < T < 2 : tạo 2 muối NaHSO3 và Na2SO3 theo phản ứng (1) và (2)
T >2: tạo muối Na2SO3 phản ứng (2), tính theo SO2
3. Mở rộng
Khi bài toán cho biết số mol của Ca(OH)2 hoặc Ba(OH)2 và SO2 tham gia phản ứng:
SO₂ + Ca(OH)2 → CaSO3 + H₂O (1)
2SO₂ + Ca(OH)2 →Ca(HSO3)2 (2)
- Bước 1: Lập tỉ lệ: 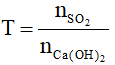
- Bước 2: So sánh
+ Nếu T<1 chỉ xảy ra phản ứng (1) muối thu được chỉ có CaSO3
+Nếu l<T<2 xảy ra cả phản ứng (1) và (2) sản phẩm thu được gồm 2 muối là Ca(HSO3)2 và CaSO3
+ Nếu T > 2 chỉ xảy ra phản ứng (2) muối thu được chỉ có Ca(HSO3)2
- Bước 3: Tính toán và giải bài toán
4. Ví dụ minh họa: Hấp thụ 3,36 lít khí SO2 (đktc) vào 200ml dung dịch Ca(OH)2 1M.Tính khối lượng muối thu được là:
A. 12 gam
B. 18 gam
C. 9 gam
D. 15 gam
Hướng dẫn
nSO₂ = 0,15mol : nCa(OH)2= 0,2 mol
-> 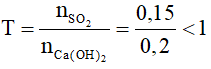
→ chỉ tạo muối thu được chỉ có CaSO3, Ca(OH)2 dư
SO₂ + Ca(OH)2 → CaSO3 + H₂O
nCaSO3 = nSO₂ =0,15mol
-> mCaSO3 = 0,15.120 =18gam
Đáp án B
4. Bài tập minh họa
Câu 1: Dẫn V lít (đktc) khí SO2 vào 200 ml dung dịch KOH 1M thu được 12 gam muối KHSO3. Vậy V có giá trị là:
A. 2,24 lít
B. 3,36 lít
C. 4,48 lít
D. 5,6 lít
Hướng dẫn
nKOH =0,2 mol ; nKHSO3 = 0,1mol → tạo ra hỗn hợp 2 muối KHSO3 và K2SO3
Các phương trình phản ứng xảy ra:
SO2 + KOH → KHSO3
SO2 + 2KOH → K2SO3 + H2O
Áp dụng công thức tính nhanh ta có:
nOH- = 2nSO2 - nKHSO3
-> 0,2 = 2nSO2 -0,1
-> nSO2 = 0,15mol
-> VSO2= 3,36 lít
Đáp án B
Câu 2. Dẫn 2,24 lít khí SO2 (đkc) vào 200 ml dung dịch KOH 1,5M vậy khi phản ứng xảy ra hoàn toàn thì thu được:
A. K2SO3 0,1M và KOH dư 0,4M
B. KHSO3 0,1M
C. K2SO3 0,5M và KOH dư 0,5M
D. KHSO3 0,1M và K2SO3 0,5M
Hướng dẫn
Xét tỉ lệ: = 0,1mol; nKOH = 0,3mol. Tỉ lệ 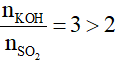
Nên KOH dư → phản ứng chỉ tạo muối trung hòa
SO2 + 2KOH → K2SO3 + H2O
nK2SO3 = nSO2 =0,1 mol -> 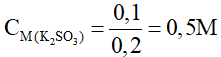
nKOH(dư) = 0,3 – 0,1.2 = 0,1 mol
⇒ 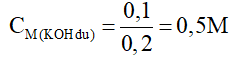
Đáp án C
Câu 3: Cho 3,36 lít SO2 ở đktc vào 200 ml dung dịch hỗn hợp NaOH 1M và Ba(OH)2 0,5M. Khối lượng kết tủa thu được sau phản ứng là
A. 16,275 gam.
B. 32,55 gam.
C.10,08 gam.
D. 21,7 gam.
Hướng dẫn
nNaOH = 0,2mol l; nBa(OH)2 = 0,1 mol
-> ∑nOH- =0,4 mol
nSO2 = 0,15 mol -> 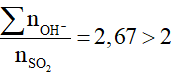
Phương trình hóa học:
SO2 + 2OH- -> SO32- + H2O
-> Sau phản ứng thu được 0,15 mol SO32- và còn dư 0,1 mol OH-
Mà nBa2+ = 0,1 mol nên chỉ có 0,1 mol BaSO3 được tạo thành
mkết tủa = 0,1. 217 = 21,7gam
Đáp án D
Xem thêm các dạng bài tập và công thức Hoá học lớp 10 hay, chi tiết khác:
Công thức tính nhanh số mol OH- khi cho H2S tác dụng với dung dịch kiềm
Các dạng bài toán tính tốc độ trung bình của phản ứng hóa học
Trắc nghiệm lý thuyết Tốc độ phản ứng và cân bằng hóa học
Các dạng bài toán tốc độ phản ứng trong đề thi Đại học
Các dạng bài toán tính nồng độ các chất ở trạng thái cân bằng
Xem thêm các chương trình khác:
- Giải sgk Vật Lí 10 | Giải bài tập Vật lí 10 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 10
- Tóm tắt tác phẩm Ngữ văn 10
- Soạn văn 10 (hay nhất) | Để học tốt Ngữ Văn 10 (sách mới)
- Soạn văn 10 (ngắn nhất) | Để học tốt Ngữ văn 10 (sách mới)
- Văn mẫu lớp 10 (cả ba sách) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Lịch sử 10 | Giải bài tập Lịch sử 10 Học kì 1, Học kì 2 (sách mới)
