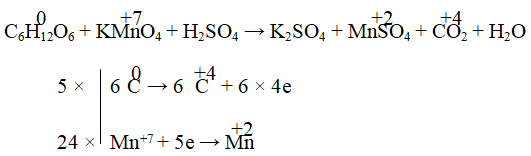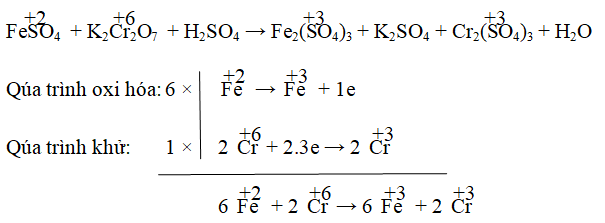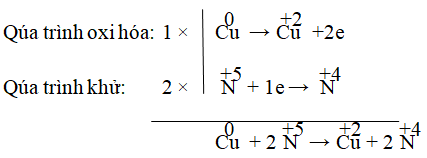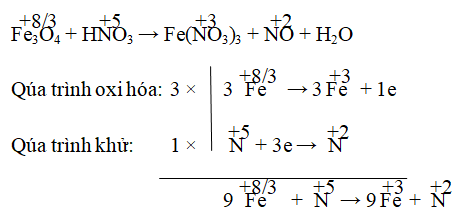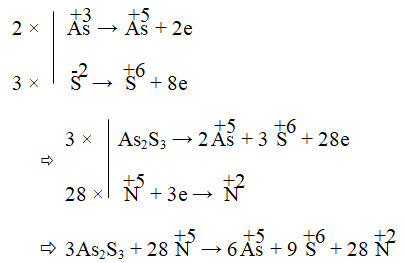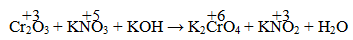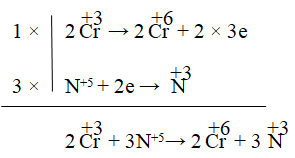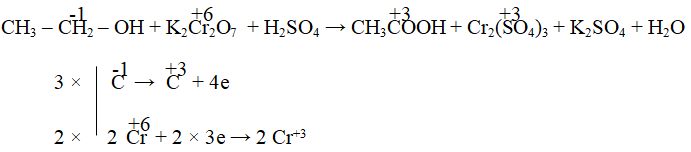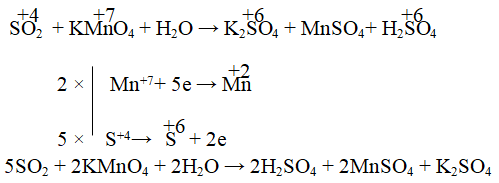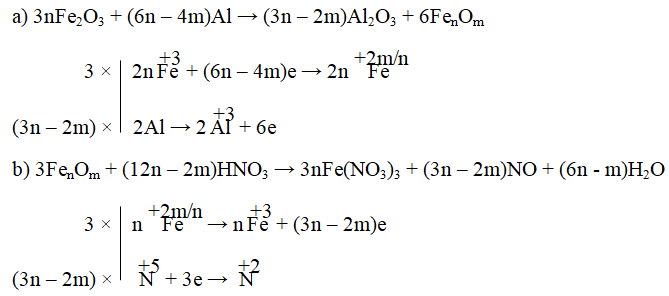Các dạng bài toán Phương pháp, cách cân bằng phản ứng oxi hóa khử và cách giải
Với tài liệu về Các dạng bài toán Phương pháp, cách cân bằng phản ứng oxi hóa khử bao gồm: lý thuyết và bài tập cũng như những định nghĩa, tính chất, các dạng bài sẽ giúp bạn nắm vững kiến thức và học tốt môn Hóa học hơn.
Các dạng bài toán Phương pháp, cách cân bằng phản ứng oxi hóa khử
A. Phương pháp & Ví dụ
I. Lý thuyết và Phương pháp giải
Theo trình tự 3 bước với nguyên tắc:
Tổng electron nhường = tổng electron nhận
Bước 1. Xác định sự thay đổi số oxi hóa.
Bước 2. Lập thăng bằng electron.
Bước 3. Đặt các hệ số tìm được vào phản ứng và tính các hệ số còn lại.
Lưu ý:
- Ngoài phương pháp thăng bằng electron, còn có thể cân bằng phản ứng oxi hóa – khử theo phương pháp tăng – giảm số oxi hóa với nguyên tắc: tổng số oxi hóa tăng = tổng số oxi hóa giảm.
- Phản ứng oxi hóa – khử còn có thể được cân bằng theo phương pháp thăng bằng ion – electron: lúc đó vẫn đảm bảo nguyên tắc thăng bằng electron nhưng các nguyên tố phải được viết ở dạng ion đúng, như NO3-, SO42-, MnO4-, Cr2072-,...
- Nếu trong phản ứng oxi hóa – khử có nhiều nguyên tố có số oxi hóa cùng tăng (hoặc cùng giảm) mà:
+ Chúng thuộc một chất thì phải đảm bảo tỉ lệ số nguyên tử của các nguyên tố trong phân tử.
+ Chúng thuộc các chất khác nhau thì phải đảm bảo tỉ lệ số mol của các chất đó theo đề cho.
* Với hợp chất hữu cơ:
- Nếu hợp chất hữu cơ trước và sau phản ứng có một nhóm nguyên tử thay đổi và một số nhóm không đổi thì nên xác định số oxi hóa của C trong từng nhóm rồi cân bằng.
- Nếu hợp chất hữu cơ thay đổi toàn phân tử, nên cân bằng theo số oxi hóa trung bình của C.
II. Ví dụ minh họa
Ví dụ 1. Cân bằng phản ứng:
FeS + HNO3 → Fe(NO3)3 + N2O + H2SO4 + H2O
Hướng dẫn:
Bước 1. Xác định sự thay đổi số oxi hóa:
Fe+2 → Fe+3
S-2 → S+6
N+5 → N+1
Bước 2. Lập thăng bằng electron:
Fe+2 → Fe+3 + 1e
S-2 → S+6 + 8e
FeS → Fe+3 + S+6 + 9e
2N+5 + 8e → 2N+1
→ Có 8FeS và 9N2O.
Bước 3. Đặt các hệ số tìm được vào phản ứng và tính các hệ số còn lại:
8FeS + 42HNO3 → 8Fe(NO3)3 + 9N2O + 8H2SO4 + 13H2O
Ví dụ 2. Cân bằng phản ứng trong dung dịch bazơ:
NaCrO2 + Br2 + NaOH → Na2CrO4 + NaBr
Hướng dẫn:
CrO2- + 4OH- → CrO42- + 2H2O + 3e
Br2 + 2e → 2Br-
Phương trình ion:
2CrO2- + 8OH- + 3Br2 → 2CrO42- + 6Br- + 4H2O
Phương trình phản ứng phân tử:
2NaCrO2 + 3Br2 + 8NaOH → 2Na2CrO4 + 6NaBr + 4H2O
Ví dụ 3. Cân bằng phản ứng trong dung dịch có H2O tham gia:
KMnO4 + K2SO3 + H2O → MnO2 + K2SO4
Hướng dẫn:
MnO4- + 3e + 2H2O → MnO2 + 4OH-
SO32- + H2O → SO42- + 2H+ + 2e
Phương trình ion:
2MnO4- + H2O + 3SO32- → 2MnO2 + 2OH- + 3SO42-
Phương trình phản ứng phân tử:
2KMnO4 + 3K2SO3 + H2O → 2MnO2 + 3K2SO4 + 2KOH
Ví dụ 4. Cân bằng phản ứng oxi hóa – khử sau:
C6H12O6 + KMnO4 + H2SO4 → K2SO4 + MnSO4 + CO2 + H2O
Hướng dẫn:
5C6H12O6 + 24KMnO4 + 36H2SO4 → 12K2SO4 + 24MnSO4 + 30CO2 + 66H2O
B. Bài tập trắc nghiệm
Câu 1. Cho phản ứng: Na2SO3 + KMnO4 + H2O → Na2SO4 + MnO2 + KOH
Tỉ lệ hệ số của chất khử và chất oxi hóa sau khi cân bằng là:
A. 4:3 B. 3:2 C. 3:4 D. 2:3
Lời giải:
Đáp án: B
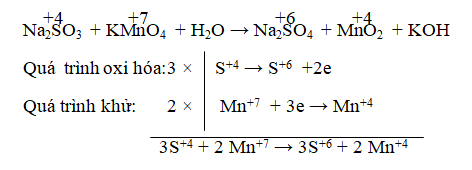
⇒ 3Na2SO3 + 2KMnO4 → 3Na2SO4 + 2MnO2
Kiểm tra hai vế: thêm 2KOH vào vế phải, thêm H2O vào vế trái.
⇒ 3Na2SO3 + 2KMnO4 + H2O → 3Na2SO4 + 2MnO2 + 2KOH
Câu 2. Cho phản ứng: FeSO4 + K2Cr2O7 + H2SO4 → Fe2(SO4)3 + K2SO4 + Cr2(SO4)2 + H2O. Hệ số cân bằng của FeSO4 và K2Cr2O7 lần lượt là:
A. 6 ; 2 B. 5; 2 C. 6; 1 D. 8; 3
Lời giải:
Đáp án:
Hay 6FeSO4 + K2Cr2O7 → 3Fe2(SO4)3 + Cr2(SO4)3
Kiểm tra hai vế: thêm K2SO4 vào về phải; thêm 7H2SO4 vào vế trái → thêm 7H2O vào vế phải.
⇒ 6FeSO4 + K2Cr2O7 + 7H2SO4 → 3Fe2(SO4)3 + K2SO4 + Cr2(SO4)2 + 7H2O
Hay Cu + 2HNO3 → Cu(NO3)2 + 2NO2
Kiểm tra hai vế: thêm 2HNO3 vào vế trái thành 4HNO3, thêm 2H2O vào vế phải.
⇒ Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
Câu 3. Cân bằng phản ứng sau: Fe3O4 + HNO3 → Fe(NO3)3 + NO + H2O
Lời giải:
Đáp án:
Hay 3Fe3O4 + HNO3 → 9Fe(NO3)3 + NO
Kiểm tra hai vế: thêm 28 vào HNO3 ở vế trái, thêm 14H2O ở vế phải.
⇒ 3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO + 14H2O
Câu 4. Cân bằng phản ứng: As2S3 + HNO3 + H2O → H3AsO4 + NO + H2SO4
Lời giải:
Đáp án:
Hay 3As2S3 + 28HNO3 + 4H2O → 6H3AsO4 + 28NO + 9H2SO4
Câu 5. Tính tổng hệ số cân bằng trong phản ứng sau:
A. 15 B. 14 C. 18 D. 21
Lời giải:
Đáp án: A
Phương trình: Cr2O3 + 3KNO3 + 4KOH → 2K2CrO4 +2H2O + 3KNO2
⇒ Tổng hệ số cân bằng là 15
Câu 6. Cân bằng phản ứng oxi hóa – khử sau:
CH3CH2OH + K2Cr2O7 + H2SO4 → CH3COOH + Cr2(SO4)3 + K2SO4 + H2O
Lời giải:
Đáp án:
3CH3CH2OH + 2K2Cr2O7 + 8H2SO4 →3CH3COOH + 2Cr2(SO4)3 + 2K2SO4 + 11H2O
Câu 7. Xác định hệ số cân bằng của KMnO4 trong phản ứng sau:
SO2 + KMnO4 + H2O → K2SO4 + ...
A. 2 B. 5 C. 7 D. 10
Lời giải:
Đáp án: A
Câu 8. Cân bằng phản ứng oxi hóa – khử sau bằng phương pháp thăng bằng e:
a) Fe2O3 + Al → Al2O3 + FenOm
b) FenOm + HNO3 → Fe(NO3)3 + NO + H2O
Lời giải:
Đáp án:
Xem thêm các dạng bài tập và công thức Hoá học lớp 10 hay, chi tiết khác:
Các dạng bài toán Phương pháp bảo toàn electron
Xem thêm các chương trình khác:
- Giải sgk Vật Lí 10 | Giải bài tập Vật lí 10 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 10
- Tóm tắt tác phẩm Ngữ văn 10
- Soạn văn 10 (hay nhất) | Để học tốt Ngữ Văn 10 (sách mới)
- Soạn văn 10 (ngắn nhất) | Để học tốt Ngữ văn 10 (sách mới)
- Văn mẫu lớp 10 (cả ba sách) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Lịch sử 10 | Giải bài tập Lịch sử 10 Học kì 1, Học kì 2 (sách mới)