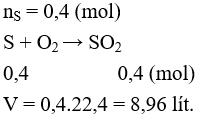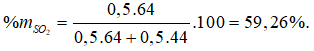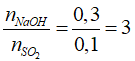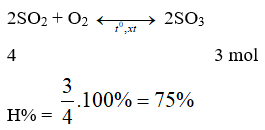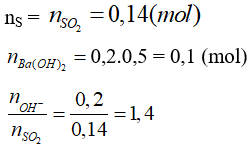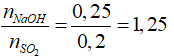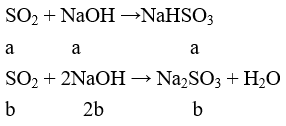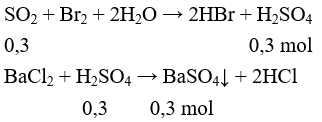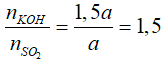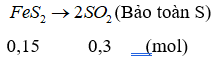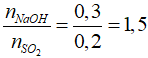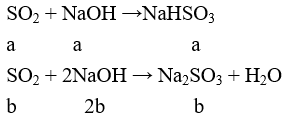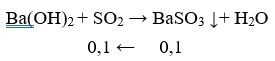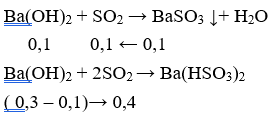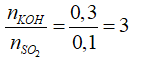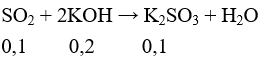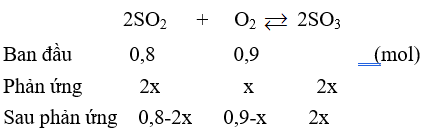50 bài tập về Lưu huỳnh Đioxit (SO2) | Lý thuyết, phương pháp và cách giải mở rộng
Với tài liệu về 50 bài tập về Lưu huỳnh Đioxit (SO2) bao gồm: lý thuyết và bài tập cũng như những định nghĩa, tính chất, các dạng bài sẽ giúp bạn nắm vững kiến thức và học tốt môn Hóa học hơn.
50 bài tập về Lưu huỳnh Đioxit (SO2)
Câu 1: Số oxi hoá của lưu huỳnh trong SO2 là
A. -2. B. +4.
C. +6. D. 0.
Lời giải:
Đáp án B
x + (-2).2 = 0 ⇒ x = +4.
Câu 2: Thể tích khí SO2 ở đktc thu được khi cho 12,8 gam S phản ứng hoàn toàn với O2 dư là
A. 22,4 lít. B. 3,36 lít.
C. 4,48 lít. D. 8,96 lít.
Lời giải:
Đáp án D
Câu 3: Chất khí X tan trong nước tạo ra một dung dịch làm chuyển màu quỳ tím thành đỏ và có thể được dùng làm chất tẩy màu. Khí X là
A. NH3. B. CO2.
C. SO2. D. O3.
Lời giải:
Đáp án C
Câu 4: Chọn phát biểu đúng về SO2?
A. SO2 là chất khí, màu vàng lục.
B. SO2 làm xanh quỳ tím ẩm.
C. SO2 không làm mất màu dd Br2.
D. SO2 có thể oxi hóa H2S thành S.
Lời giải:
Đáp án D
Câu 5: Để chứng minh SO2 là một oxit axit, người ta cho SO2 phản ứng với chất nào sau đây?
A. Dung dịch brom.
B. Dung dịch kiềm.
C. Dung dịch KMnO4.
D. Dung dịch axit sunfuhiđric.
Lời giải:
Đáp án B
SO2 + 2NaOH → Na2SO3 + H2O
Câu 6: Cho các phát biểu sau:
(a) Sục khí SO2 vào dung dịch NaOH dư tạo ra muối trung hòa Na2SO3.
(b) SO2 vừa có tính khử, vừa có tính oxi hóa.
(c) Khí SO2 là một trong những nguyên nhân chính gây ra mưa axit.
(d) Khí SO2 có màu vàng lục và rất độc.
Số phát biểu đúng là
A. 3. B. 1.
C. 4. D. 2.
Lời giải:
Đáp án A.
Các phát biểu đúng a,b,c.
Câu 7: Dẫn từ từ V lít khí SO2 (đktc) vào lượng dư dung dịch Br2, không thấy khí thoát ra. Thêm tiếp dung dịch BaCl2 dư vào dung dịch sau phản ứng, thu được 23,3 gam kết tủa. Giá trị của V là
A. 4,48. B. 1,12.
C. 3,36. D. 2,24.
Lời giải:
Đáp án D.
SO2 + Br2 + 2H2O → H2SO4 + 2HBr
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
nSO2 = nH2SO4 = 0,1 mol ⇒ V = 0,1.22,4 = 2,24 lít.
Câu 8: Lưu huỳnh đioxit có thể tham gia phản ứng:
(1) SO2 + 2H2S → 3S + 2H2O;
(2) SO2+ Br2 + H2O → 2HBr + H2SO4.
Tính chất của SO2 được diễn tả đúng nhất là
A. SO2 thể hiện tính oxi hoá.
B. SO2 thể hiện tính khử.
C. SO2 vừa oxi hóa vừa khử.
D. SO2 là oxit axit.
Lời giải:
Đáp án C.
(1) số oxi hóa của S giảm từ +4 xuống 0 → SO2 thể hiện tính oxi hóa.
(2) số oxi hóa của S tăng từ +4 lên +6 → SO2 thể hiện tính khử.
Câu 9: Dẫn khí SO2 vào dung dịch KMnO4 hiện tượng quan sát được là
A. Dung dịch không màu chuyển sang màu tím.
B. Dung dịch màu tím bị vẩn đục màu vàng.
C. Màu tím của dung dịch KMnO4 chuyển sang màu vàng.
D. Màu tím của dung dịch KMnO4 chuyển sang không màu.
Lời giải:
Đáp án D.
5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4.
Câu 10: Hỗn hợp X gồm hai khí SO2 và CO2 có tỉ khối đối với H2 là 27. Thành phần % theo khối lượng của SO2 là
A. 35,5% B. 59,26%
C. 40% D. 50%
Lời giải:
Đáp án B
Coi số mol hỗn hợp X = 1 mol.
nSO2 = x, nCO2 = y (mol)
⇒ x + y = 1
64x + 44y = 1.27.2
⇒ x = y = 0,5 (mol).
Câu 11: Để nhận biết hai bình chứa khí không màu CO2 và SO2, cách làm nào sau đây không đúng?
A. Cho mỗi khí vào nước Br2.
B. Cho từ từ đến dư mỗi khí vào nước vôi trong.
C. Cho mỗi khí vào dung dịch H2S.
D. Cho mỗi khí vào dung dịch KMnO4.
Lời giải:
Đáp án B
Do cả SO2 và CO2 đều phản ứng với Ca(OH)2 tạo kết tủa CaSO3 và CaCO3 đều màu trắng, sau đó, khí dư kết tủa đều hòa tan, không thể phân biệt được.
Câu 12: Cho các chất khí sau đây: Cl2, SO2, CO2, SO3. Chất làm mất màu dung dịch brom là
A. CO2. B. SO3.
C. Cl2. D. SO2
Lời giải:
Đáp án D
SO2 + Br2 + 2H2O → 2HBr + H2SO4
Câu 13: Hấp thụ 2,24 lít khí SO2 (đktc) vào 300 ml dung dịch NaOH 1M, thu được dung dịch X. Chất tan trong X là
A. Na2SO3 B. NaHSO3
C. Na2SO3, NaOH D. Na2SO3, NaHSO3
Lời giải:
Đáp án C
nSO2 = 0,1(mol), nNaOH = 1.0,3 = 0,3 mol
Tạo Na2SO3, NaOH dư
Câu 14: Dẫn V lít (đktc) khí SO2 vào 200 ml dung dịch KOH 1M thu được 12 gam muối KHSO3. Vậy V có giá trị là
A. 2,24 lít B. 3,36 lít
C. 4,48 lít D. 5,6 lít
Lời giải:
Đáp án B
nKOH = 0,2 mol > nKHSO3 = 0,1(mol)
Các phương trình phản ứng xảy ra:
Tổng số mol SO2 = 0,15 mol
→ V = 3,36 lit
Câu 15: Oxi hoá 89,6 lít SO2 (đktc) ở điều kiện thích hợp thu được 240 gam SO3. Hiệu suất của phản ứng là
A. 50% B. 75%
C. 80%. D. Kết quả khác
Lời giải:
Đáp án B
Câu 16: Để diệt chuột trong một nhà kho người ta dùng phương pháp đốt lưu huỳnh, đóng kín cửa nhà kho lại. Chuột hít phải khói sẽ bị sưng yết hầu, co giật, tê liệt cơ quan hô hấp dẫn đến bị ngạt mà chết. Chất nào sau đây là nguyên nhân chính gây ra các hiện tượng trên?
A. H2S. B. SO2.
C. SO3. D. H2SO4
Lời giải:
Đáp án B
S + O2 → SO2
Câu 17: Cho phương trình phản ứng:
SO2 + KMnO4 + H2O → K2SO4 + MnSO4 + H2SO4
Sau khi cân bằng với hệ số là các giá trị tối giản, hệ số của chất oxi hoá và chất khử là
A. 5 và 2. B. 2 và 5.
C. 2 và 2. D. 5 và 5.
Lời giải:
Đáp án B
5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4
SO2: chất khử; KMnO4: chất oxi hóa.
Câu 18: Đốt cháy hoàn toàn 4,48 g lưu huỳnh rồi cho sản phẩm cháy hấp thụ hoàn toàn vào 200 ml dung dịch Ba(OH)2 0,5M. Lượng chất kết tủa thu được sau phản ứng là
A. 10,85g B. 21,7g
C. 13,02 g D. 16,725
Lời giải:
Tạo 2 muối Ba(HSO3)2 và BaSO3
nBaSO3 = 2nBa(OH)2 - nSO2 = 0,2 - 0,14 = 0,06
mBaSO3 = 0,06.(137 + 32 + 48) = 13,02(g)
Câu 19: Hấp thụ hoàn toàn 12,8g SO2 vào 250ml dung dịch NaOH 1M. Khối lượng từng muối tạo thành sau phản ứng là
A. 15,6g và 5,3g. B. 18g và 6,3g.
C. 15,6g và 6,3g. D. Kết quả khác.
Lời giải:
nSO2 = 0,2 (mol); nNaOH = 1.0,25 = 0,25 (mol)
Tạo Na2SO3 và NaHSO3
a + b = 0,2
a + 2b = 0,25
Giải ra ta có a = 0,15, b = 0,05 mol
mNa2SO3 = 0,05.(23.2 + 32 + 48) = 6,3(g)
mNaHSO3 = 0,15.(23 + 1 + 32 + 48) = 15,6(g)
Câu 20: Hấp thụ hoàn toàn 6,72 lít khí SO2 (đktc) vào dung dịch chứa a mol KOH, thu được dung dịch chứa 39,8 gam hỗn hợp muối. Giá trị của a là
A. 0,5 B. 0,6
C. 0,4 D. 0,3
Lời giải:
Đáp án C
nSO2 = 0,3 (mol)
Gọi số mol KHSO3: x mol; K2SO3: y mol
⇒ x + y = 0,3 (1)
120x + 158y = 39,8 (2)
⇒ x = 0,2; y = 0,1
⇒ nKOH = x + 2y = 0,4 (mol) (bảo toàn K)
Câu 21: Sục 6,72 lít SO2 ở đktc vào dung dịch brom rồi cho dung dịch thu được tác dụng với BaCl2 dư, kết tủa thu được có khối lượng (g) là
A. 23,3 B. 34,95
C. 46,6 D. 69,9
Lời giải:
Đáp án D
Phương trình phản ứng
mBaSO4 = 0,3 × 233 = 69,9g
Câu 22: Dẫn a mol SO2 vào dung dịch chứa 1,5a mol KOH. Phát biểu nào sau đây đúng?
A. Chỉ thu được muối axit
B. Chỉ thu được muối trung hòa
C. Thu được cả 2 muối
D. Thu được muối trung hòa và KOH dư.
Lời giải:
Đáp án C.
Tạo 2 muối KHSO3 và K2SO3.
Câu 23: Đốt cháy hoàn toàn m gam FeS2 bằng một lượng O2 vừa đủ, thu được khí X. Hấp thị hết X vào 2 lít dung dịch chứa Ba(OH)2 0,1M, thu được dung dịch Y và 21,7 gam kết tủa. Cho Y vào dung dịch NaOH, thấy xuất hiện thêm kết tủa. Giá trị của m là
A. 23,2 B. 12,6
C. 18,0 D. 24,0
Lời giải:
Đáp án C
nBa(OH)2 = 0,1.2 = 0,2 (mol); n↓ = 0,1 (mol)
nBaSO3 = 2nBa(OH)2 - nSO2 ⇒ nSO2 = 2.0,2 – 0,1 = 0,3 (mol)
⇒ mFeS2 = 0,15.(56 + 32.2) = 18 (g)
Câu 24: Hấp thụ 4,48 lít SO2 (đktc) vào 150 ml dung dịch NaOH 2M, thu được dung dịch chứa m gam muối. Giá trị của m là
A. 18,9 B. 25,2
C. 20,8 D. 23,0
Lời giải:
Đáp án D
nSO2 = 0,2 (mol); nNaOH = 2.0,15 = 0,3 (mol)
Tạo Na2SO3 và NaHSO3
a + b = 0,2
a + 2b = 0,3
Giải ra ta có a = b = 0,1 mol
mNa2SO3 = 0,1.(23.2 + 32 + 48) = 12,6(g)
mNaHSO3 = 0,1.(23 + 1 + 32 + 48) = 10,4(g)
⇒ m = 23 (gam)
Câu 25: Khi làm thí nghiệm với H2SO4 đặc, nóng thường sinh ra khí SO2. Để hạn chế tốt nhất khí SO2 thoát ra gây ô nhiễm môi trường, người ta nút ống nghiệm bằng bông tẩm dung dịch nào sau đây?
A. Giấm ăn. B. Muối ăn.
C. Cồn. D. Xút.
Lời giải:
Đáp án D
2NaOH + SO2 → Na2SO3 + H2O
Câu 26: Hấp thụ V lít SO2 (đktc) vào 300 ml dung dịch Ba(OH)2 1M thu được 21,7g kết tủa. Tính V
A. 2,24 B. 1,12
C. 11,2 D. A và C
Lời giải:
Đáp án D
Trường hợp 1: Ba(OH)2 dư, SO2 hết, nBaSO3 = nSO2
→ VSO2 = 0,1. 22,4 = 2,24 lít
Trường hợp 2: Ba(OH)2 hết, SO2 dư nhưng không hòa tan hết kết tủa (kết tủa chỉ tan một phần)
→ nSO2 = 0,1 + 0,4 = 0,5 mol
→ VSO2 = 0,5. 22,4 = 11,2 lít
Câu 27: Dẫn 2,24 lít khí SO2 (đkc) vào 200 ml dung dịch KOH 1,5M vậy khi phản ứng xảy ra hoàn toàn thì thu được
A. K2SO3 0,1M và KOH dư 0,4M.
B. KHSO3 0,1M.
C. K2SO3 0,5M và KOH dư 0,5M.
D. KHSO3 0,1M và K2SO3 0,5M.
Lời giải:
Đáp án C
nSO2 = 0,1 (mol); nKOH = 2.0,15 = 0,3 (mol)
Tạo K2SO3, KOH dư
nKOH dư = 0,1 mol ⇒ CKOH = 0,5M,
Câu 28: Cho các phản ứng sau:
(1) SO2 + 2H2S → 3S + 2H2O
(2) 5SO2 + 2KMnO4 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4
(3) SO2 + Br2 + 2H2O → H2SO4 + 2HBr
(4) SO2 + Ca(OH)2 → Ca(HSO3)2
Số phản ứng mà SO2 đóng vai trò là chất khử là
A. 2. B. 1.
C. 3. D. 4.
Lời giải:
Đáp án A.
Phản ứng 2, 3 số oxi hóa của S tăng từ +4 lên +6 nên SO2 thể hiện tính khử.
Câu 29: Trộn 0,8 mol SO2 với 20,16 lít O2 (đktc) trong bình kín có thể tích không đổi là 100 lít, đun nóng bình đến 400oC, ở nhiệt độ này thấy áp suất trong bình là 0,8 atm. % các chất khí trong bình là
A. SO2 10%; O2 30%; SO3 60%.
B. SO2 15%; O2 70%; SO3 15%.
C. SO2 10%; O2 5%; SO3 65%.
D. SO2 20,69%; O2 44,83%; SO3 34,48%.
Lời giải:
Đáp án D
nO2 = 0,9 (mol), nSO2 = 0,8 (mol)
n sau phản ứng = 1,7 - x = 1,45
⇒ x = 0,25 (mol)
⇒ SO2 20,69%; O2 44,83%; SO3 34,48%.
Câu 30: Cặp khí nào sau đây không phân biệt được bằng dung dịch brom?
A. O2 và SO2. C. SO2 và CO2.
B. H2S và SO2. D. CO2 và H2S.
Lời giải:
Đáp án B
H2S + 4Br2 + 4H2O → H2SO4 + 8HBr
SO2 + Br2 + 2H2O → H2SO4 + 2HBr.
Xem thêm các dạng bài tập và công thức Hoá học lớp 10 hay, chi tiết khác:
Công thức tính nhanh khối lượng muối sunfat
Công thức tính nhanh số mol OH- khi cho SO2 với dung dịch kiềm
Công thức tính nhanh số mol OH- khi cho H2S tác dụng với dung dịch kiềm
Các dạng bài toán tính tốc độ trung bình của phản ứng hóa học
Xem thêm các chương trình khác:
- Giải sgk Vật Lí 10 | Giải bài tập Vật lí 10 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 10
- Tóm tắt tác phẩm Ngữ văn 10
- Soạn văn 10 (hay nhất) | Để học tốt Ngữ Văn 10 (sách mới)
- Soạn văn 10 (ngắn nhất) | Để học tốt Ngữ văn 10 (sách mới)
- Văn mẫu lớp 10 (cả ba sách) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Lịch sử 10 | Giải bài tập Lịch sử 10 Học kì 1, Học kì 2 (sách mới)