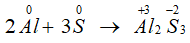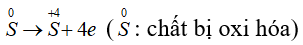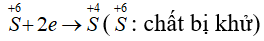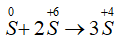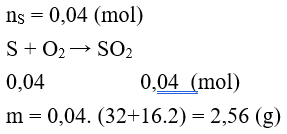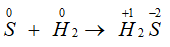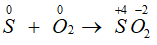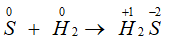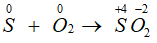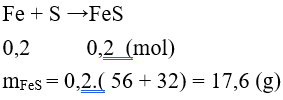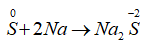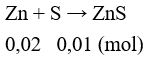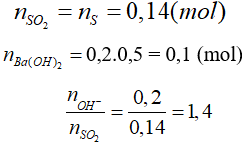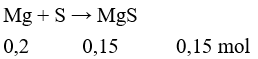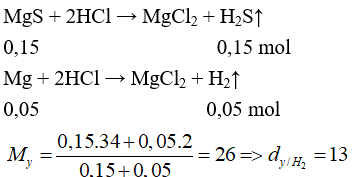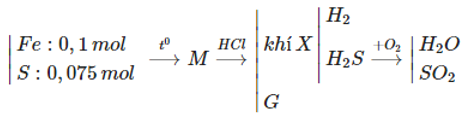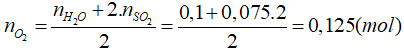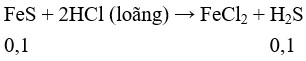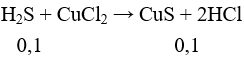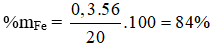50 bài tập về Lưu huỳnh (S) | Lý thuyết, phương pháp và cách giải mở rộng
Với tài liệu về 50 bài tập về Lưu huỳnh (S) bao gồm: lý thuyết và bài tập cũng như những định nghĩa, tính chất, các dạng bài sẽ giúp bạn nắm vững kiến thức và học tốt môn Hóa học hơn.
50 bài tập về Lưu huỳnh (S)
Câu 1: Vị trí của nguyên tố lưu huỳnh (z = 16) trong bảng tuần hoàn hóa học là
A. Ô thứ 16, chu kì 3, nhóm VIA.
B. Ô thứ 16, chu kì 2, nhóm VIA.
C. Ô thứ 16, chu kì 3, nhóm IVA.
D. Ô thứ 16, chu kì 2, nhóm IVA.
Lời giải:
Đáp án A.
Cấu hình electron của lưu huỳnh: 1s22s22p63s23p4
Lưu huỳnh thuộc ô thứ 16 (do z = 16), chu kỳ 3 (do có 3 lớp electron), nhóm VIA (do có 6e lớp ngoài cùng, nguyên tố p).
Câu 2: Nguyên tử nguyên tố X có tổng số electron ở các phân lớp p là 10. Nguyên tố X là
A. Na. B. Cl.
C. O. D. S.
Lời giải:
Đáp án D.
Cấu hình của X: 1s22s22p63s23p4.
→ X thuộc ô 16, chu kỳ 3, nhóm VIA. X là lưu huỳnh (S).
Câu 3: Số oxi hóa có thể có của lưu huỳnh trong hợp chất là
A. 0, 2, 4, 6. B. -2, 0, +4, +6.
C. 1, 3, 5, 7. D. -2, +4, +6.
Lời giải:
Đáp án D.
Ở trạng thái cơ bản S có 2 electron độc thân, ở trạng thái kích thích S có 4 hoặc 6 electron độc thân. Do đó trong hợp chất S có thể thể hiện các số oxi hóa -2, +4, +6.
Câu 4: Lưu huỳnh thể hiện tính oxi hóa khi tác dụng với chất nào dưới đây?
A. O2. B. Al.
C. H2SO4 đặc. D. F2.
Lời giải:
Đáp án B.
Số oxi hóa của S giảm từ 0 xuống -2, S thể hiện tính oxi hóa.
Câu 5: Cho phản ứng: S + 2H2SO4(đặc) → 3SO2↑ + 2H2O. Tỉ lệ số nguyên tử S bị khử và số nguyên tử S bị oxi hóa là
A. 1 : 2. B. 1 : 3.
C. 3 : 1. D. 2 : 1.
Lời giải:
Đáp án D.
Quá trình khử:
Quá trình oxi hóa:
PTSC:
→ Tỉ lệ số nguyên tử S bị khử và số nguyên tử S bị oxi hóa là 2 : 1.
Câu 6: Có bao nhiêu gam SO2 hình thành khi cho 1,28 gam S phản ứng hoàn toàn với lượng O2 dư?
A. 2,28 g B. 2,00 g
C. 1,00 g D. 2,56 g
Lời giải:
Đáp án D.
Câu 7: Đơn chất vừa có tính oxi hóa vừa có tính khử là
A. F2. B. O3.
C. S. D. O2.
Lời giải:
Đáp án C.
Số oxi hóa của S giảm từ 0 xuống -2, S thể hiện tính oxi hóa.
Số oxi hóa của S tăng từ 0 lên +4, S thể hiện tính khử.
Câu 8: Câu nào sau đây đúng khi nói về tính chất hoá học của lưu huỳnh?
A. Lưu huỳnh không có tính oxi hoá, tính khử.
B. Lưu huỳnh chỉ có tính oxi hoá.
C. Lưu huỳnh vừa có tính oxi hoá, vừa có tính khử.
D. Lưu huỳnh chỉ có tính khử.
Lời giải:
Đáp án C
Số oxi hóa của S giảm từ 0 xuống -2, S thể hiện tính oxi hóa.
Số oxi hóa của S tăng từ 0 lên +4, S thể hiện tính khử.
Câu 9: Dãy gồm các chất đều tác dụng trực tiếp với lưu huỳnh là
A. Hg, O2, HCl.
B. Pt, Cl2, HCl.
C. Zn, O2, F2.
D. Na, Br2, H2SO4 loãng.
Lời giải:
Đáp án C
Zn + S 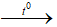
S + O2 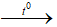
S + 3F2 → SF6
Câu 10: Kim loại nào sau đây tác dụng với lưu huỳnh ở nhiệt độ thường?
A. Al. B. Fe.
C. Hg. D. Cu.
Lời giải:
Đáp án C.
Hg + S → HgS
Câu 11: Nhận định nào sau đây là sai?
A. S vừa có tính oxi hoá vừa có tính khử.
B. Hg phản ứng với S ngay nhiệt độ thường.
C. Ở nhiệt độ thích hợp, S tác dụng với O2, Cl2, F2 thể hiện tính oxi hóa.
D. Ở nhiệt độ cao, S tác dụng với nhiều kim loại và thể hiện tính oxi hoá.
Lời giải:
Đáp án C
S thể hiện tính khử khi tác dụng với O2, Cl2, F2.
Câu 12: Đun nóng 11,2 gam Fe trong lưu huỳnh dư, khối lượng muối thu được sau phản ứng là
A. 8,8g. B. 17,6g.
C. 4,4g. D. 35,2 g.
Lời giải:
Đáp án B
Câu 13: Cho phản ứng hóa học: S + H2SO4đặc 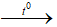
A. SO2. B. H2S.
C. H2SO3. D. SO3.
Lời giải:
Đáp án A
S + 2H2SO4 → 3SO2↑ + 2H2O
Câu 14: Nhận định nào sau về lưu huỳnh là sai?
A. S là chất rắn màu vàng.
B. S không tan trong nước.
C. S dẫn điện, dẫn nhiệt kém.
D. S không tan trong các dung môi hữu cơ.
Lời giải:
Đáp án A
S tan tốt trong dung môi hữu cơ.
Câu 15: Nung 6,5 gam Zn với bột lưu huỳnh. Khối lượng lưu huỳnh cần dùng để phản ứng hết với lượng kẽm là
A. 3,2 B. 1,6
C. 6,4 D. 4
Lời giải:
Đáp án A
Câu 16: Phản ứng nào sau đây lưu huỳnh đóng vai trò là chất oxi hóa?
A. S + O2 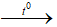
B. S + 2Na 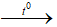
C. S + 2H2SO4(đ) 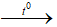
D. S + 6HNO3(đ) 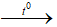
Lời giải:
Đáp án B
Câu 17: Cho các phản ứng sau:
(a) S + O2 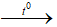
(b) S + 3F2 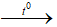
(c) S + 6HNO3 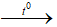
(d) S + Hg → HgS
Số phản ứng trong đó S thể hiện tính khử là
A. 2. B. 3.
C. 1. D. 4.
Lời giải:
Đáp án B
Các phương trình a, b, c.
Câu 18: Cho 1,3 gam kẽm tác dụng với 0,32 gam lưu huỳnh. Sau khi phản ứng xảy ra hoàn toàn, sản phẩm thu được là
A. ZnS. B. ZnS và S.
C. ZnS và Zn. D. ZnS, Zn và S.
Lời giải:
Đáp án C
Sau phản ứng thu được: ZnS: 0,01 mol và Zn dư 0,01 mol.
Câu 19: Hơi thủy ngân rất độc, bởi vậy khi làm vỡ nhiệt kế thủy ngân trong phòng thí nghiệm thì chất bột thường được dùng để rắc lên thủy ngân rồi gom lại là
A. vôi sống. B. cát.
C. muối ăn. D. lưu huỳnh.
Lời giải:
Đáp án D
Hg + S → HgS
Câu 20: Trộn sắt bột và lưu huỳnh bột rồi cho vào ống nghiệm khô. Đun ống nghiệm trên ngọn lửa đèn cồn, một lúc sau hỗn hợp cháy đỏ. Sản phẩm tạo thành là
A. sắt(II) sunfua có màu nâu đỏ.
B. sắt(II) sunfua có màu xám đen.
C. sắt(III) sunfua có màu nâu đỏ.
D. sắt(III) sunfua có màu xám đen.
Lời giải:
Đáp án B
Fe + S 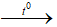
FeS có màu xám đen.
Câu 21: Nung một hỗn hợp gồm 4,8 gam bột Magie và 3,2 gam bột lưu huỳnh trong một ống nghiệm đậy kín. Khối lượng chất rắn thu được sau phản ứng là
A. 8,0g. B. 11,2g.
C. 5,6g. D. 4,8g.
Lời giải:
Đáp án A.
Áp dụng định luật bảo toàn khối lượng: msau = mtrước = 4,8 + 3,2 = 8 gam.
Câu 22: Đốt cháy hoàn toàn 4,48 g bột lưu huỳnh rồi cho sản phẩm cháy hấp thụ hoàn toàn vào 200 ml dung dịch Ba(OH)2 0,5M. Lượng chất kết tủa thu được sau phản ứng là
A. 10,85g. B. 21,7g.
C. 13,02 g. D. 16,725.
Lời giải:
Đáp án C.
Tạo 2 muối Ba(HSO3)2 và BaSO3
n↓ = nBaSO3 = 2.nBa(OH)2 - nSO2 = 0,2 - 0,14 = 0,06
mBaSO3 = 0,06.(137 + 32 + 48) = 13,02(g)
Câu 23: Đốt cháy đơn chất X trong oxi thu được khí Y. Mặt khác, X phản ứng với H2 (khi đun nóng) thu được khí Z. Cho Y và Z phản ứng với nhau thu được chất rắn màu vàng. Đơn chất X là
A. lưu huỳnh. B. cacbon.
C. photpho. D. nitơ.
Lời giải:
Đáp án A.
S + O2 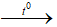
S + H2 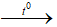
2H2S + SO2 → 3S↓ + 2H2O
Câu 24: Đun nóng 4,8 gam bột magie với 4,8 gam bột lưu huỳnh trong điều kiện không có không khí, thu được hỗn hợp rắn X. Hòa tan hoàn toàn X vào dung dịch HCl dư, thu được hỗn hợp khí Y. Tỉ khối hơi của Y so với H2 là
A. 9 B. 13
C. 26 D. 5
Lời giải:
Đáp án B
Hỗn hợp chất rắn X gồm: MgS: 0,15 mol và Mg dư: 0,05 mol.
Câu 25: Đun nóng 4,8 gam bột Mg với 9,6 gam bột lưu huỳnh (trong điều kiện không có không khí), thu được chất rắn X. Cho toàn bộ X vào lượng dư dung dịch HCl, thu được V lít khí (đktc). Giá trị của V là
A. 2,24 B. 3,36
C. 4,48 D. 6,72
Lời giải:
Đáp án C
Câu 26: Trộn 5,6 gam bột sắt với 2,4 gam bột lưu huỳnh rồi nung nóng (trong điều kiện không có không khí), thu được hỗn hợp rắn M. Cho M tác dụng với lượng dư dung dịch HCl, giải phóng hỗn hợp khí X và còn lại một phần không tan G. Để đốt cháy hoàn toàn X và G cần vừa đủ V lít khí O2(đktc). Giá trị của V là
A. 2,80 B. 3,36
C. 3,08 D. 4,48
Lời giải:
Đáp án A
nFe = 0,1 (mol), nS = 0,075 (mol)
Bảo toàn nguyên tố S có nSO2 = nS = 0,075 mol
Có nHCl phản ứng = 2.nFe = 0,2 mol
Bảo toàn nguyên tố H có nH2O = nHCl : 2 = 0,1 mol
Bảo toàn nguyên tố O có
⇒ VO2 = 0,125.22,4 = 2,8 (lít).
Câu 27: Cho m gam hỗn hợp bột Fe và S có nFe = 2nS rồi nung trong điều kiện không có oxi thu được hỗn hợp A. Hòa tan A bằng HCl dư thu được 1,6 gam chất rắn B, dung dịch C và hỗn hợp khí D. Sục D từ từ qua dung dịch CuCl2 thấy tạo ra 9,6 gam kết tủa đen. Giá trị của m là
A. 21,6. B. 10,8.
C. 7,2. D. 14,4.
Lời giải:
Đáp án A
Do A + HCl thu được chất rắn B nên S dư ⇒ A có FeS, S dư và Fe dư
Cho A vào HCl loãng có phản ứng:
Fe + 2HCl → FeCl2 + H2
Cho H2S vào CuCl2 có phản ứng:
Tính được:
nCuS = 0,1 mol = nFeS
nS dư = 0,05mol → nS = 0,15 mol, nFe = 0,3 mol
→ m = 32.0,15 + 0,3.56 = 21,6 gam
Câu 28: Nung nóng hỗn hợp bột X gồm a mol Fe và b mol S trong khí trơ, hiệu suất phản ứng bằng 50%, thu được hỗn hợp rắn Y. Cho Y vào dung dịch HCl dư, sau khi các phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Z có tỉ khối so với H2 bằng 5. Tỉ lệ a:b bằng
A. 2:1. B. 1:1.
C. 3:1. D. 3:2.
Lời giải:
Đáp án A
Fe + S → FeS
FeS + 2HCl → FeCl2 + H2S ↑
Fe + 2HCl → FeCl2 + H2 ↑
MZ = 5.2 = 10; Chọn 1 mol Z
⇒ nH2 + nH2S = 1
2nH2 + 34nH2S = 10
⇒ nH2 = 0,75 ; nH2S = 0,25
nFeS = nH2S = 0,25 mol;
nFe (dư) = nH2 = 0,75 mol
⇒ nFe(bđ) = 0,25 + 0,75 = 1 (mol)
Do Fe dư nên hiệu suất phản ứng tính theo S
⇒ nS(bđ) = (0,25.100):50 = 0,5 (mol)
⇒ a : b = 1 : 0,5 = 2 : 1
Câu 29: Cho 11 gam hỗn hợp bột sắt và bột nhôm phản ứng hoàn toàn với bột lưu huỳnh trong điều kiện không có không khí thấy có 12,8 gam lưu huỳnh tham gia phản ứng. Khối lượng sắt có trong 11 gam hỗn hợp đầu là
A. 5,6 gam. B. 11,2 gam.
C. 2,8 gam. D. 8,4 gam.
Lời giải:
Đáp án A
nS = 0,4 (mol)
Gọi số mol của Fe và Al trong hỗn hợp lần lượt là a và b
→ 56a + 27b = 11
Bảo toàn electron: 2nFe + 3nAl = 2nS → 2a + 3b = 0,8
⇒ nFe = 0,1, nAl = 0,2 ⇒ mFe = 0,1.56 = 5,6 (gam).
Câu 30: Nung nóng 20 gam một hỗn hợp X gồm Fe và S trong điều kiện không có không khí thu được hỗn hợp rắn A. Hòa tan hỗn hợp rắn A vào dung dịch HCl thu được 6,72 lít (đktc) hỗn hợp khí Y. Thành phần phần trăm khối lượng Fe trong X là
A. 28%. B. 56%.
C. 42%. D. 84%.
Lời giải:
Đáp án D
Fe + S → FeS
FeS + 2HCl → FeCl2 + H2S
Fe + 2HCl → FeCl2 + H2
nFe(bđ) = nFeS + nFe(dư) = nH2S + nH2 = 0,3 (mol)
Xem thêm các dạng bài tập và công thức Hoá học lớp 10 hay, chi tiết khác:
50 bài tập về Hidro Sunfua (H2S)
50 bài tập về Lưu huỳnh Đioxit (SO2)
Công thức tính nhanh khối lượng muối sunfat
Công thức tính nhanh số mol OH- khi cho SO2 với dung dịch kiềm
Công thức tính nhanh số mol OH- khi cho H2S tác dụng với dung dịch kiềm
Xem thêm các chương trình khác:
- Giải sgk Vật Lí 10 | Giải bài tập Vật lí 10 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 10
- Tóm tắt tác phẩm Ngữ văn 10
- Soạn văn 10 (hay nhất) | Để học tốt Ngữ Văn 10 (sách mới)
- Soạn văn 10 (ngắn nhất) | Để học tốt Ngữ văn 10 (sách mới)
- Văn mẫu lớp 10 (cả ba sách) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Lịch sử 10 | Giải bài tập Lịch sử 10 Học kì 1, Học kì 2 (sách mới)