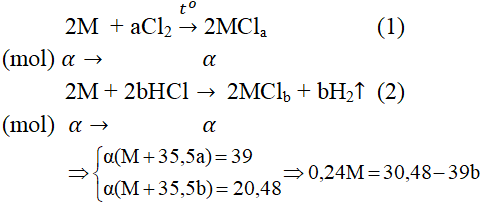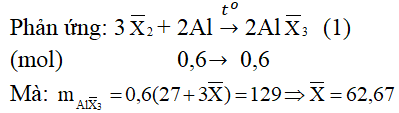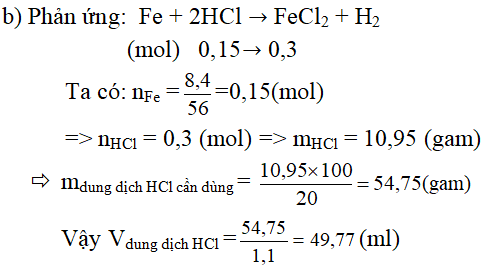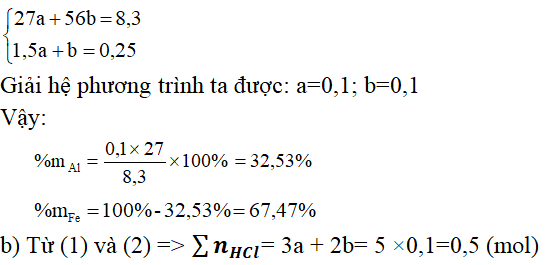Các dạng bài toán Kim loại tác dụng với Halogen | Lý thuyết, công thức, các dạng bài tập và cách giải
Với tài liệu về Các dạng bài toán Kim loại tác dụng với Halogen bao gồm: lý thuyết và bài tập cũng như những định nghĩa, tính chất, các dạng bài sẽ giúp bạn nắm vững kiến thức và học tốt môn Hóa học hơn.
Các dạng bài toán Kim loại tác dụng với Halogen
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
Một số lưu ý:
Khi kim loại tác dụng với các chất oxi hóa mạnh như F2, Cl2, Br2 sẽ được oxi hóa lên hóa trị cao nhất.
Ví dụ: 2Fe + 3Cl2 → 2FeCl3; Fe + 2HCl → FeCl2 + H2
Ví dụ minh họa
Ví dụ 1. Cho 5,25 gam hỗn hợp bột nhôm và magie vào dung dịch HCl dư, thu được 5,88 lít khí (đktc). Viết phản ứng xảy ra và tính phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu?
Hướng dẫn:
Gọi a là số mol của Al và b là số mol của Mg
Ví dụ 2: Cho 4,8 g một kim loại R thuộc nhóm IIA tác dụng hết với dung dịch HCl thu được 4,48 lít khí H2 (đktc).
a) Viết phương trình hóa học của phản ứng xảy ra và tính số mol hiđro thu được.
b) Xác định tên kim loại R.
c) Tính khối lượng muối khan thu được
Hướng dẫn:
a, PTHH: R + 2HCl → RCl2 + H2
nH2 = 4,48/22,4 = 0,2 mol
b, nR = nH2 = 0,2 mol
MR = 4,8/0,2 = 24 (Mg)
c, mMgCl2 = (24 + 71) . 0,2 = 19g
Ví dụ 3: Để hoà tan hoàn toàn 8,1g một kim loại X thuộc nhóm IIIA cần dùng 450 ml dung dịch HCl 2M, thu được dung dịch A và V lít khí H2 (đktc).
a) Xác định X
b) Tính giá trị V.
c) Tính nồng độ mol của dung dịch A, xem như thể tích dung dịch thay đổi không đáng kể.
Hướng dẫn:
a, PTHH: 2X + 6HCl → 2XCl3 + 3H2
nHCl = 0,45 .2 =0,9 mol ⇒ nX = 0,9/3= 0,3 mol
MX = 8,1 /0,3 = 27 (Al)
b, nH2 = 1/2nHCl =0,45 mol
VH2 = 0,45 .22,4 = 10,08 l
c, Dung dịch A là AlCl3
nAlCl3 = nX = 0,3 mol
CM = n/V = 0,3/0,45 = 0,67M
B. Bài tập trắc nghiệm
Câu 1. Lấy một lượng kim loại M tác dụng với khí clo dư thu được 39 gam muối clorua. Cũng lượng kim loại đó tác dụng với dung dịch HCl dư, cô cạn dung dịch thu được 39,48 gam muối clorua khan. Hỏi kim loại M đem dùng là gì?
Lời giải:
Đáp án:
Gọi α là số mol kim loại M tham gia trong mỗi thí nghiệm.
Bảng biện luận
| a | 1 | 1 | 2 | 2 | 3 | 3 |
| b | 1 | 2 | 1 | 3 | 2 | 1 |
| M | < 0 | < 0 | 91,5 | < 0 | 56(Fe) | 218,5 |
| Loại | Loại | Loại | Loại | Nhận | Loại |
Câu 2. Cho 16,2 gam nhôm phản ứng vừa đủ với 90,6 gam hỗn hợp hau halogen thuộc hai chu kì liên tiếp nhau trong bảng tuần hoàn. Xác định tên của halogen đem dùng.
Lời giải:
Đáp án:
Gọi công thức chung của hai halogen là: X−2 (gồm halogen A và B, giả sử MA < MB)
Suy ra: A là clo(35,5); B là brom (80)
Câu 3. Cho 2, 8 gam kim loại M (chưa biết hóa trị) tác dụng với khí clo dư thu được 8,125 gam muối clorua.
a. Hãy xác định kim loại M
b. Để hòa tan hết 8,4 gam kim loại M ở trên cần dùng bao nhiêu ml dung dịch HCl 20% (d = 1,1 g/ml) ?
Lời giải:
Đáp án:
+) Nếu n = 1 ⇒ M = 18,67 (loại)
+) Nếu n = 2 ⇒ M = 37,33 (loại)
+) Nếu n = 3 ⇒ M = 56 (Kim loại M là Fe)
Câu 4. Đốt cháy 11,9 gam hỗn hợp gồm Zn, Al trong khí Cl2 dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được 40,3 gam hỗn hợp muối. Thể tích khí Cl2 (ở đktc) đã phản ứng là bao nhiêu?
Lời giải:
Đáp án:
Bảo toàn khối lượng mCl2 = mMuối − mKL = 28,4 gm
⇒ nCl2 = 0,4 mol ⇒ V = 8,96 (l)
Câu 5. Hỗn hợp khí A gồm clo và oxi. A phản ứng vừa hết với một hỗn hợp gồm 4,8 gam magie và 8,1 gam nhôm tạo ra 37,05 gam hỗn hợp các muối clorua và oxit của hai kim loại. Xác định thành phần phần trăm theo khối lượng và theo thể tích của hỗn hợp A.
Lời giải:
Đáp án:
Các phương trình hóa học:
Mg + Cl2 → MgCl2 (1)
2Al + 3Cl2 → AlCl3 (2)
3Mg + O2 → 2MgO (3)
4Al + 3O2 → 2AlO3 (4)
Khối lượng hỗn hợp sau phản ứng tăng = khối lượng oxi và clo tham gia phản ứng:
37, 05 – (4,80 + 8,10) = 24, 15 (gam)
nMg = 4,8/24 = 0,2(mol); nAl = 8,1/27 = 0,3 (mol);
Gọi số mol O2 trong hỗn hợp là x, số mol Cl2 là y
Phương trình nhường e:
Al → Al3+ + 3e
Mg → Mg2+ + 2e
Tổng số mol e nhường là: 0,2 × 2 + 0,3 × 3 = 1,3 (mol)
Phương trình nhận e:
O2 + 4e → 2O2-
Cl2 + 2e → 2Cl-
Tổng số mol e nhận là: 4x + 2y
Số e nhường = số e nhận nên: 4x + 2y = 1,3 (*)
Khối lượng Cl2 và O2 tham gia phản ứng là 24, 15 gam, ta có:
32x + 71y = 24,15 (**)
Kết hợp (*) và (**), ta có hệ phương trình:
Câu 6. Hòa tan 8,3 gam hỗn hợp gồm Al và Fe bằng dung dịch HC1 dư, thu được 5,6 lít H2 (đktc) và dung dịch A.
a. Tính phần trăm theo khối lượng mỗi muối trong hỗn hợp ban đầu.
b. Tính thể tích dung dịch HCl 2M đã dùng biết đã dùng dư 10cm3 so với lí thuyết.
c. Dẫn khí Cl2 dư vào dung dịch A. Cô cạn dung dịch sau phản ứng thì thu được bao nhiêu gam muối khan.
Lời giải:
Đáp án:
a)Tính phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu:
Ta có: nH2 = 5,6/22,4 = 0,25(mol)
Gọi a là số mol của Al và b là số mol của Fe
Phản ứng:
2Al + 6HCl → 2AlCl3 + 3H2 ↑ (1)
(mol) a → 3a 3a/2
Fe + 2HCl → FeCl2 + H2 ↑ (2)
(mol) b → 2b b
Gọi a là số mol của Al và b là số mol của Fe.
Theo đề bài, ta có hệ phương trình:
VHCl phản ứng = 0,5/2 = 0,25 (lít) = 250(ml)
Vậy VHCl đã dùng = 250 + 10 = 260 (ml)
c) Khối lượng muối khan:
Cl2 + AlCl3 → không phản ứng
Cl2 + 2FeCl2 → 2FeCl3
(mol) 0,1 → 0,1
Khối lượng muối khan thu được là:
mmuối khan = mAlCl3 + mFeCl3 = 0,1 ×(133,5 + 162,5) = 29,6 (gam)
Xem thêm các dạng bài tập và công thức Hoá học lớp 10 hay, chi tiết khác:
Các dạng bài toán Halogen tác dụng với muối của halogen yếu hơn
Xem thêm các chương trình khác:
- Giải sgk Vật Lí 10 | Giải bài tập Vật lí 10 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 10
- Tóm tắt tác phẩm Ngữ văn 10
- Soạn văn 10 (hay nhất) | Để học tốt Ngữ Văn 10 (sách mới)
- Soạn văn 10 (ngắn nhất) | Để học tốt Ngữ văn 10 (sách mới)
- Văn mẫu lớp 10 (cả ba sách) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Lịch sử 10 | Giải bài tập Lịch sử 10 Học kì 1, Học kì 2 (sách mới)