Công thức tính hiệu độ âm điện (2025) chi tiết nhất
Với tài liệu về Công thức tính hiệu độ âm điện bao gồm: lý thuyết và bài tập cũng như những định nghĩa, tính chất, các dạng bài sẽ giúp bạn nắm vững kiến thức và học tốt môn Hóa học hơn.
Công thức tính hiệu độ âm điện
Hiệu độ âm điện cho ta dự đoán về mặt lý thuyết liên kết trong phân tử. Vậy công thức hiệu tính hiệu độ âm điện như thế nào? Cách dự đoán liên kết dựa vào hiệu độ âm điện ra sao? Bài viết này sẽ giúp các em hiểu rõ điều này.
1. Công thức tính hiệu độ âm điện
- Giả sử hợp chất có dạng AxBy.
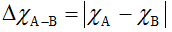
Trong đó:
+ 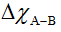 Hiệu độ âm điện
Hiệu độ âm điện
+ 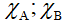 : Độ âm điện của A và B
: Độ âm điện của A và B
Chú ý: Do đặt phép tính trong dấu giá trị tuyệt đối, nên hiệu độ âm điện luôn ≥ 0.
Ví dụ:
Tính hiệu độ âm điện của Na và Cl trong phân tử NaCl, biết độ âm điện của Cl là 3,16; độ âm điện của Na là 0,93.
Hướng dẫn:
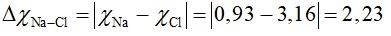
- Hiệu độ âm điện giúp đánh giá loại liên kết trong phân tử hợp chất một cách định tính.
2. Bạn nên biết
- Độ âm điện của một nguyên tử đặc trưng cho khả năng hút electron của nguyên tử đó khi hình thành liên kết hóa học.
- Dưới đây là bảng độ âm điện của nguyên tử một số nguyên tố nhóm A theo Pau – linh
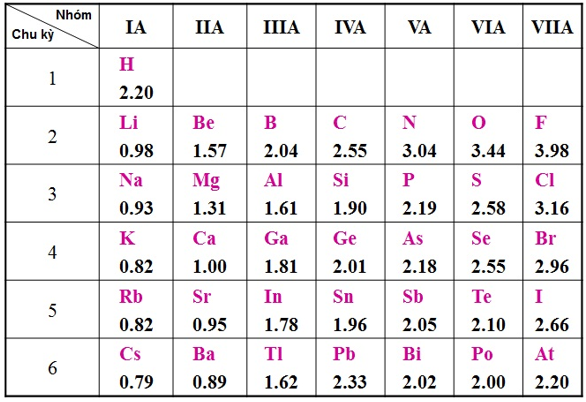
3. Mở rộng
Người ta phân loại một cách tương đối loại liên kết hóa học theo quy ước kinh nghiệm dựa vào độ âm điện của Pau – linh như sau:
|
Hiệu độ âm điện |
Loại liên kết |
|
Từ 0 đến < 0,4 |
Liên kết cộng hóa trị không cực |
|
Từ 0,4 đến < 1,7 |
Liên kết cộng hóa trị có cực |
|
≥ 1,7 |
Liên kết ion |

4. Bài tập minh họa
Câu 1: Dựa vào hiệu độ âm điện, hãy xác định loại liên kết trong phân tử HCl (biết độ âm điện của H là 2,2; độ âm điện của Cl là 3,16)
Hướng dẫn
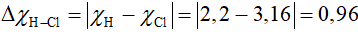
Có 0,4 < 0,96 < 1,7, vậy liện kết giữa H và Cl là liên kết cộng hóa trị có cực.
Câu 2: Cho biết độ âm điện của Ca = 1,00; Al = 1,61; Cl = 3,16; S = 2,58. Trong các hợp chất CaS, CaCl2, Al2S3; AlCl3. Số hợp chất có liên kết ion là
A. 1. B. 2. C. 3. D. 4.
Hướng dẫn:
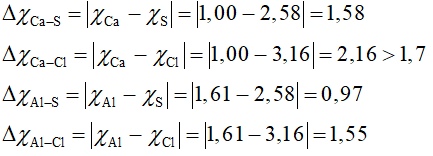
Vậy chỉ có hợp chất CaCl2 có liên kết ion.
Đáp án A
Xem thêm các dạng bài tập và công thức Hoá học lớp 10 hay, chi tiết khác:
Các dạng bài toán xác định loại phản ứng hóa học
Các dạng bài toán xác định chất khử, chất oxi hóa trong phản ứng hóa học
Các dạng bài toán xác định số oxi hóa của các nguyên tố
Các dạng bài toán Phương pháp, cách cân bằng phản ứng oxi hóa khử
Xem thêm các chương trình khác:
- Giải sgk Vật Lí 10 | Giải bài tập Vật lí 10 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 10
- Tóm tắt tác phẩm Ngữ văn 10
- Soạn văn 10 (hay nhất) | Để học tốt Ngữ Văn 10 (sách mới)
- Soạn văn 10 (ngắn nhất) | Để học tốt Ngữ văn 10 (sách mới)
- Văn mẫu lớp 10 (cả ba sách) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Lịch sử 10 | Giải bài tập Lịch sử 10 Học kì 1, Học kì 2 (sách mới)
