50 bài tập về tốc độ phản ứng và cân bằng hóa học | Lý thuyết, phương pháp và cách giải mở rộng
Với tài liệu về 50 bài tập về tốc độ phản ứng và cân bằng hóa học bao gồm: lý thuyết và bài tập cũng như những định nghĩa, tính chất, các dạng bài sẽ giúp bạn nắm vững kiến thức và học tốt môn Hóa học hơn.
50 bài tập về tốc độ phản ứng và cân bằng hóa học
Bài 1. Cho phản ứng thuận nghịch sau ở nhiệt độ cao:
3Fe + 4H2 O → Fe2 O4 + 4H2 ↑
Cân bằng phản ứng sẽ dịch chuyển theo chiều nào khi.
a) Tăng nồng độ của H2
b) Giảm nồng độ của H2O
Lời giải:
Cân bằng sẽ dịch chuyển theo chiều nghịch khi tăng nồng độ H2
Cân bằng cũng dịch chuyển theo chiều nghịch khi giảm nồng độ H2O
Bài 2. Xét các hệ cân băng sau:
C(r)+ H2O(k) 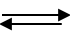
CO(k)+ H2(k) 
Các cân bằng trên chuyển dịch như thế nào khi biến đổi trong một các điều kiện sau:
Tăng nhiệt độ.
Thêm lượng hơi nước vào.
Lấy bớt H2 ra.
Tăng áp suất chung bằng cách nén cho thể tích của hệ giảm xuống.
Dùng chất xúc tác.
Lời giải:
Tăng nhiệt độ: Cân bằng chuyển dịch theo chiều nghịch
Thêm lượng hơi nước: Cân bằng chuyển dịch theo chiều thuận
Thêm khí H2 vào: Cân bằng chuyển dịch theo chiều nghịch
Tăng áp suất chung bằng cách nén cho thể tích của hệ giảm xuống không làm chuyển dịch cân bằng
Dùng chất xúc tác: không làm chuyển dịch cân bằng
Bài 3. Cho cân bằng hóa học: 2NO2 ⇋ N2 O4 ΔH= -58,04kJ. Cân bằng sẽ chuyển dịch như thế nào, giải thích, khi:
Tăng nhiệt độ, tăng áp suất.
Thêm khí trơ Ar trong 2 trường hợp: Giữ áp suất không đổi và giữ thể tích không đổi.
Thêm xúc tác.
Lời giải:
Phản ứng hóa học: 2NO2 ⇋ N2 O4 ΔH= -58,04kJ ΔH<0 là phản ứng tỏa nhiệt.
a) Khi tăng nhiệt độ, phản ứng thu nhiệt nên cân bằng được chuyển dịch sang trái. Tăng áp suất, cân bằng được chuyển dịch sang phải để tạo thành số moi khí nhỏ hơn.
b) Khi thêm Ar trong trường hợp giữ áp suất không đổi nghĩa là tăng thể tích của hệ, cân bằng không chuyển dịch.
Khi thêm Ar trong trường hợp giữ thể tích không đổi nghĩa là tăng áp suất của hệ nhưng do Kp= 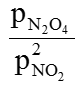
c) Khi thêm chất xúc tác, chỉ làm tăng tốc độ phản ứng chứ không chuyển dịch cân bằng.
Bài 4. Tại sao khi làm than để đun bếp người ta lại làm các lỗ rỗng (gọi là than tổ ong), hay khi cần đun bếp cho lửa cháy to thì chẻ nhỏ củi, trong khi cần cháy lâu, lửa nhỏ thì người ta lại dùng thanh củi lớn?
Lời giải:
Phản ứng cháy của than và củi là phản ứng của chất rắn (than, củi) với chất khí (oxi trong không khí) là phản ứng dị thể. Nên để tăng tốc độ phản ứng cần tăng diện tích bề mặt. Để tăng khả năng cháy của than và củi người ta tăng diện tích bề mặt của than và củi, khi muốn thanh củi cháy chậm lại người ta dùng thanh củi to để giảm diện tích bề mặt.
Bài 5. Hãy giải thích vì sao người ta thực hiện các quá trình sản xuất trong các trường hợp sau:
a) Dùng không khí nén, nóng thổi vào lò cao để đốt cháy than cốc (trong sản xuất gang)..
b) Nung đá vôi ở nhiệt độ cao ≈ 900 - 950oC để sản xuất vôi sống miệng lò hở.
c) Nghiền nguyên liệu trước khi đưa vào lò nung để sản xuất clanhke (trong sản xuất xi măng).
Lời giải:
a) Phản ứng trong lò cao:
C + O2( k) → CO2 (k )
C + CO2 (k) → 2CO (k)
FeO + CO (k) → Fe + CO2 (k) ΔH> 0
Dùng không khí nén, nóng thổi vào lò cao để đốt cháy than cốc (trong sản xuất gang). Tăng nồng dộ khí oxi và tăng nhiệt độ để tăng tốc độ phản ứng thuận.
b) Phản ứng nung vôi: CaCO3 → CaO + CO2 (k) ΔH> 0
Nung đá vôi ở nhiệt độ cao ≈ 900 — 950oC để sản xuất vôi sống. Yếu tố nhiệt độ làm tăng tốc độ phản ứng hóa học. Miệng lò hở để giảm áp suất của khí CO2 để chuyển dịch cân bằng.
c) Nghiền nguyên liệu trước khi đưa vào lò nung để sản xuất clanhke (trong sản xuất xi măng). Tăng diện tích tiếp xúc giữa nguyên liệu và nhiệt độ cao, tăng tốc độ phản ứng.
Bài 6. Phản ứng hóa học tổng hợp amoniac là:
N2 + 3H2 ⇋ 2NH3 với ΔH= -92KJ
Hãy giải thích tại sao người ta thực hiện phản ứng tổng hợp amoniac ở khoảng 400oC đến 500oC, dưới áp suất cao (100 - 150atm, thực tế càng cao càng tốt) và dùng sắt hoạt hóa xúc tác.
Lời giải:
Phản ứng hóa học tổng hợp amoniac là:
N2 + 3H2 ⇋ 2NH3 với ΔH= -92KJ
Đặc điểm của phản ứng tổng hợp NH3 là sau phản ứng có sự giảm số mol so với ban đầu, phản ứng tỏa nhiệt. Khi tăng áp suất, cân bằng chuyển sang chiều thuận, nên phản ứng thực hiện ở áp suất càng cao càng tốt. Do phản ứng tỏa nhiệt cho nên về nguyên tắc cân bằng sẽ chuyển sang chiều thuận khi giảm nhiệt độ, tuy nhiên khi nhiệt độ thấp thì tốc độ phản ứng lại chậm nên hiệu quả kinh tế thấp. Do đó, người ta dung hòa hai xu hướng trên ở nhiệt độ 400 – 450oC. Chất xúc tác nhằm mục đích tăng tốc độ của phản ứng.
Xem thêm các dạng bài tập và công thức Hoá học lớp 10 hay, chi tiết khác:
Các dạng bài toán tính nồng độ các chất ở trạng thái cân bằng
50 bài tập về cân bằng hóa học
Xem thêm các chương trình khác:
- Giải sgk Vật Lí 10 | Giải bài tập Vật lí 10 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 10
- Tóm tắt tác phẩm Ngữ văn 10
- Soạn văn 10 (hay nhất) | Để học tốt Ngữ Văn 10 (sách mới)
- Soạn văn 10 (ngắn nhất) | Để học tốt Ngữ văn 10 (sách mới)
- Văn mẫu lớp 10 (cả ba sách) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Lịch sử 10 | Giải bài tập Lịch sử 10 Học kì 1, Học kì 2 (sách mới)
