50 bài tập về Oleum | Lý thuyết, phương pháp và cách giải mở rộng
Với tài liệu về 50 bài tập về Oleum bao gồm: lý thuyết và bài tập cũng như những định nghĩa, tính chất, các dạng bài sẽ giúp bạn nắm vững kiến thức và học tốt môn Hóa học hơn.
50 bài tập về Oleum
A. Phương pháp giải
- Oleum có công thức là H2SO4.nSO3. Khi Oleum tác dụng với nước ta có:
(n +1)H2SO4
- Nguyên tắc pha loãng axit sunfuric đặc: Rót axit sunfuric (H2SO4) vào nước và khuấy nhẹ bằng đũa thủy tinh mà không làm ngược lại.
- Phương pháp: Áp dụng phương pháp đường chéo hoặc bảo toàn khối lượng.
B. Ví dụ minh họa
Ví dụ 1: Có 200 ml dung dịch H2SO4 98% có khối lượng riêng d = 184 g/cm3. Thể tích nước cần dùng để pha loãng H2SO4 trên thành H2SO4 35% là
A. 662,4 ml
B. 331,2 ml
C. 300 ml.
D. 501,2 ml
Hướng dẫn giải
Khối lượng H2SO4 98% là:
Áp dụng quy tắc đường chéo ta có:
368 gam dd H2SO4 có C%= 98% 35%
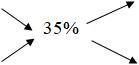
x gam dd H2O có C%= 0% 63%
Vì nên
Đáp án A
Ví dụ 2: Trộn 200 gam dung dịch H2SO4 12% với 300 gam dung dịch H2SO4 40% thu được 500 gam dung dịch H2SO4 a%. Giá trị của a là:
A. 20,8%.
B. 28,8%.
C. 25,8%.
D. 30,8%.
Hướng dẫn giải
Đán án B
Ví dụ 3: Hòa tan 8,36g oleum vào nước được dung dịch Y, để trung hòa dung dịch Y cần 200 ml dung dịch NaOH 1M. Công thức phân tử của oleum:
A. H2SO4. 2SO3
B. H2SO4.3SO3
C. H2SO4. 5SO3
D. H2SO4. 4SO3
Hướng dẫn giải
Gọi công thức phân tử của oleum là: H2SO4.nSO3
Dung dịch Y là dung dịch H2SO4
→ CTPT của oleum: H2SO4.4SO3
Đáp án D
C. Bài tập tự luyện
Câu 1: Để pha loãng dung dịch H2SO4 đặc, người ta dùng cách nào sau đây?
A. Đổ nhanh dung dịch H2SO4 đặc vào nước, khuấy đều.
B. Rót từ từ nước vào dung dịch H2SO4 đặc, khuấy đều.
C. Rót từ từ dung dịch H2SO4 đặc vào nước, khuấy đều.
D. Đổ nhanh nước vào dung dịch H2SO4 đặc, khuấy đều.
Đáp án C
Câu 2: Để pha loãng 100 ml dung dịch H2SO4 98% (D = 1,84g/cm3) thành dung dịch H2SO4 20% cần V ml H2O. Giá trị của V là
A. 717,6
B. 617,5
C. 524,6
D. 814,2
Hướng dẫn giải
Khối lượng dung dịch axit 20% là:
Đáp án A
Câu 3: Hòa tan 0,4 gam SO3 vào a gam dung dịch H2SO4 10% thu được dung dịch H2SO4 12,25%. Giá trị a là
A. 20,6 gam
B. 16,9 g
C. 26,0 g
D. 19,6g
Hướng dẫn giải
Trong a gam dung dịch H2SO4 10%, có:
Khối lượng dung dịch sau phản ứng:
Đán án D
Câu 4: Cần bao nhiêu gam dung dịch H2SO4 35% để hòa tan vào đó 140 gam SO3 thu được dung dịch axit có nồng độ 70%?
A. 200 gam.
B. 220 gam.
C. 210 gam.
D. 250 gam.
Hướng dẫn giải
Cần lấy x gam dung dịch H2SO4 35%
Khối lượng dung dịch sau phản ứng là: mdd = x + 140
Đáp án C
Câu 5: Hòa tan hết 1,69 gam oleum có công thức H2SO4.3SO3 vào nước dư. Trung hòa dung dịch thu được cần V ml dung dịch KOH 1M. Giá trị của V là
A. 20
B. 40
C. 30
D. 10
Hướng dẫn giải
Đáp án B
Câu 6: Hấp thụ m gam SO3 vào 100 gam dung dịch H2SO4 96,4% thu được một loại oleum có phần trăm khối lượng SO3 là 40,82%. Giá trị của m là:
A. 104
B. 80
C. 96
D. 98
Hướng dẫn giải
Đáp án C
Câu 7: Khối lượng FeS2 cần dùng để điều chế một lượng SO3 đủ để hòa tan vào 100 gam H2SO4 91% thành oleum chứa 12,5% SO3 là
(Giả thiết các phản ứng xảy ra hoàn toàn)
A. 45 gam.
B. 48 gam.
C. 54 gam.
D. 35,8 gam.
Hướng dẫn giải
Trong 100 gam dung dịch H2SO4 91% chứa:
SO3 điều chế từ FeS2 hòa tan vào dung dịch H2SO4 xảy ra 2 phản ứng:
→ Tổng khối lượng H2SO4 trong oleum là:
Gọi lượng SO3 tạo oleum là x mol
Bảo toàn nguyên tố S:
→m = 45 gam
Đáp án A
Câu 8: Hoà tan 418 gam oleum X (H2SO4.nSO3) vào nước người ta phải dùng 1 lít dung dịch KOH 0,1M để trung hoà. Công thức phân tử của oleum:
A. H2SO4.3SO3
B. H2SO4.2SO3
C. H2SO4.4SO3
D. H2SO4.nSO3
Hướng dẫn giải
Quy đổi oleum X thành H2O.xSO3 (Vì có thể coi H2SO4 là H2O.SO3)
Sơ đồ phản ứng:
Ta có:
Đáp án C
Câu 9: Có một oleum công thức là H2SO4.3SO3. Cần bao nhiêu gam oleum này để pha vào 100 ml dung dịch H2SO4 40% (d=1,31ml) để tạo ra oleum có hàm lượng SO3 là 10%
A. 274, 55 (g)
B. 823,65 (g)
C. 449,15 (g)
D. 59,10 (g)
Hướng dẫn giải
Đáp án D
Câu 10: Cho 0,015 mol một loại hợp chất oleum vào nước thu được 200 ml dung dịch X. Để trung hoà 100 ml dung dịch X cần dùng 200 ml dung dịch NaOH 0,15M. Phần trăm về khối lượng của nguyên tố lưu huỳnh trong oleum trên gần với giá trị nào nhất sau đây?
A. 36%.
B. 33%.
C. 38%.
D. 23%.
Hướng dẫn giải
Gọi công thức của oleum là H2SO4.nSO3
nNaOH = 0,2.0,15 = 0,03 mol
- Trong 100 ml dung dịch X:
H2SO4 + 2NaOH → Na2SO4 + H2O
0,015 ← 0,03
- Trong 200 ml dung dịch X:
Gọi công thức của oleum là H2SO4.nSO3
H2SO4.nSO3 + nH2O → (n+1)H2SO4
0,15 (n + 1)
→ H2SO4.SO3
Đáp án A
Xem thêm các dạng bài tập và công thức Hoá học lớp 10 hay, chi tiết khác:
50 bài tập về dung dịch H2SO4 loãng
50 bài tập về dung dịch H2SO4 đặc
50 bài tập về tính chất hóa học, phương pháp điều chế Oxi, Lưu huỳnh
Các dạng bài toán nhận biết oxi, ozon, lưu huỳnh, SO2, SO3, H2S
Các dạng bài toán hoàn thành phản ứng hóa học Oxi, Lưu huỳnh
Xem thêm các chương trình khác:
- Giải sgk Vật Lí 10 | Giải bài tập Vật lí 10 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 10
- Tóm tắt tác phẩm Ngữ văn 10
- Soạn văn 10 (hay nhất) | Để học tốt Ngữ Văn 10 (sách mới)
- Soạn văn 10 (ngắn nhất) | Để học tốt Ngữ văn 10 (sách mới)
- Văn mẫu lớp 10 (cả ba sách) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Lịch sử 10 | Giải bài tập Lịch sử 10 Học kì 1, Học kì 2 (sách mới)
