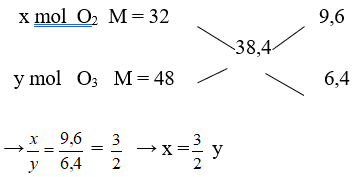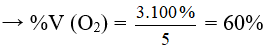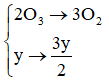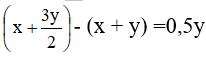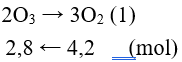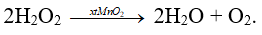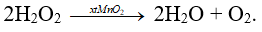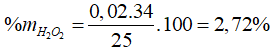50 bài tập về Ozon (O3) và Hidropeoxit | Lý thuyết, phương pháp và cách giải mở rộng
Với tài liệu về 50 bài tập về Ozon (O3) và Hidropeoxit bao gồm: lý thuyết và bài tập cũng như những định nghĩa, tính chất, các dạng bài sẽ giúp bạn nắm vững kiến thức và học tốt môn Hóa học hơn.
50 bài tập về Ozon (O3) và Hidropeoxit
Câu 1: Ứng dụng nào sau đây không phải của ozon?
A. Tẩy trắng tinh bột, dầu ăn.
B. Chữa sâu răng.
C. Điều chế oxi trong phòng thí nghiệm.
D. Sát trùng nước sinh hoạt.
Lời giải:
Đáp án C
Trong công nghiệp ozon dùng để tẩy trắng tinh bột, dầu ăn. Trong y học, ozon dùng để chữa sâu răng. Trong đời sống, ozon dùng để sát trùng nước sinh hoạt.
Câu 2: Hãy chọn phát biểu đúng về oxi và ozon?
A. Ozon có tính oxi hóa mạnh hơn oxi.
B. Oxi và ozon đều có số proton và số nơtron giống nhau trong phân tử.
C. Oxi và ozon là đồng phân của nhau.
D. Oxi và ozon đều phản ứng được với dung dịch KI.
Lời giải:
Đáp án A
Ozon là một trong số những chất có tính oxi hóa mạnh và mạnh hơn oxi.
Câu 3: Tầng ozon nằm ở tầng nào của khí quyển trái đất?
A. Tầng đối lưu. B. Tầng trung lưu.
C. Tầng bình lưu. D. Tầng điện li
Lời giải:
Đáp án C
Ozon nằm ở tầng bình lưu, cách mặt đất khoảng 20 – 30 km.
Câu 4: Nhận định nào sau đây không đúng khi nói về tính chất của ozon?
A. Có tính oxi hóa mạnh nhưng không có tính khử.
B. Là chất khí màu xanh nhạt, khi hóa lỏng có màu xanh đậm.
C. Khử được Ag thành Ag2O.
D. Không bền, dễ bị phân hủy thành O2.
Lời giải:
Đáp án C
Ozon oxi hóa Ag thành Ag2O.
Câu 5: Khi cho O3 tác dụng lên giấy có tẩm KI và hồ tinh bột, thấy tờ giấy xuất hiện màu xanh. Hiện tượng màu xanh này xảy ra do nguyên nhân nào?
A. Sự oxi hóa tinh bột tạo thành hợp chất có màu xanh.
B. Sự oxi hóa kali tạo thành hợp chất có màu xanh.
C. Sự oxi hóa iotua sinh ra I2, I2 kết hợp với hồ tinh bột tạo hợp chất bọc màu xanh.
D. Sự oxi hóa ozon tạo thành hợp chất có màu xanh.
Lời giải:
Đáp án C
2KI + O3 + H2O → I2 + 2KOH + O2
I2 kết hợp với hồ tinh bột tạo hợp chất bọc màu xanh.
Câu 6: Tính chất nào làm cho ozon có nhiều ứng dụng trong thực tế?
A. Tính khử. B. Tính phi kim.
C. Tính oxi hóa. D. Tính kém bền.
Lời giải:
Đáp án C
Những ứng dụng của ozon dựa trên tính oxi hóa mạnh của nó.
Câu 7: Chất khí có màu xanh nhạt, có mùi đặc trưng là
A. Cl2. B. SO2.
C. O3. D. H2S.
Lời giải:
Đáp án C
Khí ozon có màu xanh nhạt, có mùi đặc trưng.
Câu 8: Nội dung sai là
A. O3 là một dạng thù hình của O2.
B. O3 tan nhiều trong nước hơn O2.
C. Ở điều kiện thường, O3 oxi hoá được Ag thành Ag2O.
D. O3 oxi hoá được tất cả các kim loại.
Lời giải:
Đáp án D
Ozon phản ứng với hầu hết các kim loại trừ Au, Pt .
Câu 9: Ở nhiệt độ thường, phương trình hoá học đúng là
A. 4Ag + O2 → 2Ag2O.
B. 6Ag + O3 → 3Ag2O.
C. 2Ag + O3 → Ag2O + O2.
D. 2Ag + 2O2 → Ag2O + O2.
Lời giải:
Đáp án C
2Ag + O3 → Ag2O + O2.
Câu 10: Ở điều kiện thường, để so sánh tính oxi hóa của oxi và ozon ta có thể dùng
A. Au. B. Hg.
C. S. D. KI.
Lời giải:
Đáp án D
2KI + O3 + H2O → I2 + 2KOH + O2
KI không phản ứng với oxi ở điều kiện thường.
Câu 11: Hỗn hợp khí A gồm O2 và O3 có tỉ khối hơi so với H2 là 19,2. % về thể tích của O2 trong A là
A. 60%. B. 20%.
C. 40%. D. 80%.
Lời giải:
Đáp án A
dB/H2 = 19,2 → MB = 19,2. 2 = 38,4
Áp dụng quy tắc đường chéo
Giả sử nO3 = y = 2 mol thì nO2 = x = 3 mol → nB = 2 + 3 = 5 mol
Mà ở cùng điều kiện nhiệt độ và áp suất % về thể tích = % về số mol
Câu 12: Có hỗn hợp khí là oxi và ozon. Sau một thời gian, ozon bị phân hủy hết, ta được một chất khí duy nhất có thể tích tăng thêm 2%. Biết các thể tích khí đo được ở cùng điều kiện nhiệt độ, áp suất. Phần trăm thể tích của ozon trong hỗn hợp ban đầu là
A. 6%. B. 10%.
C. 96%. D. 4%.
Lời giải:
Đáp án D
Đặt x và y lần lượt là số mol O2 và O3 trong hỗn hợp trước phản ứng
PTHH:
Số mol hỗn hợp khí trước khi phản ứng là: (x + y) (mol)
Sau phản ứng số mol khí oxi là:
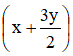
Số mol khí tăng so với ban đầu là:
Ta có 0,5y ứng với 2% nên y ứng với 4%. Vậy O3 chiếm 4%.
Câu 13: Để phân biệt oxi và ozon có thể dùng chất nào sau đây?
A. Cu.
B. Hồ tinh bột.
C. H2.
D. Dung dịch KI và hồ tinh bột.
Lời giải:
Đáp án D
2KI + O3 + H2O → I2 + 2KOH + O2,
I2 kết hợp với hồ tinh bột tạo hợp chất bọc màu xanh.
KI không phản ứng với oxi ở điều kiện thường.
Câu 14: Tiến hành phản ứng hết a gam ozon thì thu được 94,08 lít khí O2 (đktc). Xác định giá trị của a.
A. 2,8g. B. 134,4.
C. 13,44. D. 280.
Lời giải:
Đáp án B
Ta có: nO2 = 4,2(mol)
Phản ứng:
mozon = 2,8.16.3 = 134,4(gam)
Câu 15: Một chất dùng để làm sạch nước, dùng để chữa sâu răng và có tác dụng bảo vệ các sinh vật trên trái đất không bị bức xạ cực tím. Chất này là
A. Ozon. B. Clo.
C. Oxi. D. Flo.
Lời giải:
Đáp án A.
Trong y học, ozon dùng để chữa sâu răng. Trong đời sống, ozon dùng để sát trùng nước sinh hoạt. Tầng ozon có tác dụng bảo vệ các sinh vật trên trái đất không bị bức xạ cực tím.
Câu 16: Tỉ khối của hỗn hợp X gồm oxi và ozon so với hiđro là 18. Phần trăm thể tích của oxi và ozon có trong hỗn hợp X lần lượt là
A. 25% và 75%. B. 30% và 70%.
C. 50% và 50%. D.75% và 25%.
Lời giải:
Đáp án D
Coi số mol hỗn hợp X = 1 mol.
nO2 = x, nO3 = y (mol)
x + y = 1
32x + 48y = 1.18.2
⇒ x = 0,75, y = 0,25 (mol)
⇒ %VO2 = 75%, %VO3 = 25%
Câu 17: Trong các cách dưới đây, cách nào được dùng để điều chế oxi trong phòng thí nghiệm
A. Điện phân H2O.
B. Phân huỷ H2O2 với chất xúc tác là MnO2.
C. Điện phân CuSO4.
D. Chưng cất phân đoạn không khí lỏng.
Lời giải:
Đáp án B
Trong PTN người ta điều chế khí O2 bằng cách phân hủy các hợp chất giàu oxi, kém bền với nhiệt như KMnO4 rắn, KClO3 rắn, H2O2 …
Câu 18: Phương trình hóa học xảy ra khi cho bột MnO2 vào ống nghiệm đựng nước oxi già (H2O2) là
A. H2O2 + MnO2 → Mn(OH)2 + O2.
B. 2H2O2 → 2H2O + O2.
C. 2H2O2 + MnO2 → H2MnO2 + H2 + O2.
D. H2O2 → H2 + O2.
Lời giải:
Đáp án B
Câu 19: Tính chất nào sau đây không phải của H2O2 ?
A. Là hợp chất ít bền, dễ bị phân huỷ thành H2 và O2 khi có xúc tác MnO2.
B. Là chất lỏng không màu.
C. Tan trong nước theo bất kì tỉ lệ nào.
D. Số oxi hoá của nguyên tố oxi là -1.
Lời giải:
Đáp án A
Câu 20: Phương trình phản ứng chứng tỏ H2O2 có tính oxi hoá là
A. H2O2 + 2KI → I2 + 2KOH.
B. H2O2 + Ag2O → 2Ag + 2H2O + O2.
C. 5H2O2 + 2KMnO4 + 3H2SO4 → 2MnSO4 + 5O2 + K2SO4 + 8H2O.
D. Tất cả đều đúng.
Lời giải:
Đáp án A
H2O2 + 2KI → I2 + 2KOH
Số oxi hóa của O giảm từ -1 xuống -2 do đó H2O2 có tính oxi hoá.
Câu 21: Hidro peoxit tham gia các phản ứng hóa học:
H2O2 + 2KI → I2 + 2KOH (1);
H2O2 + Ag2O → 2Ag + H2O + O2 (2).
Nhận xét nào sau đây là đúng?
A. Hidro peoxit chỉ có tính oxi hóa.
B. Hidro peoxit chỉ có tính khử.
C. Hidro peoxit vừa có tính oxi hóa, vừa có tính khử.
D. Hidro peoxit không có tính oxi hóa, không có tính khử.
Lời giải:
Đáp án C
- H2O2 + 2KI → I2 + 2KOH
Số oxi hóa của O giảm từ -1 xuống -2 do đó H2O2 có tính oxi hoá.
- H2O2 + Ag2O → 2Ag + H2O + O2
Số oxi hóa của O tăng từ -1 lên 0 do đó H2O2 có tính khử.
Câu 22: Cho H2O2 vào dung dịch KMnO4 trong môi trường axit H2SO4, sản phẩm thu được là
A. MnSO4 + K2SO4 + H2O.
B. MnSO4 + O2↑ + K2SO4 + H2O.
C. MnSO4 + KOH.
D. K2SO4 + Mn(OH)3 + H2O.
Lời giải:
Đáp án C
5H2O2 + 2KMnO4 + 3H2SO4 → 5O2 + K2SO4 + 2MnSO4 + 8H2O
Câu 23: Để xác đinh hàm lượng hiđro peoxit trong 25g một loại thuốc làm nhạt màu tóc cần 80ml dd KMnO4 0,1M trong môi trường H2SO4. Hàm lượng của hiđropeoxit trong loại thuốc nói trên là
A. 2,72%. B. 7,2%.
C. 12,3%. D. 8,6%.
Lời giải:
Đáp án A.
5H2O2 (0,02) + 2KMnO4 (0,008 mol) + 3H2SO4 → 5O2 + K2SO4 + 2MnSO4 + 8H2O
Câu 24: Cho H2O2 vào dung dịch KMnO4 trong môi trường axit H2SO4. Tổng hệ số (tối giản) của các chất tham gia phản ứng là
A. 10. B. 7.
C. 26. D. 30.
Lời giải:
Đáp án A.
5H2O2 + 2KMnO4 + 3H2SO4 → 5O2 + K2SO4 + 2MnSO4 + 8H2O
Tổng hệ số (tối giản) của các chất tham gia phản ứng = 5 + 2 + 3 = 10.
Câu 25: Cho H2O2 vào dung dịch KMnO4 trong môi trường axit H2SO4. Tổng hệ số (tối giản) của các chất có trong phản ứng là
A. 10. B. 7.
C. 26. D. 30.
Lời giải:
Đáp án C
5H2O2 + 2KMnO4 + 3H2SO4 → 5O2 + K2SO4 + 2MnSO4 + 8H2O
Tổng hệ số (tối giản) của các chất có trong phản ứng = 5 + 2 + 3 + 5 + 2 + 8 = 26.
Xem thêm các dạng bài tập và công thức Hoá học lớp 10 hay, chi tiết khác:
50 bài tập về Axit Sunfuric (H2SO4) và muối Sunfat
50 bài tập về Hidro Sunfua (H2S)
Xem thêm các chương trình khác:
- Giải sgk Vật Lí 10 | Giải bài tập Vật lí 10 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 10
- Tóm tắt tác phẩm Ngữ văn 10
- Soạn văn 10 (hay nhất) | Để học tốt Ngữ Văn 10 (sách mới)
- Soạn văn 10 (ngắn nhất) | Để học tốt Ngữ văn 10 (sách mới)
- Văn mẫu lớp 10 (cả ba sách) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Lịch sử 10 | Giải bài tập Lịch sử 10 Học kì 1, Học kì 2 (sách mới)