Công thức tính tốc độ phản ứng (2025) chi tiết nhất
Với tài liệu về Công thức tính tốc độ phản ứng bao gồm: lý thuyết và bài tập cũng như những định nghĩa, tính chất, các dạng bài sẽ giúp bạn nắm vững kiến thức và học tốt môn Hóa học hơn.
Công thức tính tốc độ phản ứng
1.Công thức tính tốc độ phản ứng
Xét phản ứng: A → B
+Tốc độ phản ứng tính theo chất A trong khoảng thời gian từ t1 đến t2 được xác định như sau:
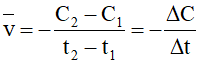
Trong đó:
Ở thời điểm t1, nồng độ chất A là C1 (mol/l);
Ở thời điểm t2, nồng độ chất A là C2 (mol/l)
+Nếu tốc độ được tính theo sản phẩm B thì
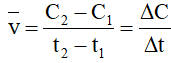
Trong đó:
Ở thời điểm t1, nồng độ chất B là (mol/l)
Ở thời điểm t2, nồng độ chất B là (mol/l).
2. Bạn nên biết
+ Tốc độ phản ứng dùng để đánh giá mức độ xảy ra nhanh hay chậm của các phản ứng hóa học.
+ Tốc độ phản ứng được xác định bằng thực nghiệm.
3. Mở rộng
-Biểu thức liên hệ giữa tốc độ phản ứng và hằng số tốc độ.
Xét phản ứng: xA+yB→ sản phẩm
Tốc độ phản ứng là: v= k.[A]x[B]y
Trong đó:
k: là hằng số tốc độ phản ứng
[A], [B] là nồng độ mol của chất A, B
x, y là hệ số phương trình của A, B
-Các yếu tố ảnh hưởng đến tốc độ phản ứng:
+ Khi tăng nồng độ chất phản ứng, tốc độ phản ứng tăng.
+ Đối với các sản phẩm có chất khí, khi tăng áp suất, tốc độ phản ứng tăng.
+ Khi tăng nhiệt độ, tốc độ phản ứng tăng. Thông thường khi nhiệt độ tăng lên 100C thì tốc độ phản ứng tăng từ 2 đến 4 lần.
+ Khi tăng diện tích tiếp xúc các chất phản ứng, tốc độ phản ứng tăng.
+ Chất xúc tác làm tăng tốc độ phản ứng, nhưng còn lại sau khi phản ứng.

4. Ví dụ minh họa
Câu 1: Cho phản ứng: 2X(khí) + Y(khí) → Z(khí) + T(khí)
Nếu áp suất của hệ tăng 3 lần thì tốc độ phản ứng tăng hay giảm bao nhiêu lần?
A. 3 lần
B. 6 lần
C. 9 lần
D. 27 lần
Hướng dẫn:
Vban đầu = k.[X] 2.[Y] = kx2y ( với x, y là nồng độ của X, Y)
Khi áp suất của hệ tăng 3 lần thì nồng độ các chất cũng tăng gấp 3 lần .
⇒ Vsau= k.[3X] 2.[3Y]= k(3x) 2 .(3y)=27kx2y
Vậy tốc độ phản ứng tăng lên 27 lần
Đáp án D
Câu 2: Khi bắt đầu phản ứng, nồng độ một chất là 0,024 mol/l. Sau 10 giây xảy ra phản ứng, nồng độ của chất đó là 0,022 mol/l. Tốc độ phản ứng trong trường hợp này là :
A. 0,0003 mol/l.s.
B. 0,00025 mol/l.s.
C. 0,00015 mol/l.s.
D. 0,0002 mol/l.s.
Hướng dẫn
Trong trường hợp này, tốc độ của phản ứng là:
(0,024 – 0,022) : 10 = 0,0002 mol/l.s
Đáp án D
Câu 3: Cho chất xúc tác MnO2 vào 100 ml dung dịch H2O2, sau 60 giây thu được 3,36 ml khí O2 (ở đktc). Tốc độ trung bình của phản ứng (tính theo H2O2) trong 60 giây trên là
A. 2,5.10-4 mol/(l.s)
B. 5,0.10-4 mol/(l.s)
C. 1,0.10-3 mol/(l.s)
D. 5,0.10-5 mol/(l.s)
Lời giải
2H2O  O2 + 2H2O
O2 + 2H2O
nO2 = 1,5.10-3 mol
Theo phương trình: = 3.10-3 mol
Tốc độ phản ứng là
v= = 5.10-4 mol/(l.s)
Đáp án B
Xem thêm các dạng bài tập và công thức Hoá học lớp 10 hay, chi tiết khác:
Các dạng bài toán tính nồng độ các chất ở trạng thái cân bằng
50 bài tập về tốc độ phản ứng và cân bằng hóa học
Xem thêm các chương trình khác:
- Giải sgk Vật Lí 10 | Giải bài tập Vật lí 10 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 10
- Tóm tắt tác phẩm Ngữ văn 10
- Soạn văn 10 (hay nhất) | Để học tốt Ngữ Văn 10 (sách mới)
- Soạn văn 10 (ngắn nhất) | Để học tốt Ngữ văn 10 (sách mới)
- Văn mẫu lớp 10 (cả ba sách) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Lịch sử 10 | Giải bài tập Lịch sử 10 Học kì 1, Học kì 2 (sách mới)
