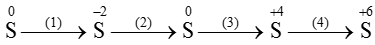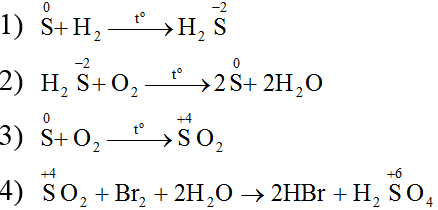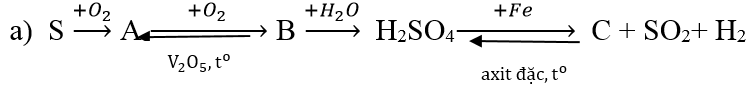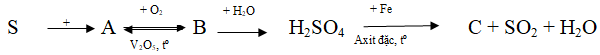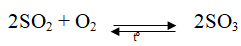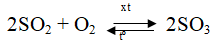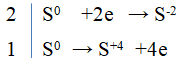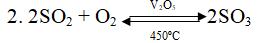Các dạng bài toán hoàn thành phản ứng hóa học Oxi, Lưu huỳnh | Lý thuyết, công thức, các dạng bài tập và cách giải
Với tài liệu về Các dạng bài toán hoàn thành phản ứng hóa học Oxi, Lưu huỳnh bao gồm: lý thuyết và bài tập cũng như những định nghĩa, tính chất, các dạng bài sẽ giúp bạn nắm vững kiến thức và học tốt môn Hóa học hơn.
Các dạng bài toán hoàn thành phản ứng hóa học Oxi, Lưu huỳnh
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
- Cần nắm chắc các tính chất hóa học về oxi, ozon, lưu huỳnh, các hợp chất của chúng để thấy được mối quan hệ giữa các chất
- Với những bài ẩn tên chất yêu cầu tìm chất phù hợp và viết phương trình cần lựa chọn các chât tương ứng với các trạng thái oxi hóa của lưu huỳnh trong sơ đồ. Quá trình làm tăng trạng thái oxi hóa các nguyên tố lưu huỳnh cầ lựa chọn cho tác dụng với chất có tính oxi hóa. Ngược lại quá trình làm giảm trạng thái oxi hóa của nguyên tố lưu huỳnh cần lựa chọn cho tác dụng với chất có tính khử.
Ví dụ minh họa
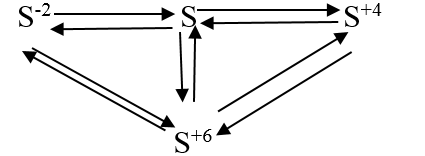
Ví dụ 1: Hãy viết các phương trình hóa học biểu diễn sự biến đổi số oxi hóa của các nguyên tố lưu huỳnh theo sơ đồ sau:
Lời giải:
Ví dụ 2: Viết các phương trình phản ứng theo chuỗi biến hóa sau:
KClO3 → O2 → O3 → O2 → ZnO → ZnSO4
FeS → H2S → S → SO2 → CaSO3 → CaSO4
Lời giải:
a) 2KClO3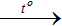
3O2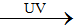
O3 + 2Ag → Ag2O + O2
O2 + 2Zn → 2ZnO
ZnO + H2SO4 → ZnSO4 + H2O
b) FeS + 2HCl → FeCl2 + H2S↑
2H2S + O2 thiếu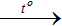
S + O2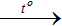
SO2 + CaO → CaSO3
CaSO3 + H2SO4 → CaSO4 + H2SO4 + SO2
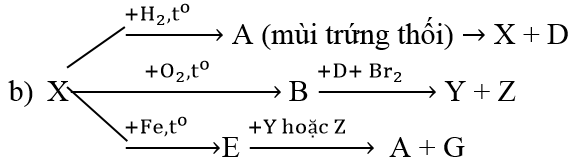
Ví dụ 3: Hoàn thành sơ đồ biến hóa sau:
Lời giải:
S + O2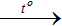
2SO2 + O2 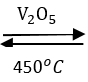
SO3 + H2O → H2SO4
6H2SO4 đặc + 2Fe 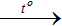
S + H2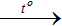
S + O2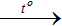
S + Fe 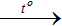
2H2S + SO2 → 3S + 2H2O
(X)⇒ S, (D) ⇒ H2O
SO2 + Br2 + 2H2O → 2HBr + H2SO4
(Y) ⇒ HBr, (Z) ⇒ H2SO4
FeS + 2HBr → FeBr2 + H2S↑
(G) ⇒ FeBr2 (A) ⇒ H2S
Hoặc FeS + H2SO4 → FeSO4+ H2S↑
(G)⇒ FeSO4 (A) ⇒ H2S
Ví dụ 4: Hoàn thành chuỗi các phản ứng sau, ghi rõ điều kiện nếu có:
ZnS → H2S → S → SO2 → SO3 → H2SO4 → HCl → Cl2 → KClO3 → O2
ZnS + 2HCl → ZnCl2 + H2S
2H2S + O2 thiếu → 2S + 2H2O
S + O2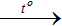
2SO2 + O2 
SO3+ H2O → H2SO4
H2SO4 đặc + NaCl tinh thể → NaHSO4 + HCl
4HCl + MnO2 → Cl2 + MnCl2 + 2H2O
3Cl2 + 6KHO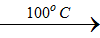
2KClO3 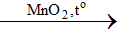
Ví dụ 5. Viết các phương trình hóa học biểu diễn sự biến đổi số oxi hóa của nguyên tố lưu huỳnh theo sơ đồ sau:
Lời giải:
+) S-2 → S0: 2H2S + O2 thiếu → 2S + 2H2O
+) S0 → S-2: H2 + S 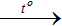
+) S0 → S+4: S + O2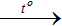
+) S+4 → S0: 2H2S + SO2 → 3S + 2H2O
+) S+4 → S+6: SO2+ Br2 + 2H2O → 2HBr + H2SO4
+) S+6 → S+4: Cu + 2H2SO4 đặc 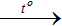
+) S0 → S+6: S + 3F2 → SF6
+) S+6 → S0: 3Zn + 4H2SO4 đặc 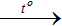
+) S-2 → S+6: H2S+ 4Cl2 + 4H2O → H2SO4 + 8HCl
+) S+6 → S2-: 4Mg + 5H2SO4 đặc 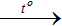
Nhận xét: với dạng bài này cần lựa chọn các chât tương ứng cho phù hợp với các trạng thái oxi hóa của lưu huỳnh trong sơ đồ. Quá trình làm tăng trạng thái oxi hóa các nguyên tố lưu huỳnh cầ lựa chọn cho tác dụng với chất có tính oxi hóa. Ngược lại quá trình làm giảm trạng thái oxi hóa của nguyên tố lưu huỳnh cần lựa chọn cho tác dụng với chất có tính khử.
B. Bài tập trắc nghiệm
Câu 1. Viết phương trình phản ứng theo chuỗi biến hóa sau:
FeS → H2S → S → SO2 → CaSO3 → CaSO4
Lời giải:
Đáp án:
FeS + 2HCl → FeCl2 + H2S
2H2S + O2thiếu ---V2O5→ 2S + 2H2O
SO2 + CaO → CaSO3
CaSO3 + H2SO4 → CaSO4 + SO2 + H2O
Câu 2. Xác định các chất và hoàn thành các phương trình phản ứng sau:
FeS + A → B (khí) + C
B + CuSO4 → D↓ đen + E
B + F → G↓ vàng + H
C + J khí → L
L + KI → C + M + N
Lời giải:
Đáp án:
FeS + 2HCl → FeCl2 + H2S↑
(A) (C) (B)
H2S + CuSO4 → CuS↓ + H2SO4
(D) (E)
2H2S + SO2 → 2S↓ + 2H2O
(F) (G) (H)
2FeCl2 + Cl2 → 2FeCl3
(J) (L)
2FeCl3 + 2KI → 2FeCl2 + 2KCl + I2
(M) (N)
Câu 3. Hoàn thành sơ đồ biến hóa sau:
Lời giải:
Đáp án:
S + O2 → SO2 (A)
SO3 + H2O → H2SO4
6H2SO4(đ) + 2Fe → Fe2(SO4)3 + 3SO2 + 6H2O
Câu 4. Viết phương trình phản ứng theo chuỗi biến hóa sau:
KMnO4 → Cl2 → NaClO3 → O2 → SO2 → SO3 → H2SO4
Lời giải:
Đáp án:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O
2NaClO3 → 2NaCl + 3O2
O2 + S → SO2
SO3 + H2O → H2SO4
Câu 5. Cặp phản ứng nào sau đây cho thấy lưu huỳnh vừa có tính khử vừa có tính oxi hóa?
A. S + H2 → H2S; S + Cu → CuS
B. S + 2H2SO4 → 3SO2 + 2H2O; S + 2Na → Na2S
C. S + 6HNO3 → H2SO4 + 6NO2 + 3H2O; S + O2 → SO2
D. S+ 3F2 → SF6 ; S + O2 → SO2
Lời giải:
Đáp án: B
Câu 6. Lưu huỳnh tác dụng với natri hidroxit đặc, nóng:
S + NaOH → Na2S + Na2SO3 + H2O
Trong phản ứng trên, tỷ lệ số nguyên tử lưu huỳnh bị khử và số nguyên tử lưu huỳnh bị oxi hóa là:
A. 1 : 2 B. 1 : 1 C. 1 : 2 D. 2 : 1
Lời giải:
Đáp án: D
Câu 6.
3S + 6NaOH → 2Na2S + Na2SO3 + 3H2O
Câu 7. Cho phương trình phản ứng hóa học:
H2SO4 đặc + 8HI → 4I2 + H2S + 4H2O
A. H2SO4 là chất oxi hóa, HI là chất khử
B. HI là chất oxi hóa
C. I2 oxi hóa H2S thành H2SO4 và nó bị khử thành HI
D. I2 khử H2S thành H2SO4 và nó bị khử thành HI.
Lời giải:
Đáp án: A
Câu 8. Cho các phương trình phản ứng hóa học sau:
1. SO2 + 2H2S → 3S + 2H2O
3. SO2 + Br2 + 2H2O → 2HBr + H2SO4
4. 5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4
5. SO2 + H2O → H2SO3
SO2 là chất oxi hóa trong các phản ứng:
A. 1, 3, 5 B. 1, 3, 4 C. 1 D. 1, 3
Lời giải:
Đáp án: C
Xem thêm các dạng bài tập và công thức Hoá học lớp 10 hay, chi tiết khác:
Các dạng bài toán về Oxi, Ozon
Các dạng bài toán SO2, H2S, SO3 phản ứng với dung dịch kiềm
Các dạng bài toán về H2S và muối sunfua
Xem thêm các chương trình khác:
- Giải sgk Vật Lí 10 | Giải bài tập Vật lí 10 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 10
- Tóm tắt tác phẩm Ngữ văn 10
- Soạn văn 10 (hay nhất) | Để học tốt Ngữ Văn 10 (sách mới)
- Soạn văn 10 (ngắn nhất) | Để học tốt Ngữ văn 10 (sách mới)
- Văn mẫu lớp 10 (cả ba sách) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Lịch sử 10 | Giải bài tập Lịch sử 10 Học kì 1, Học kì 2 (sách mới)