Trắc nghiệm Sự biến đổi tuần hoàn tính chất của các nguyên tố hóa học. Định luật tuần hoàn có đáp án – Hóa học lớp 10
Bộ 30 bài tập trắc nghiệm Hóa học lớp 10 Bài 9: Sự biến đổi tuần hoàn tính chất của các nguyên tố hóa học. Định luật tuần hoàn có đáp án đầy đủ các mức độ giúp các em ôn trắc nghiệm Hóa học 10.
Trắc nghiệm Hóa 10 Bài 9: Sự biến đổi tuần hoàn tính chất của các nguyên tố hóa học. Định luật tuần hoàn
Bài giảng Hóa 10 Bài 9: Sự biến đổi tuần hoàn tính chất của các nguyên tố hóa học. Định luật tuần hoàn
Câu 1: Chọn câu đúng:
A. Tính chất của các nguyên tố hóa học cùng nhóm bao giờ cũng giống nhau.
B. Tính chất của các nguyên tố chỉ phụ thuộc vào cấu trúc lớp vỏ electron mà không phụ thuộc vào lớp electron ngoài cùng.
C. Tính chất của các nguyên tố hóa học cùng nhóm A bao giờ cũng tương tự nhau
D. Tính chất hóa học của các nguyên tố trong một chu kì là tương tự nhau.
Đáp án: C
Giải thích:
Câu 2: Trong số các nguyên tố sau đây, nguyên tố nào có công thức oxit cao nhất ứng với công thức R2O3 ?
A. P15
B. Si14
C. Al13
D. Mg12
Đáp án: C
Giải thích:
Công thức oxit cao nhất ứng với công thức R2O3
→ R thuộc nhóm IIIA.
→ Nguyên tố cần tìm là Al13.
Câu 3: Nguyên tố X có cấu hình electron là 1s22s22p3. Vị trí của nguyên tố này trong bảng tuần hoàn và hợp chất khí với hiđro có công thức là?:
A. Chu kỳ 2, nhóm VA, HXO3.
B. Chu kỳ 3, nhóm VA, XH4.
C. Chu kỳ 2, nhóm VA, XH3.
D. Chu kỳ 3, nhóm VA, XH2.
Đáp án: C
Giải thích:
Nguyên tố X có cấu hình electron là 1s22s22p3
→ X thuộc chu kì 2, nhóm VA.
→ Hợp chất khí với hiđro có công thức là XH3.
Câu 4: Trong một chu kỳ, khi Z tăng thì
A. Hoá trị cao nhất với oxi tăng từ 1→8.
B. Hoá trị cao nhất với oxi tăng từ 1→7.
C. Hóa trị với hiđro tăng từ 1→7.
D. Hóa trị với hiđro giảm từ 7→1.
Đáp án: B
Giải thích:
Câu 5: Điều khẳng định nào sau đây là sai?
Trong một nhóm A của bảng tuần hoàn, theo chiều tăng của các điện tích hạt nhân các nguyên tử,
A. tính phi kim giảm dần.
B. tính bazơ của các hiđroxit tăng dần.
C. tính kim loại tăng dần.
D. độ âm điện tăng dần.
Đáp án: D
Giải thích:
Câu 6: Nguyên tố M thuộc chu kỳ 3, nhóm VIIA của bảng tuần hoàn. Công thức oxit ứng với hóa trị cao nhất và công thức hợp chất với hiđro của nguyên tố M là:
A. M2O3 và MH3
B. M2O5 và MH
C. M2O7 và MH
D. MO3 và MH2
Đáp án: C
Giải thích:
Câu 7: Độ âm điện của dãy nguyên tố: F, Cl, Br, I biến đổi như thế nào?:
A. vừa giảm vừa tăng.
B. giảm.
C. không thay đổi.
D. tăng.
Đáp án: B
Giải thích:
Dãy các nguyên tố: F, Cl, Br, I nằm ở nhóm VIIA, theo chiều tăng dần điện tích hạt nhân
→ Độ âm điện giảm dần.
Câu 8: Oxit cao nhất của 1 nguyên tố R ứng với công thức RO2. Trong hợp chất của nguyên tố đó với H có 25 % H về khối lượng. Nguyên tố R là: (Cho nguyên tử khối của các chất như sau:
Mg = 24, C = 12, N = 7, P = 31)
A. Mg.
B. N.
C. P.
D. C.
Đáp án: D
Giải thích:
Oxit cao nhất của 1 nguyên tố R ứng với công thức RO2
→ Hợp chất với H có công thức là RH4.
⇒4MR+4=0,25⇒MR=12
→ R là nguyên tố C.
Câu 9: Hợp chất khí với hiđro của một nguyên tử là RH2. Nguyên tử R là:
A. Clo.
B. Lưu huỳnh.
C. Silic.
D. Nitơ.
Đáp án: B
Giải thích:
Hợp chất khí với hiđro của 1 nguyên tử là RH2
→ R thuộc nhóm VIA
→ R là lưu huỳnh.
Câu 10: Hợp chất khí với hiđro của 1 nguyên tử là RH4 và oxit cao nhất của nó chứa 53,33 % oxi về khối lượng. Nguyên tố R là:
A. Cacbon.
B. Bo.
C. Silic.
D. Lưu huỳnh.
Đáp án: C
Giải thích:
Hợp chất khí với hiđro của 1 nguyên tử là RH4
→ Công thức oxit cao nhất của nó là RO2.
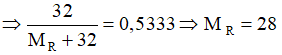
→ Nguyên tố R là silic.
Câu 11: Bán kính của các nguyên tố của các nguyên tử halogen được sắp xếp theo thứ tự giảm dần từ trái qua phải là :
A. Br, I, Cl, F.
B. F, Cl, Br, I.
C. I, Br, F, Cl.
D. I, Br, Cl, F.
Đáp án: D
Giải thích:
Trong 1 nhóm theo chiều tăng dần điện tích hạt nhân thì bán kính nguyên tử tăng dần.
→ Thứ tự bán kính giảm dần: I, Br, Cl, F.
Câu 12: Chọn câu trả lời đúng trong các câu sau: Trong một chu kì, theo chiều tăng của điện tích hạt nhân nguyên tử:
A. Tính kim loại và tính phi kim tăng.
B. Tính kim loại và tính phi kim giảm.
C. Tính kim loại giảm, tính phi kim tăng.
D. Tính kim loại tăng, tính phi kim giảm.
Đáp án: C
Giải thích:
Câu 13: Chọn phát biểu đúng: Trong một nhóm A, đi từ trên xuống thì:
A. Tính bazơ của các oxit và hiđroxit tương ứng yếu dần, tính axit mạnh dần.
B. Tính bazơ của các oxi và hiđroxit tương ứng mạnh dần, tính axit giảm dần.
C. Tính bazơ tăng dần, đồng thời tính axit giảm dần.
D. Tính bazơ của các oxit và hiđroxit tương ứng mạnh dần, đồng thời tính axit mạnh dần.
Đáp án: B
Giải thích:
Câu 14: Oxit cao nhất của nguyên tố R là R2O5, trong hợp chất với hiđro R chiếm 82,35% về khối lượng. Nguyên tố R là:
A. N.
B. As.
C. P.
D. S.
Đáp án: A
Giải thích:
Oxit cao nhất của nguyên tố R là R2O5
→ Hợp chất với hiđro có công thức là RH3.
⇒MRMR+3=0,8235⇒MR=14
→ R là nguyên tố N.
Câu 15: Trong những câu dưới đây, câu nào sai?
A. Trong một chu kì, theo chiều tăng dần của diện tích hạt nhân: tính kim loại của các nguyên tố giảm, tính phi kim tăng.
B. Trong một nhóm, theo chiều tăng của điện tích hạt nhân, tính kim loại của các nguyên tố tăng, tính phi kim giảm.
C. Trong một chu kì, theo chiều tăng của điện tích hạt nhân, bán kính nguyên tử giảm dần.
D. Trong một nhóm, theo chiều tăng của điện tích hạt nhân, bán kính nguyên tử giảm dần.
Đáp án: D
Giải thích:
Câu 16: Cho dãy các nguyên tử nào sau đây được xếp theo chiều bán kính nguyên tử tăng dần?
A. I, Br, Cl, P
B. O, S, Se, Te
C. Na, Mg, Al, Si
D. C, N, O, F
Đáp án: B
Giải thích:
- Trong 1 chu kì, theo chiều tăng của điện tích hạt nhân, bán kính nguyên tử giảm dần.
- Trong 1 nhóm, theo chiều tăng của điện tích hạt nhân, bán kính nguyên tử tăng dần.
Nhận thấy: O, S, Se, Te là các nguyên tố nhóm VIA, từ trên xuống → bán kính tăng dần.
Câu 17: Dãy nguyên tố nào sau đây được sắp xếp theo chiều tăng dần độ âm điện?
A. Li, Na, C, O, F
B. Na, Li, F, C, O
C. Li, Na, F, C, O
D. Na, Li, C, O, F
Đáp án: D
Giải thích:
- Li (chu kì 2) và Na (chu kì 3) cùng thuộc nhóm IA
→ độ âm điện của Li lớn hơn Na.
- Li, C, O, F thuộc chu kì 2, xếp theo thứ tự điện tích hạt nhân tăng dần
→ độ âm điện tăng dần.
→ Sắp xếp theo chiều tăng dần độ âm điện: Na, Li, C, O, F.
Câu 18: Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân
A. bán kính nguyên tử giảm dần, tính kim loại tăng dần.
B. bán kính nguyên tử giảm dần, tính phi kim tăng dần.
C. bán kính nguyên tử tăng dần, tính phi kim tăng dần.
D. bán kính nguyên tử tăng dần, tính phi kim giảm dần.
Đáp án: B
Giải thích:
Câu 19: Cho các nguyên tố X, Y, Z với số hiệu nguyên tử lần lượt là 4, 12, 20. Phát biểu nào sau đây là sai?
A. Thứ tự tăng dần độ âm điện:Z < Y < X.
B. Các nguyên tố này không cùng thuộc một chu kì.
C. Thứ tự giảm dần tính bazơ là Z(OH)2 > Y(OH)2 > X(OH)2.
D. Các nguyên tố này đều là kim loại mạnh nhất trong chu kì.
Đáp án: A
Giải thích:
Các nguyên tố X, Y, Z với số hiệu nguyên tử lần lượt là 4, 12, 20
→ X, Y, Z thuộc nhóm IIA trong bảng tuần hoàn.
→ D sai vì kim loại mạnh nhất trong chu kì là kim loại nhóm IA.
Câu 20: Cho các phát biểu sau:
(1) F là phi kim mạnh nhất.
(2) Be là kim loại yếu nhất trong nhóm IIA.
(3) He là nguyên tử có bán kính nhỏ nhất.
(4) Li là kim loại có độ âm điện lớn nhất.
(5) Trong một nhóm A, từ trên xuống dưới, bán kính giảm dần.
Trong các phát biểu trên, số phát biểu đúng là
A. 1
B. 2
C. 3
D. 4
Đáp án: B
Giải thích:
(1) đúng.
(2) đúng.
(3) sai vì H là nguyên tử có bán kính nhỏ nhất.
(4) sai nhiều kim loại khác có độ âm điện lớn hơn Li.
(5) sai trong một nhóm A, từ trên xuống dưới, bán kính tăng dần.
Câu 21: Hợp chất khí của nguyên tố R với hiđro có công thức hóa học RH4. Trong oxit mà R có hóa trị cao nhất, R chiếm 46,67% về khối lượng. Nguyên tố R thuộc chu kì
A. 2
B. 3
C. 4
D. 5
Đáp án: B
Giải thích:
Hợp chất khí của nguyên tố R với hiđro có công thức hóa học RH4
→ Công thức oxit cao nhất của R là RO2.
⇒MRMR+32=0,4667
⇒MR=28 (Si)
→ R thuộc chu kì 3, nhóm IVA.
Câu 22: Hai nguyên tố X và Y cùng thuộc nhóm A, trong cùng một chu kì của bảng tuần hoàn. Biết Y có nhiều hơn X là 5 electron p, số electron s của X và Y bằng nhau. Phát biểu nào sau đây đúng?
A. X có thể là kim loại kiềm.
B. X không thể là nguyên tố p.
C. Y có thể thuộc nhóm VA.
D. Giữa vị trí của X và Y trong bảng tuần hoàn luôn có 4 nguyên tố.
Đáp án: D
Giải thích:
Theo bài, ta có: cấu hình electron lớp ngoài cùng của X và Y lần lượt là: ns2npx, ns2npy.
→ y – x = 5
→ y = 6, x = 1.
→ X kim loại nhóm IIIA,
Y là khí hiếm.
→ Khoảng cách giữa hai nguyên tố là 4 nguyên tố.
Câu 23: Biến thiên tính chất bazơ của các hiđroxit nhóm IA theo chiều tăng của điện tích hạt nhân là
A. giảm.
B. tăng.
C. không thay đổi.
D. giảm sau đó tăng.
Đáp án: B
Giải thích:
Câu 24: Tính chất bazơ của hiđroxit: NaOH, Mg(OH)2, Al(OH)3 biến đổi theo chiều nào sau đây?
A. Tăng.
B. Giảm sau đó tăng.
C. Không thay đổi.
D. Giảm.
Đáp án: D
Giải thích:
Các hiđroxit NaOH, Mg(OH)2, Al(OH)3 lần lượt của các kim loại chu kì 2, có điện tích hạt nhân tăng dần.
→ Tính bazơ của hiđroxit giảm dần.
Câu 25: Một oxit X của một nguyên tố ở nhóm VIA trong bảng tuần hoàn có tỉ khối so với khí oxi là 2. Công thức hóa học của X là
A. SO2
B. SeO3
C. SO3
D. TeO2
Đáp án: A
Giải thích:
Gọi công thức của oxit là ROb.
⇒MR+16.b=32.2⇒{MR=32 (S)b=2
→ Công thức của oxit là SO2.
Câu 26: Khi sắp xếp các nguyên tố hóa học theo chiều tăng dần của điện tích hạt nhân, tính chất nào sau đây không biến đổi tuần hoàn?
A. Năng lượng ion hóa.
B. Độ âm điện.
C. Số electron lớp ngoài cùng.
D. Số khối.
Đáp án: D
Giải thích:
Câu 27: Cho dãy các nguyên tố hóa học nhóm VA: N – P – As – Sb – Bi. Từ N đến Bi, theo chiều điện tích hạt nhân tăng, tính phi kim thay đổi theo chiều:
A. giảm dần
B. tăng dần
C. tăng rồi giảm
D. giảm rồi tăng
Đáp án: A
Giải thích:
Câu 28: Nguyên tử của nguyên tố có bán kính nguyên tử lớn nhất trong nhóm VA?
A. Nito (Z = 7)
B. Photpho (Z = 15)
C. Asen (Z = 33)
D. Bitmut (Z = 83)
Đáp án: D
Giải thích:
Câu 29: Đại lượng đặc trưng cho khả năng hút electron của nguyên tử các nguyên tố khi hình thành liên kết hoá học là :
A. Độ âm điện.
B. Tính phi kim.
C. Điện tích hạt nhân.
D. Tính kim loại.
Đáp án: A
Giải thích:
Câu 30: Độ âm điện của các nguyên tố: Na, Mg, Al, Si. Xếp theo chiều tăng dần là:
A. Si < Mg < Al < Na
B. Si < Al < Mg < Na
C. Na < Mg < Al < Si
D. Al < Na < Si < Mg
Đáp án: C
Giải thích:
Các nguyên tố: Na, Mg, Al, Si cùng thuộc chu kì và được sắp xếp theo chiều tăng dần của điện tích hạt nhân.
→ Độ âm điện tăng dần: Na < Mg < Al < Si.
Các câu hỏi trắc nghiệm Hóa lớp 10 có đáp án, chọn lọc khác:
Trắc nghiệm Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học có đáp án
Trắc nghiệm Liên kết ion - Tinh thể ion có đáp án
Trắc nghiệm Liên kết cộng hóa trị có đáp án
Trắc nghiệm Tinh thể nguyên tử và tinh thể phân tử có đáp án
Xem thêm các chương trình khác:
- Trắc nghiệm Sinh học lớp 7 có đáp án
- Trắc nghiệm Toán lớp 7 có đáp án
- Trắc nghiệm Ngữ văn lớp 7 có đáp án
- Trắc nghiệm Sinh học 8 có đáp án
- Trắc nghiệm Toán lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn 8 có đáp án
- Trắc nghiệm Hóa học lớp 8 có đáp án
- Trắc nghiệm Địa Lí lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Tiếng Anh lớp 8 có đáp án
- Trắc nghiệm GDCD lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Lịch sử lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Vật Lí lớp 8 có đáp án
- Trắc nghiệm Công nghệ lớp 8 có đáp án
- Trắc nghiệm Tin học lớp 8 có đáp án
- Trắc nghiệm Sinh học lớp 9 có đáp án
- Trắc nghiệm Toán lớp 9 có đáp án
- Trắc nghiệm Ngữ văn 9 có đáp án
- Trắc nghiệm Hóa học lớp 9 có đáp án
- Trắc nghiệm Địa lí lớp 9 có đáp án
- Trắc nghiệm Tiếng Anh lớp 9 có đáp án
- Trắc nghiệm GDCD lớp 9 có đáp án
- Trắc nghiệm Lịch sử lớp 9 có đáp án
- Trắc nghiệm Vật lí lớp 9 có đáp án
- Trắc nghiệm Công nghệ lớp 9 có đáp án
- Trắc nghiệm Sinh học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Toán lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Hóa học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn lớp 11 có đáp án
- Trắc nghiệm Tiếng Anh lớp 11 có đáp án
- Trắc nghiệm Vật Lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Địa lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm GDCD lớp 11 có đáp án
- Trắc nghiệm Lịch sử lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Công nghệ lớp 11 có đáp án
- Trắc nghiệm Giáo dục quốc phòng - an ninh lớp 11 có đáp án
- Trắc nghiệm Tin học lớp 11 có đáp án
- Trắc nghiệm Toán lớp 12 có đáp án
- Trắc nghiệm Sinh học lớp 12 có đáp án
- Trắc nghiệm Hóa học lớp 12 có đáp án
- Trắc nghiệm Ngữ văn lớp 12 có đáp án
- Trắc nghiệm Tiếng Anh lớp 12 có đáp án
- Trắc nghiệm Địa lí lớp 12 có đáp án
- Trắc nghiệm Vật Lí lớp 12 có đáp án
- Trắc nghiệm Công nghệ lớp 12 có đáp án
- Trắc nghiệm Giáo dục công dân lớp 12 có đáp án
- Trắc nghiệm Lịch sử lớp 12 có đáp án
- Trắc nghiệm Giáo dục quốc phòng - an ninh lớp 12 có đáp án
