Trắc nghiệm Phản ứng oxi hóa khử có đáp án – Hóa học lớp 10
Bộ 30 bài tập trắc nghiệm Hóa học lớp 10 Bài 17: Phản ứng oxi hóa khử có đáp án đầy đủ các mức độ giúp các em ôn trắc nghiệm Hóa học 10.
Trắc nghiệm Hóa 10 Bài 17: Phản ứng oxi hóa khử
Bài giảng Hóa 10 Bài 17: Phản ứng oxi hóa khử
Câu 1: Chất khử là chất
A. nhận electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
B. cho electron, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
C. cho electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
D. nhận electron, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
Đáp án: C
Giải thích:
Câu 2: Chất nào sau đây tác dụng với dung dịch HNO3 loãng, dư sinh ra khí NO?
A. Fe2O3.
B. FeO.
C. Fe(OH)3.
D. Fe2(SO4)3.
Đáp án: B
Giải thích:
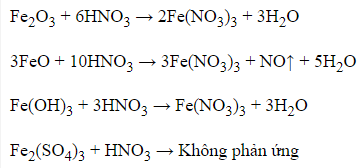
Câu 3: Chất oxi hoá là chất nhận electron, chứa nguyên tố có số oxi hóa
A. tăng sau phản ứng.
B. giảm sau phản ứng.
C. không thay đổi sau phản ứng.
D. vừa tăng vừa giảm sau phản ứng.
Đáp án: B
Giải thích:
Câu 4: Chọn phát biểu không hoàn toàn đúng?
A. Sự oxi hóa là quá trình chất khử cho electron.
B. Trong các hợp chất, số oxi hóa của H luôn là +1 và số oxi hóa của O luôn là -2.
C. Nitơ có nhiều mức oxi hóa (âm hoặc dương) khác nhau.
D. Chất oxi hóa gặp chất khử chưa chắc đã xảy ra phản ứng.
Đáp án: B
Giải thích:
Câu 5: Hòa tan hoàn toàn 3,9 gam hỗn hợp Al và Mg trong dung dịch HCl dư, thu được 4,48 lít (ở đktc) khí H2 và dung dịch chứa m gam muối. Giá trị của m là
A. 11,6.
B. 17,7.
C. 18,1.
D. 18,5.
Đáp án: C
Giải thích:
nH2=0,2 mol→nHCl pu=0,4 mol
→nCl− (muối) = 0,4 mol
→ mmuối = mkim loại + mCl- muối = 18,1 gam
Câu 6: Chất đóng vai trò là chất oxi hóa trong phản ứng sau:
Fe + 2HCl → FeCl2 + H2
A. Fe
B. HCl
C. FeCl2
D. H2
Đáp án: B
Giải thích:
0Fe+2+1HCl →+2FeCl2+0H2
→ Fe là chất khử, HCl là chất oxi hóa.
Câu 7: Trong phân tử NH4NO3 thì số oxi hóa của 2 nguyên tử nitơ lần lượt là :
A. –3 và +6.
B. –4 và +6.
C. +1 và +1.
D. –3 và +5.
Đáp án: D
Giải thích:
Câu 8: Cho quá trình: 2H++NO3−+e→NO2+H2O . Đây là quá trình:
A. tự oxi hóa – khử.
B. nhận proton.
C. khử.
D. oxi hóa.
Đáp án: C
Giải thích:
Câu 9: Khi cho Cu2S tác dụng với HNO3 thu được hỗn hợp sản phẩm gồm: Cu(NO3)2; H2SO4; NO và H2O. Số electron mà 1 phân tử Cu2S đã nhường là:
A. 6 electron.
B. 9 electron.
C. 10 electron.
D. 2 electron.
Đáp án: C
Giải thích:
Quá trình nhường electron:
0⏞Cu2S→2Cu2++S+6+10e
→ 1 phân tử Cu2S đã nhường 10 electron.
Câu 10: Phát biểu nào dưới đây không đúng ?
A. Phản ứng oxi hoá – khử là phản ứng trong đó xảy ra sự trao đổi electron giữa các chất.
B. Phản ứng oxi hoá – khử là phản ứng trong đó có sự thay đổi số oxi hoá của một hay một số nguyên tố hóa học.
C. Phản ứng oxi hoá – khử là phản ứng luôn xảy ra đồng thời sự oxi hoá và sự khử.
D. Phản ứng oxi hoá – khử là phản ứng trong đó có sự thay đổi số oxi hoá của tất cả các nguyên tố hóa học.
Đáp án: D
Giải thích:
Câu 11: Phản ứng nào sau đây SO2 thể hiện tính khử?
A. SO2 + H2O → H2SO3
B. SO2 + 2NaOH → Na2SO3 + H2O
C. SO2 + Br2 + H2O → 2HBr + H2SO4
D. SO2 + 2H2S → 3S + 2H2O
Đáp án: C
Giải thích:
Trong phản ứng:
SO2 + Br2 + H2O → 2HBr + H2SO4
Số oxi hóa của S tăng từ +4 lên +6. Vậy SO2 thể hiện tính khử.
Câu 12: Cho các hợp chất: NO,NH+4, NO2, N2O,NO−3, N2.
Thứ tự giảm dần số oxi hóa của N là:
A. N2 > NO−3 > NO2 > N2O > NH+4
B. NO−3 > N2O > NO2 > N2 > NH+4
C. NO−3 > NO2 > N2O > N2 > NH+4
D. NO−3 > NO2 > NH+4 > N2 > N2O.
Đáp án: C
Giải thích:
Câu 13: Cho quá trình: Cu→ Cu2++2e. Đây là quá trình:
A. nhận proton.
B. khử.
C. oxi hóa.
D. tự oxi hóa – khử.
Đáp án: C
Giải thích:
Câu 14: Cho phản ứng: Fe + HNO3 → Fe(NO3)3 + NO + H2O. Hệ số của Fe và HNO3 lần lượt là:
A. 4 và 1.
B. 1 và 4.
C. 1 và 6.
D. 6 và 1.
Đáp án: B
Giải thích:
Câu 15: Số mol electron dùng để khử 1,0 mol thành Fe là :
A. 0,5.
B. 1,5.
C. 3,0.
D. 4,5.
Đáp án: C
Giải thích:
Fe3++3e→Fe1 → 3 mol
→Fe3+ cần nhận 3 mol electron.
Câu 16: Khi Fe3O4 thể hiện tính khử thì mỗi phân tử Fe3O4 sẽ
A. nhận 1 electron.
B. nhường 8 electron.
C. nhận 8 electron.
D. nhường 1 electron.
Đáp án: D
Giải thích:
Fe3O4→3Fe3++4O2−+1e
→ Khi Fe3O4 thể hiện tính khử thì mỗi phân tử Fe3O4 sẽ nhường 1 electron.
Câu 17: Cho 7,8 gam hỗn hợp X gồm Mg và Al tác dụng vừa đủ với 5,6 lít hỗn hợp khí Y (đktc) gồm Cl2 và O2 thu được 19,7 gam hỗn hợp Z gồm 4 chất. Phần trăm khối lượng của Al trong X là:
A. 34,62%.
B. 65,38%.
C. 30,77%.
D. 69,23%.
Đáp án: D
Giải thích:
Gọi số mol Cl2 và O2 trong hỗn hợp Y lần lượt là x và y mol.
Gọi số mol Mg và Al trong hỗn hợp X lần lượt là a và b mol.
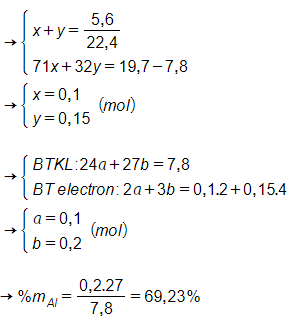
Câu 18: Cho m gam Cu phản ứng hết với dung dịch HNO3 thu được 8,96 lít (đktc) hỗn hợp khí NO và NO2 có tỉ khối đối với H2 là 19. Giá trị của m là:
A. 2,56 gam.
B. 16 gam.
C. 25,6 gam.
D. 8 gam.
Đáp án: C
Giải thích:
Ta có: nhỗn hợp khí = 0,4 mol
Áp dụng phương pháp đường chéo
nNOnNO2=46−19.219.2−30=11→nNO=nNO2=0,2 mol
Áp dụng định luật bảo toàn electron ta có:
2nCu=3nNO+nNO2→nCu=3.0,2+0,22=0,4 mol→mCu=0,4.64=25,6 gam
Câu 19: Khi tham gia vào các phản ứng hoá học, nguyên tử kim loại sẽ:
A. nhận proton.
B. cho proton.
C. bị oxi hoá.
D. bị khử.
Đáp án: C
Giải thích:
Khi tham gia vào các phản ứng hoá học, nguyên tử kim loại sẽ đóng vai trò là chất khử
→ Các nguyên tử kim loại sẽ bị oxi hóa.
Câu 20: Cho phản ứng: 4HNO3 đặc, nóng + Cu → Cu(NO3)2 + 2NO2↑ + 2H2O.
Trong phản ứng trên, HNO3 đóng vai trò là:
A. axit.
B. chất oxi hóa.
C. môi trường.
D. chất oxi hóa và môi trường.
Đáp án: D
Giải thích:
Nhận thấy số oxi hóa của N giảm từ +5 xuống +4
→ HNO3 là chất oxi hóa.
Trong 4 phân tử HNO3 phản ứng thì 2 phân tử đóng vai trò chất oxi hóa còn 2 phân tử đóng vai trò làm môi trường.
Câu 21: Cho sơ đồ phản ứng:
KMnO4 + FeSO4 + H2SO4 → Fe2(SO4)3 + K2SO4 + MnSO4 + H2O
Hệ số của chất khử và chất oxi hóa trong phản ứng trên lần lượt là:
A. 2 và 5.
B. 2 và 10.
C. 2 và 1.
D. 10 và 2.
Đáp án: D
Giải thích:
2x5x|+7Mn+5e→+2Mn+22Fe→+32Fe+2e
→ Phương trình:
2KMnO4 + 10FeSO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Nhận thấy:
- Số oxi hóa của Mn giảm từ +7 xuống +2
→ KMnO4 là chất oxi hóa.
- Số oxi hóa của Fe tăng từ +2 xuống +3
→ FeSO4 là chất khử.
→ Hệ số của chất khử và chất oxi hóa trong phản ứng trên lần lượt là 10 và 2.
Câu 22: Trong phản ứng:
Cu + HNO3 → Cu(NO3)2 + NO2↑ + H2O
Tổng các hệ số của phản ứng là:
A. 8.
B. 9.
C. 10.
D. 11.
Đáp án: D
Giải thích:
1x2x|0Cu→+2Cu+2e+5N+e→+4N
→ Phương trình:
Cu + 4HNO3 → Cu(NO3)2 + 2NO2↑ + 2H2O
→ Tổng hệ số là 10.
Câu 23: Trong các chất: FeCl2, FeCl3, Fe(NO3)3, Fe(NO3)2, FeSO4, Fe2(SO4)3. Số chất có cả tính oxi hoá và tính khử là
A. 2.
B. 3.
C. 4.
D. 5.
Đáp án: C
Giải thích:
Nhận thấy, bài cho các muối của sắt. Chất có cả tính oxi hóa và tính khử là chất mà sắt có mức oxi hóa +2 (mức oxi hóa trung gian giữa 0 và +3) hoặc hợp chất mà Fe có số oxi hóa +3 đóng vai trò là chất oxi hóa và 1 nguyên tố có tính khử.
→ Các chất thỏa mãn là: FeCl2, FeCl3, Fe(NO3)2 và FeSO4.
Câu 24: Hòa tan m gam Fe trong HNO3 dư thấy sinh ra hỗn hợp khí chứa 0,06 mol NO2 và 0,01 mol NO. Giá trị của m là
A. 0,56
B. 1,68
C. 2,24
D. 1,12
Đáp án: B
Giải thích:
Bảo toàn electron:
3nFe=1.nNO2+3nNO→nFe=1.0,06+3.0,013=0,03 mol
→ mFe = 0,03.56 = 1,68 gam.
Câu 25: Phản ứng nào dưới đây không xảy ra ?
A. KMnO4 + HCl →
B. Cu + HCl + NaNO3 →
C. Cu + HCl →
D. Fe(NO3)2 + AgNO3 →
Đáp án: C
Giải thích:
2KMnO4 + 16HCl → 5Cl2↑ + 2KCl + 2MnCl2 + 8H2O
3Cu + 8HCl + 2NaNO3 → 3CuCl2 + 2NO↑ + 2NaCl + 4H2O
Cu + HCl → Không phản ứng.
Fe(NO3)2 + AgNO3 → Ag↓ + Fe(NO3)3
Câu 26: Sản phẩm của phản ứng Fe + NaNO3 + HCl là :
A. NaCl, Fe(NO3)2,NO, H2O.
B. NaCl, Fe(NO3)2, NO2, H2O.
C. NaCl, Fe(NO3)3, NO, H2O.
D. NaCl, Fe(NO3)3, NO2, H2O.
Đáp án: C
Giải thích:
Câu 27: Cho phản ứng: Fe + CuCl2 → FeCl2 + Cu↓. Chất nào đóng vai trò là chất khử và đã nhường hay nhận bao nhiêu electron?
A. CuCl2 và nhận 2 electron.
B. Fe và nhận 2 electron.
C. Fe và nhường 2 electron.
D. Fe và nhận 3 electron.
Đáp án: C
Giải thích:
0Fe→+2Fe +2e
→ Fe là chất khử và nhường 2 electron.
Câu 28: Cho phản ứng:
2Fe3O4 + 10H2SO4 → 3Fe2(SO4)3 + SO2 + 10H2O
Số oxi hóa của Fe trước và sau phản ứng là :
A. +2 và +3.
B. +2 và +2.
C. +83 và +3.
D. +83 và 2.
Đáp án: C
Giải thích:
Câu 29: Trong phản ứng:
KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
Số phân tử HCl đóng vai trò chất khử là:
A. 11.
B. 10.
C. 9.
D. 8.
Đáp án: B
Giải thích:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
→ HCl vừa là chất khử vừa là môi trường tạo muối.
→ Số phân tử HCl đóng vai trò là chất khử, bị oxi hóa thành Cl2 là 10.
Câu 30: Hòa tan 0,9 gam một kim loại M (hóa trị không đổi) vào dung dịch HNO3 dư, thu được 0,28 lít (đktc) khí N2O duy nhất. Kim loại M là
A. Ag
B. Al
C. Zn
D. Mg
Đáp án: B
Giải thích:
Quá trình nhường electron: M→Mn++ne
Quá trình nhận electron:
10H++2NO−3+8e→N2O+5H2O
→MM=0,90,1n=9n
→{n=3MM=27→ M là nhôm.
Các câu hỏi trắc nghiệm Hóa lớp 10 có đáp án, chọn lọc khác:
Trắc nghiệm Phân loại phản ứng trong hóa học vô cơ có đáp án
Trắc nghiệm Luyện tập: Phản ứng oxi hóa - khử có đáp án
Trắc nghiệm Thành phần nguyên tử có đáp án
Trắc nghiệm Hạt nhân nguyên tử - Nguyên tố hóa học - Đồng vị có đáp án
Xem thêm các chương trình khác:
- Trắc nghiệm Sinh học lớp 7 có đáp án
- Trắc nghiệm Toán lớp 7 có đáp án
- Trắc nghiệm Ngữ văn lớp 7 có đáp án
- Trắc nghiệm Sinh học 8 có đáp án
- Trắc nghiệm Toán lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn 8 có đáp án
- Trắc nghiệm Hóa học lớp 8 có đáp án
- Trắc nghiệm Địa Lí lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Tiếng Anh lớp 8 có đáp án
- Trắc nghiệm GDCD lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Lịch sử lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Vật Lí lớp 8 có đáp án
- Trắc nghiệm Công nghệ lớp 8 có đáp án
- Trắc nghiệm Tin học lớp 8 có đáp án
- Trắc nghiệm Sinh học lớp 9 có đáp án
- Trắc nghiệm Toán lớp 9 có đáp án
- Trắc nghiệm Ngữ văn 9 có đáp án
- Trắc nghiệm Hóa học lớp 9 có đáp án
- Trắc nghiệm Địa lí lớp 9 có đáp án
- Trắc nghiệm Tiếng Anh lớp 9 có đáp án
- Trắc nghiệm GDCD lớp 9 có đáp án
- Trắc nghiệm Lịch sử lớp 9 có đáp án
- Trắc nghiệm Vật lí lớp 9 có đáp án
- Trắc nghiệm Công nghệ lớp 9 có đáp án
- Trắc nghiệm Sinh học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Toán lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Hóa học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn lớp 11 có đáp án
- Trắc nghiệm Tiếng Anh lớp 11 có đáp án
- Trắc nghiệm Vật Lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Địa lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm GDCD lớp 11 có đáp án
- Trắc nghiệm Lịch sử lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Công nghệ lớp 11 có đáp án
- Trắc nghiệm Giáo dục quốc phòng - an ninh lớp 11 có đáp án
- Trắc nghiệm Tin học lớp 11 có đáp án
- Trắc nghiệm Toán lớp 12 có đáp án
- Trắc nghiệm Sinh học lớp 12 có đáp án
- Trắc nghiệm Hóa học lớp 12 có đáp án
- Trắc nghiệm Ngữ văn lớp 12 có đáp án
- Trắc nghiệm Tiếng Anh lớp 12 có đáp án
- Trắc nghiệm Địa lí lớp 12 có đáp án
- Trắc nghiệm Vật Lí lớp 12 có đáp án
- Trắc nghiệm Công nghệ lớp 12 có đáp án
- Trắc nghiệm Giáo dục công dân lớp 12 có đáp án
- Trắc nghiệm Lịch sử lớp 12 có đáp án
- Trắc nghiệm Giáo dục quốc phòng - an ninh lớp 12 có đáp án
