Trắc nghiệm Clo có đáp án – Hóa lớp 10
Bộ 30 bài tập trắc nghiệm Hóa lớp 10 Bài 22: Clo có đáp án đầy đủ các mức độ giúp các em ôn trắc nghiệm Hóa 10 Bài 22.
Trắc nghiệm Hóa 10 Bài 22: Clo
Bài giảng Hóa 10 Bài 22: Clo
Câu 1: Khí Cl2 ẩm có tính tẩy màu là do
A. Cl2 có tính oxi hóa mạnh.
B. Cl2 tác dụng với nước tạo thành HClO có tính tẩy màu.
C. Cl2 tác dụng với nước tạo thành dung dịch axit.
D. Cl2 vừa có tính oxi hóa, vừa có tính khử.
Đáp án: B
Giải thích:
Khi tan trong nước, một phần khí clo tác dụng với nước theo phản ứng thuận nghịch:
Axit hipoclorơ có tính oxi hóa rất mạnh, nó phá hủy các chất màu, vì thế clo ẩm có tác dụng tẩy màu.
Câu 2: Nếu cho 1 mol mỗi chất: CaOCl2, KMnO4, KClO3, MnO2 lần lượt phản ứng với lượng dư dung dịch HCl đặc, chất tạo ra lượng khí Cl2 nhiều nhất là
A. KMnO4
B. KClO3
C. CaOCl2
D. MnO2
Đáp án: B
Giải thích:

Do đó, chất tạo ra lượng khí Cl2 nhiều nhất là KClO3
Câu 3: Trong phòng thí nghiệm, khí clo được điều chế bằng cách oxi hóa hợp chất nào sau đây?
A. NaCl
B. HCl
C. KClO3
D. KMnO4
Đáp án: B
Giải thích:
Câu 4: Đốt 28 gam bột sắt trong khí clo dư. Khối lượng muối clorua sinh ra là
A. 32,50 gam
B. 24,50 gam
C. 81,25 gam
D. 25,40 gam
Đáp án: C
Giải thích:
Ta có: nFe = 0,5 mol
Câu 5: Cho 10,8 gam kim loại M tác dụng hoàn toàn với khí Cl2 dư thu được 53,4 gam muối clorua. Kim loại M là
A. Mg
B. Al
C. Fe
D. Zn
Đáp án: B
Giải thích:
Phương trình hóa học:
Với n = 3 → M = 27 (Al).
Câu 6: Cho 13,44 lít khí clo (đktc) đi qua 2,5 lít dung dịch KOH ở 1000C. Sau khi phản ứng xảy ra hoàn toàn, thu được 37,25 gam KCl. Dung dịch KOH trên có nồng độ là
A. 0,24M
B. 0,20M
C. 0,40M
D. 0,48M
Đáp án: A
Giải thích:
Vì Cl2 dư, KOH phản ứng hết
→ Tính số mol KOH theo KCl
→ nKOH = 0,6 mol
→ CM(KOH) = 0,24M
Câu 7: Cho V lít Cl2 tác dụng với dung dịch NaOH vừa đủ ở điều kiện thường, cô cạn dung dịch thu được m1 gam muối khan. Cũng lấy V lít Cl2 cho tác dụng với dung dịch NaOH vừa đủ, đun nóng ở 80oC, cô cạn dung dịch thu được m2 gam muối. Thể tích khí Cl2 đo ở cùng điều kiện. Tỉ lệ m1:m2 là
A. 1:2
B. 1:1,5.
C. 1:1
D. 2:1.
Đáp án: C
Giải thích:
Bảo toàn khối lượng cho phương trình (1)
(*)
Bảo toàn khối lượng cho phương trình (2)
(**)
Theo phương trình:
Từ (*) và (**) → m1 = m2
→ m1 : m2 = 1:1
Câu 8: Thể tích khí Cl2 (đktc) thu được khi cho 3,95 gam KMnO4 phản ứng hết với dung dịch HCl (lấy dư) là
A. 1,4000 lít
B. 1,4560 lít
C. 1,3440 lít
D. 0,0625 lít
Đáp án: A
Giải thích:
Bảo toàn electron:
lít
Câu 9: Cho 1 lít H2 (đktc) tác dụng với 0,672 lít Cl2 (đktc) rồi hòa tan sản phẩm vào nước để được 20 gam dung dịch A. Lấy 5 gam A tác dụng với dung dịch AgNO3 dư thu được 1,435 gam kết tủa. Tính hiệu suất phản ứng giữa H2 và Cl2 (giả sử Cl2 và H2 không tan trong nước)
A. 50%
B. 33,33%
C. 60%
D. 66,67%
Đáp án: D
Giải thích:
H2 + Cl2 → 2HCl
Vì hiệu suất phản ứng tính theo Cl2
AgNO3 + HCl → AgCl ↓ + HNO3
→ nHCl (5g A) = nAgCl = 0,01 mol
→ nHCl (20g A) = 0,01.4 = 0,04 mol
Theo phương trình:
Câu 10: Trong tự nhiên clo có mấy đồng vị bền, là những đồng vị nào?
A. Có hai đồng vị bền là 35Cl và 37Cl
B. có 2 đồng vị bền là 36Cl và 37Cl
C. có 3 đồng vị bền là 35Cl, 36Cl và 37Cl
D. có 1 đồng vị bền là 35,5Cl
Đáp án: A
Giải thích:
Câu 11: Trong phản ứng: Cl2 + H2O HCl + HClO clo đóng vai trò
A. Là chất khử
B. Vừa là chất oxi hóa, vừa là chất khử
C. Là chất oxi hóa
D. Không là chất oxi hóa, không là chất khử
Đáp án: B
Giải thích:
Xét sự thay đổi số oxi hóa của Cl:
+ Tăng từ 0 lên +1 (trong HClO)
+ Giảm từ 0 xuống -1 (trong HCl)
⇒ Clo vừa là chất khử vừa là chất oxi hóa
Câu 12: Nước clo có màu:
A. vàng lục
B. vàng da cam
C. vàng đậm
D. vàng nhạt
Đáp án: A
Giải thích:
Câu 13: Hiện tượng xảy ra khi cho dây sắt nóng đỏ vào bình đựng khí clo là:
A. Có khói trắng
B. Có khói nâu
C. Có khói đen
D. Có khói tím
Đáp án: B
Giải thích:
Câu 14. Cho sơ đồ chuyển hóa sau: Cl2 → X → Y → Z → X → Cl2. Trong đó X, Y, Z là các chất rắn; Y và Z đều chứa natri. X, Y, Z là
A. NaCl, NaBr, Na2CO3
B. NaBr, NaOH, Na2CO3
C. NaCl, Na2CO3, NaOH
D. NaCl, NaOH, Na2CO3
Đáp án: D
Giải thích:
Cl2 → NaCl → NaOH → Na2CO3 → NaCl → Cl2.
2Na + Cl2 → 2NaCl
2NaCl +2H2O ![]() 2NaOH + H2 + Cl2
2NaOH + H2 + Cl2
2NaOH + CO2 → Na2CO3 + H2O
Na2CO3 + 2HCl → 2NaCl + H2O + CO2
2NaCl +2H2O ![]() 2NaOH + H2 + Cl2
2NaOH + H2 + Cl2
Câu 15. Đốt cháy hết 13,6g hỗn hợp Mg, Fe trong bình kín chứa khí clo dư, sau phản ứng thì lượng clo trong bình giảm tương ứng 0,4 mol. Khối lượng muối clorua khan thu được là.
A. 65,0 g.
B. 38,0 g.
C. 50,8 g.
D. 42,0 g.
Đáp án: D
Giải thích:
Câu 16. Nước Gia-ven là hỗn hợp các chất nào sau đây?
A. HCl, HClO, H2O.
B.NaCl, NaClO, H2O.
C. NaCl, NaClO3, H2O.
D. NaCl, NaClO4, H2O.
Đáp án: B
Giải thích:
Câu 17. Clorua vôi có công thức là
A. CaOCl.
B. CaOCl2.
C. Ca(OCl)2.
D. CaCl2.
Đáp án: B
Giải thích:
Câu 18. Xét phản ứng: 2Cl2 + 6KOH 5KCl + KClO3 + 3H2O.
Trong phản ứng trên, Cl2 đóng vai trò
A. chất khử.
B. vừa là chất oxi hóa, vừa là chất khử.
C. chất oxi hóa.
D. môi trường.
Đáp án: B
Giải thích:
Câu 19. Brom có lẫn một ít tạp chất là clo. Một trong các hoá chất có thể loại bỏ clo ra khỏi hỗn hợp là
A. KBr.
B. KCl.
C. H2O.
D. NaOH.
Đáp án: A
Giải thích:
- KBr được vì chỉ có clo phản ứng theo phản ứng sau:
Cl2 + 2KBr → 2KCl + Br2.
- KCl không được ⇒ Ko tách được clo.
- H2O xảy ra phản ứng của clo và brom với nước và một phần tan trong nước ⇒ ko tách được.
- NaOH cả brom và clo đều phản ứng ⇒ không tách được.
Câu 20. Trong phòng thí nghiệm, khí X được điều chế và thu vào bình tam giác bằng cách đẩy không khí như hình vẽ dưới đây:
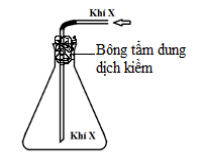
Khí X là
A. Cl2.
B. N2.
C. H2.
D. NH3.
Đáp án: A
Giải thích:
Câu 21. Đun nóng Na với Cl2 thu được 11,7 gam muối. Khối lượng Na và thể tích khí clo (đktc) đã phản ứng là
A. 4,6gam; 2,24 lít.
B. 2,3gam; 2,24 lít.
C. 4,6gam; 4,48lít.
D. 2,3gam; 4,48 lít.
Đáp án: A
Giải thích:
2Na + Cl2 → 2 NaCl
0,2 0,1 0,2 (mol).
Khối lượng Na là: 23 . 0,2 = 4,6g.
Thể tích Cl2: 0,1 . 22,4= 2,24 lít.
Câu 22. Cho clo tác dụng với vừa đủ với Fe rồi hòa tan lượng muối sinh ra vào nước được 100g dung dịch muối có nồng độ 16,25%. Khối lượng sắt và clo (đktc) đã dùng là
A. 0,56 gam; 2,24 lít
B. 5,6 gam; 3,36 lít
C. 11,2 gam; 4,48 lít
D. 1,12 gam; 2,4 lít
Đáp án: B
Giải thích:
= = 16,25g ⇒ = 0,1 mol
2Fe + 3Cl2 → 2FeCl3
0,1 0,15 0,1 (mol).
Khối lượng sắt là: 0,1.56 = 5,6g;
Thể tích clo là: 0,15. 22,4= 3,36 lít.
Câu 23. Cho 14 gam Fe vào bình chứa 10,08 lít clo (đktc) tác dụng với nung nóng rồi lấy chất rắn thu được hoà vào nước và khuấy đều thì thu được 500 g dung dịch X. Nồng độ phần trăm của dung dịch X là
A. 6,35%
B. 9,19%
C. 8,125%
D. 11,43%
Đáp án: C
Giải thích:
2Fe + 3Cl2 → 2FeCl3
Bài cho: 0,25 0,45
Phản ứng: 0,25 0,375 0,25
Sau phản ứng 0 0,075 0,25
⇒ Clo dư
Khối lượng muối thu được là
m = = 0,25 . 162,5 = 40,625g
⇒ C% = 8,125%
Câu 24. Cho 0,12 mol Al tác dụng vừa hết với đơn chất halogen X2 thu được 16,02 gam muối Y. Cho các phát biểu sau
(1) X thuộc chu kì 3, nhóm VIIA trong bảng HTTH.
(2) X oxi hóa Fe thành muối Fe2+ ở nhiệt độ cao.
(3) X là nguyên tố có độ âm điện lớn nhất trong nhóm halogen.
(4) Phản ứng giữa X2 và H2 gây nổ mạnh ở tỉ lệ thể tích 1:1.
(5) Dung dịch NaX không tác dụng với dung dịch AgNO3 dư.
(6) Muối NaXO được dùng để tẩy rửa.
(7) Điện phân dung dịch là phương pháp duy nhất để điều chế X2.
Số phát biểu đúng là
A. 3.
B. 4.
C. 5.
D. 6.
Đáp án: A
Giải thích:
⇒ 0,12. (27 + 3MX) = 16,02
⇒ MX = 35,5 ⇒ X là Clo
Vậy các phát biểu (1); (4) và (6) đúng.
Câu 25. Cho m gam bột Fe tác dụng với khí Cl2 sau khi phản ứng kết thúc thu được m + 12,78 gam hỗn hợp X. Hoà tan hết hỗn hợp X trong nước cho đến khi X tan tối đa thì thu được dung dịch Y và 1,12 gam chất rắn. Giá trị của m là.
A. 5,6 gam
B. 11,2 gam
C. 16,8 gam
D. 8,4 gam.
Đáp án: B
Giải thích:
Bản chất phản ứng:
2Fe + 3Cl2 2FeCl3
Fe + 2FeCl3 → 3FeCl2
⇒ nFe pư = nClo
Câu 26. Cho 7,84 lít hỗn hợp khí X (đktc) gồm Cl2 và O2 phản ứng vừa đủ với 11,1 gam hỗn hợp Y gồm Mg và Al, thu được 30,1 gam hỗn hợp Z. Phần trăm khối lượng của Al trong Y là.
A. 75,68%.
B. 24,32%.
C. 51,35%.
D. 48,65%.
Đáp án: B
Giải thích:
Đặt số mol Cl2 là x mol; số mol O2 là y mol. Theo bài ra ta có hệ phương trình:
Gọi số mol Mg và Al lần lượt là a và b mol. Theo bài ra ta có hệ phương trình:
Vậy %mAl =
Câu 27. Khi cho 6,72 lít khí clo (ở đktc) lội qua dung dịch NaBr dư. Sau khi phản ứng xảy ra hoàn toàn khối lượng brom thu được là
A. 12 gam.
B. 48 gam.
C. 16 gam.
D. 24 gam.
Đáp án: B
Giải thích:
PTHH:
Cl2 + 2NaBr → 2NaCl + Br2
0,3 0,3 mol
Vậy m = 0,3.160 = 48 gam
Câu 28. Sục khí clo dư vào dung dịch NaBr và NaI đến phản ứng hoàn toàn ta thu được 1,17g NaCl. Số mol hỗn hợp NaBr và NaI có trong dung dịch ban đầu:
A. 0,1mol
B. 015mol
C. 0,25mol
D. 0,02mol
Đáp án: D
Giải thích:
Cl2 + 2NaBr → 2NaCl + Br2
Cl2 + 2NaI → 2NaCl + I2
Câu 29. Có phản ứng hoá học xảy ra như sau:
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
Câu nào diễn tả đúng tính chất các chất phản ứng?
A. H2S là chất khử, H2O là chất oxi hoá.
B. Cl2 là chất oxi hoá. H2O là chất khử.
C. H2S là chất oxi hoá, Cl2 là chất khử.
D. Cl2 là chất oxi hoá. H2S là chất khử.
Đáp án: D
Giải thích:
PTHH: H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
Trong phản ứng trên, số oxi hóa của lưu huỳnh tăng từ -2 lên +6 ⇒ H2S là chất khử
Số oxi hóa của Clo giảm từ 0 xuống -1 ⇒ Cl2 là chất oxi hóa
Câu 30. Số oxi hóa của clo trong hợp chất HCl, KClO3, HClO, HClO3, HClO4 lần lượt là:
A. +1, +5, -1, +3, +7.
B. -1, +5, +1, +3, -7.
C. -1, -5, +1, +5, +7.
D. -1, +5, +1, +5, +7.
Đáp án: D
Giải thích:
Các câu hỏi trắc nghiệm Hóa lớp 10 có đáp án, chọn lọc khác:
Trắc nghiệm Hiđro clorua – axit clohiđric và muối clorua có đáp án
Trắc nghiệm Sơ lược về hợp chất có oxi của clo có đáp án
Trắc nghiệm Flo – brom - iot có đáp án
Xem thêm các chương trình khác:
- Trắc nghiệm Sinh học lớp 7 có đáp án
- Trắc nghiệm Toán lớp 7 có đáp án
- Trắc nghiệm Ngữ văn lớp 7 có đáp án
- Trắc nghiệm Sinh học 8 có đáp án
- Trắc nghiệm Toán lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn 8 có đáp án
- Trắc nghiệm Hóa học lớp 8 có đáp án
- Trắc nghiệm Địa Lí lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Tiếng Anh lớp 8 có đáp án
- Trắc nghiệm GDCD lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Lịch sử lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Vật Lí lớp 8 có đáp án
- Trắc nghiệm Công nghệ lớp 8 có đáp án
- Trắc nghiệm Tin học lớp 8 có đáp án
- Trắc nghiệm Sinh học lớp 9 có đáp án
- Trắc nghiệm Toán lớp 9 có đáp án
- Trắc nghiệm Ngữ văn 9 có đáp án
- Trắc nghiệm Hóa học lớp 9 có đáp án
- Trắc nghiệm Địa lí lớp 9 có đáp án
- Trắc nghiệm Tiếng Anh lớp 9 có đáp án
- Trắc nghiệm GDCD lớp 9 có đáp án
- Trắc nghiệm Lịch sử lớp 9 có đáp án
- Trắc nghiệm Vật lí lớp 9 có đáp án
- Trắc nghiệm Công nghệ lớp 9 có đáp án
- Trắc nghiệm Sinh học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Toán lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Hóa học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn lớp 11 có đáp án
- Trắc nghiệm Tiếng Anh lớp 11 có đáp án
- Trắc nghiệm Vật Lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Địa lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm GDCD lớp 11 có đáp án
- Trắc nghiệm Lịch sử lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Công nghệ lớp 11 có đáp án
- Trắc nghiệm Giáo dục quốc phòng - an ninh lớp 11 có đáp án
- Trắc nghiệm Tin học lớp 11 có đáp án
- Trắc nghiệm Toán lớp 12 có đáp án
- Trắc nghiệm Sinh học lớp 12 có đáp án
- Trắc nghiệm Hóa học lớp 12 có đáp án
- Trắc nghiệm Ngữ văn lớp 12 có đáp án
- Trắc nghiệm Tiếng Anh lớp 12 có đáp án
- Trắc nghiệm Địa lí lớp 12 có đáp án
- Trắc nghiệm Vật Lí lớp 12 có đáp án
- Trắc nghiệm Công nghệ lớp 12 có đáp án
- Trắc nghiệm Giáo dục công dân lớp 12 có đáp án
- Trắc nghiệm Lịch sử lớp 12 có đáp án
- Trắc nghiệm Giáo dục quốc phòng - an ninh lớp 12 có đáp án
