Trắc nghiệm Lưu huỳnh có đáp án - Hóa học lớp 10
Bộ 30 bài tập trắc nghiệm Hóa học lớp 10 Bài 30: Lưu huỳnh khử có đáp án đầy đủ các mức độ giúp các em ôn trắc nghiệm Hóa học 10.
Trắc nghiệm Hóa học lớp 10 Bài 30: Lưu huỳnh
Bài 1: Câu nào sau đây diễn tả đúng tính chất hóa học của lưu huỳnh?
A. Lưu huỳnh có cả tính oxi hóa và tính khử.
B. Lưu huỳnh không có tính oxi hóa và cả tính khử.
C. Lưu huỳnh chỉ có tính khử
D. Lưu huỳnh chỉ có tính oxi hóa
Đáp án: A
Giải thích:
Đơn chất lưu huỳnh khi tham gia phản ứng hóa học, số oxi hóa của nó có thể giảm hoặc tăng. Ta nói, lưu huỳnh có tính oxi hóa và tính khử.
Bài 2: Dãy đơn chất nào sau đây vừa có tính oxi hóa, vừa có tính khử?
A. S, Cl2, Br2
B. Na, F2, S
C. Br2, O2, Ca
D. Cl2, O3, S
Đáp án: A
Giải thích:
Chất vừa có tính khử vừa có tính oxi hóa khi chất đó có số oxi hóa ở trạng thái trung gian. Tức là vừa có thể lên cao hơn vừa có thể xuống thấp hơn
: có thể lên +4 (SO2) hoặc xuống -2 (H2S)
: có thể lên +1 (NaClO) hoặc xuống -1 (NaCl)
: có thể lên +1 (NaBrO) hoặc xuống -1 (NaBr)
Bài 3: Hơi thủy ngân rất độc, do đó phải thu hồi thủy ngân rơi vãi bằng cách
A. nhỏ nước brom lên giọt thủy ngân
B. rắc bột lưu huỳnh lên giọt thủy ngân
C. nhỏ nước ozon lên giọt thủy ngân
D. rắc bột photpho lên giọt thủy ngân
Đáp án: B
Giải thích:
Thủy ngân có thể phản ứng ngay với lưu huỳnh ở điều kiện thường tạo thành hợp chất không bay hơi (HgS).
Hg + S → HgS (không bay hơi)
Bài 4: So sánh tính oxi hóa của oxi, ozon, lưu huỳnh ta thấy:
A. Lưu huỳnh > Oxi > Ozon
B. Oxi > Ozon > Lưu huỳnh
C. Lưu huỳnh < Oxi < Ozon
D. Oxi < Ozon < Lưu huỳnh
Đáp án: C
Giải thích:
Tính oxi hóa: Lưu huỳnh < Oxi < Ozon
Bài 5: Nung 11,2 gam Fe và 26 gam Zn với một lượng S dư. Sản phẩm của phản ứng cho tan hoàn toàn trong dung dịch H2SO4 loãng, toàn bộ khí sinh ra được dẫn vào dung dịch CuSO4 10% (d = 1,2 gam/ml). Biết các phản ứng xảy ra hoàn toàn. Thể tích tối thiểu của dung dịch CuSO4 cần để hấp thụ hết khí sinh ra là:
A. 700 ml
B. 800 ml
C. 500 ml
D. 600 ml
Đáp án: B
Giải thích:
n Fe = 0,2 mol
n Zn = 0,4 mol
Theo các phương trình phản ứng :
→ V dung dịch = 800 ml
Bài 6: Chọn câu sai:
A. Không khí chứa một lượng rất nhỏ ozon (dưới một phần triệu theo thể tích) sẽ gây ngộ độc
B. Oxi có vai trò quyết định đối với sự sống của người và động vật
C. 90% lượng lưu huỳnh khai thác được dùng để sản xuất H2SO4
D. Trong đời sống, người ta dùng ozon để sát trùng nước sinh hoạt
Đáp án: A
Giải thích:
B, C, D đúng
A sai. Có 1 lượng rất nhỏ Ozon (dưới 1 phần triệu theo thể tích) sẽ làm không khí trong lành hơn.
Bài 7: Các số oxi hóa thường gặp của lưu huỳnh là
A. -2, 0, + 4, +6
B. -4, 0, +2, +4
C. -3, 0, +3, +5
D. -3, 0, +1 đến +5
Đáp án: A
Giải thích:
Các số oxi hóa của lưu huỳnh: -2, 0, + 4, +6
Bài 8: Tính chất hóa học của lưu huỳnh:
A. Tính khử
B. Trung tính
C. Tính oxi hóa và tính khử
D. Kim loại
Đáp án: C
Giải thích:
Do ở dạng đơn chất, lưu huỳnh có số oxi hóa 0, là số oxi hóa trung gian.
Do đó tính chất hóa học của lưu huỳnh: Tính oxi hóa và tính khử.
Bài 9: Cho sơ đồ phản ứng:
S + H2SO4 đặc → X + H2O. Vậy X là:
A. H2S
B. H2SO4
C. SO3
D. SO2.
Đáp án: D
Giải thích:
S + 2H2SO4 đặc → 3SO2 + 2H2O
Vậy X là SO2.
Câu 10: Lưu huỳnh tác dụng với axit sunfuric đặc, nóng:
S + 2H2SO4 → 3SO2 + 2H2O.
Trong phản ứng này, tỉ lệ số nguyên tử lưu huỳnh bị khử và số nguyên tử lưu huỳnh bị oxi hóa là
A. 1: 2
B. 2: 1
C. 1: 3
D. 3: 1
Đáp án: B
Giải thích:
S là chất khử (chất bị oxi hóa); H2SO4 là chất oxi hóa (chất bị khử)
Số nguyên tử lưu huỳnh bị khử : số nguyên tử lưu huỳnh bị oxi hóa = 2 : 1
Bài 11: Chọn câu trả lời sai về lưu huỳnh?
A. Lưu huỳnh là chất rắn màu vàng.
B. Lưu huỳnh có 2 dạng thù hình.
C. Lưu huỳnh có 6e ở lớp ngoài cùng.
D. Lưu huỳnh chỉ có tính oxi hóa.
Đáp án: D
Giải thích:
A đúng
B đúng, đó là lưu huỳnh tà phương và lưu huỳnh đơn tà
C đúng
D sai vì ở dạng đơn chất S có số oxi hóa 0 là số oxi hóa trung gian nên S vừa có tính oxi hóa và tính khử
Bài 12: Trộn 5,6 gam bột sắt với 2,4 gam bột lưu huỳnh rồi nung nóng (trong điều kiện không có không khí), thu được hỗn hợp rắn M. Cho M tác dụng với lượng dư dung dịch HCl, giải phóng hỗn hợp khí X và còn lại một phần không tan G. Để đốt cháy hoàn toàn X và G cần vừa đủ V lít khí O2 (ở đktc). Giá trị của V là
A. 2,80.
B. 3,08.
C. 4,48.
D. 3,36.
Đáp án: A
Giải thích:
Ta có: nFe = 0,1 mol và nS = 0,075 mol
Phương trình hóa học xảy ra:
Fe + S FeS
Đặt nFe pứ = x mol
Ta có hỗn hợp rắn M thu được chứa x mol FeS, (0,1-x) mol Fe, (0,075-x) mol S
Cho M tác dụng với HCl dư thu được khí X chứa x mol H2S và (0,1-x) mol H2. Phần không tan G là S.
Khi đốt cháy X và G:
2H2S + 3O2 2SO2 + 2H2O
2H2 + O2 2H2O
S + O2 SO2
Theo các PTHH ta có:
Bài 13: Chất nào sau đây có màu vàng?
A. H2S.
B. SO2.
C. SO3.
D. S.
Đáp án: D
Giải thích:
Ở điều kiện thường:
- H2S, SO2 đều là các khí không màu
- SO3 là chất lỏng không màu
- S là chất rắn màu vàng
Bài 14: Dãy gồm các chất đều tác dụng với lưu huỳnh (trong điều kiện phản ứng thích hợp) là:
A. Zn, H2, O2, F2.
B. H2, Pt, Cl2, KClO3.
C. Hg, O2, F2, HCl.
D. Na, He, Br2, H2SO4 loãng.
Đáp án: A
Giải thích:
- Dãy B: S không tác dụng với Pt.
- Dãy C: S không tác dụng với HCl
- Dãy D: S không tác dụng với He, H2SO4 loãng.
Lưu huỳnh tác dụng với dãy chất: Zn, H2, O2, F2.
Bài 15: Số oxi hoá của lưu huỳnh trong một loại hợp chất oleum H2S2O7 là
A. +8
B. -2
C. +4
D. +6
Số oxi hoá của lưu huỳnh trong hợp chất oleum H2S2O7 là +6.
Đáp án: D
Giải thích:
Bài 16: Nung nóng hỗn hợp bột gồm 1,5 mol Fe và 1 mol S trong môi trường không có không khí đến khi phản ứng xảy ra hoàn toàn, thu được chất rắn X. Cho X tác dụng với dung dịch HCl dư thu được khí Y. Thành phần của khí Y là
A. H2S.
B. H2.
C. H2S và SO2.
D. H2S và H2.
Đáp án: D
Giải thích:
Fe + S FeS
Bđ: 1,5 1 mol
Pư: 1dư 0,5 ← 1 → 1 mol
Vậy chất rắn X gồm Fe dư và FeS
⇒ Khí Y gồm H2 và H2S
Bài 17: Lưu huỳnh có bao nhiêu dạng thù hình?
A. 2.
B. 5.
C. 3.
D. 4.
Đáp án: A
Giải thích:
Lưu huỳnh có 2 dạng thù hình là lưu huỳnh tà phương và lưu huỳnh đơn tà.
Bài 18: Phát biểu nào sau đây sai?
A. Điều kiện thường, lưu huỳnh ở thể rắn.
B. Lưu huỳnh tác dụng với thủy ngân ngay ở nhiệt độ thường.
C. Lưu huỳnh vừa có tính oxi hóa, vừa có tính khử.
D. Lưu huỳnh dễ tan trong nước.
Đáp án: D
Giải thích:
A đúng vì ở điều kiện thường, lưu huỳnh là chất rắn, màu vàng
B đúng vì lưu huỳnh phản ứng với Hg ngay ở nhiệt độ phòng, theo phương trình hóa học:
S + Hg → HgS
C đúng vì S đơn chất có số oxi hóa trung gian nên vừa có tính oxi hóa, vừa có tính khử
D sai vì S không tan trong nước
Bài 19: Ứng dụng nào sau đây không phải của lưu huỳnh?
A. Làm nguyên liệu sản xuất axit sunfuric
B. Làm chất lưu hóa cao su
C. Khử chua đất
D. Điều chế thuốc nổ đen
Đáp án: C
Giải thích:
Lưu huỳnh có nhiều ứng dụng quan trọng trong nhiều ngành công nghiệp như: làm nguyên liệu để sản xuất H2SO4, lưu hóa cao su, điều chế thuốc nổ đen, chất trừ sâu,…
⇒ A, B, D đúng, C sai
Bài 20: Đun nóng một hỗn hợp gồm có 0,65 gam bột kẽm và 0,224 gam bột lưu huỳnh trong ống nghiệm đậy kín không có không khí đến khi phản ứng xảy ra hoàn toàn. Khối lượng kẽm sunfua thu được là
A. 0,291 gam
B. 0,697 gam.
C. 0,096 gam
D. 0,970 gam
Đáp án: B
Giải thích:
Ta có: nZn = 0,01 mol; nS = 0,007 mol
Phương trình hóa học:
Zn + S ZnS
Xét tỉ lệ Zn dư,
S phản ứng hết → tính theo S
Theo phương trình hóa học:
nZnS = nS = 0,007 mol
→ mZnS = 0,679 gam
Bài 21: Cho 1,10 gam hỗn hợp bột sắt và bột nhôm tác dụng vừa đủ với 1,28 gam bột lưu huỳnh. Phần trăm khối lượng của sắt trong hỗn hợp ban đầu là
A. 33,33%
B. 66,67%
C. 49,09%
D. 50,91%
Đáp án: D
Giải thích:
Ta có: nS = 0,04 mol
Gọi số mol của Fe, Al trong hỗn hợp ban đầu lần lượt là a, b mol
→ 56a + 27b = 1,10 (*)
Sơ đồ phản ứng:
Bảo toàn electron: 2nFe + 3nAl = 2nS
→ 2a + 3b = 2.0,04 (**)
Từ (*) và (**) → a = 0,01 và b = 0,02
Bài 22: Nung hỗn hợp X gồm m gam Fe và a gam S ở nhiệt độ cao, sau một thời gian thu được chất rắn Y. Cho Y vào dung dịch HCl dư thu được 2,688 lít hỗn hợp khí Z và còn lại một chất rắn không tan. Giá trị của m là
A. 11,20
B. 6,72
C. 5,60
D. 22,40
Đáp án: B
Giải thích:
Ta có: nZ = 0,12 mol
Bảo toàn nguyên tố H:
→ nHCl = 0,24 mol
Bảo toàn nguyên tố Cl:
Bảo toàn nguyên tố Fe:
→mFe = 6,72g
Bài 23: Nung một hỗn hợp gồm 4,8 gam bột Magie và 3,2 gam bột lưu huỳnh trong một ống nghiệm đậy kín. Khối lượng chất rắn thu được sau phản ứng là
A. 8,0 gam
B. 11,2 gam
C. 5,6 gam
D. 4,8 gam
Đáp án: A
Giải thích:
Ta có:
Phương trình phản ứng:
Mg + S MgS;
Ta có:
⇒ Mg dư
Chất rắn gồm: MgS: 0,1 mol và Mg dư 0,1 mol
⇒ mrắn = 56.0,1 + 24.0,1 = 8 gam.
Bài 24: Hấp thụ 7,84 lít (đktc) khí H2S vào 64 gam dung dịch CuSO4 10%, sau phản ứng hoàn toàn thu được m gam kết tủa đen. Gía trị của m là:
A. 33,6 gam
B. 38,4 gam
C. 3,36 gam
D. 3,84 gam
Đáp án: A
Giải thích:
Phương trình phản ứng:
H2S + CuSO4 CuS + H2SO4.
Ta có:
⇒ H2S dư và CuSO4 hết.
Bài 25: Hòa tan hoàn toàn m gam hỗn hợp X gồm Fe và FeS trong dung dịch HCl dư thu được dung dịch Y và thoát ra 4,928 lít hỗn hợp khí Z. Cho hỗn hợp khí Z qua dung dịch Pb(NO3)2 dư thu được 47,8 gam kết tủa đen. Thành phần phần trăm về khối lượng của FeS trong hỗn hợp X gần nhất với giá trị nào sau đây?
A. 94%.
B. 6%
C. 60%
D. 40%
Đáp án: A
Giải thích:
Gọi x, y lần lượt là số mol Fe, FeS trong hỗn hợp X.
Phương trình phản ứng:
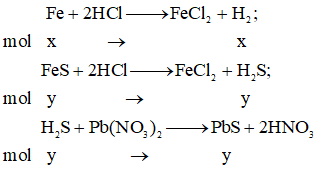
Ta có:
Bài 26: Nung 5,6 gam bột sắt và 13 gam kẽm với một lượng dư bột lưu huỳnh, sau phản ứng thu được rắn X. Hòa tan hoàn toàn X trong dung dịch axit clohidric thu được khí Y. Dẫn khí Y vào V lít dung dịch CuSO4 dư, sau phản ứng hoàn toàn thu được m gam kết tủa. Gía trị của m là:
A. 9,6 gam
B. 19,2 gam
C. 18,6 gam
D. 28,8 gam
Đáp án: D
Giải thích:
Phương trình phản ứng:
Fe + S FeS
Zn + S ZnS
FeS + 2HCl FeCl2 + H2S
ZnS + 2HCl ZnCl2 + H2S
H2S + CuSO4 CuS + H2SO4
Ta có:
Bài 27: Cho 2,24 lit (đktc) khí H2S hấp thụ hết vào 85 ml dung dịch NaOH 2M, sau phản ứng thu được dung dịch X. Dung dịch X chứa các chất tan gồm:
A. NaHS và Na2S.
B. NaHS .
C. Na2S.
D. Na2S và NaOH.
Đáp án: A
Giải thích:
Ta có:
Muối gồm hay
Bài 28: Đốt cháy hoàn toàn m gam S có trong oxi dư, hấp thụ toàn bộ sản phẩm cháy vào 120 ml dung dịch NaOH 1M thì thu được dung dịch chứa 2 muối có cùng nồng độ mol. Giá trị của m là
A. 3,84 gam
B. 2,56 gam
C. 3,20 gam
D. 1,92 gam
Đáp án: B
Giải thích:
Phản ứng của lưu huỳnh cháy trong khí oxi:
O2 + S SO2;
SO2 tác dụng với dung dịch NaOH thu được 2 muối là NaHSO3 và Na2SO3.
Vì 2 muối có nồng độ bằng nhau nên chúng có số mol bằng nhau
Bảo toàn nguyên tố Na
Bảo toàn nguyên tố S
Bài 29: Đốt cháy hoàn toàn 8,96 lít H2S (đktc) trong oxi dư, rồi dẫn tất cả sản phẩm vào 50 ml dung dịch NaOH 25% (d = 1,28). Nồng độ phần trăm của muối trong dung dịch là :
A. 47,92%.
B. 42,98%.
C. 42,69%.
D. 46,43%.
Đáp án: B
Giải thích:
Sơ đồ bài toán:
8,96 lít H2S + O2
Muối?
Phản ứng của H2S cháy trong khí oxi:
3O2 + 2H2S 2SO2 + 2H2O.
Ta có:
Muối hay NaHSO3
Bảo toàn nguyên tố S
Khối lượng dung dịch sau phản ứng
Bài 30: Hoà tan hoàn toàn m gam hỗn hợp gồm Fe và FeS bằng dung dịch HCl thấy thoát ra 8,96 lít (đkc) hỗn hợp khí X. Dẫn hỗn hợp khí X đi qua dung dịch CuCl2 dư, tạo ra 9,6 gam kết tủa. Giá trị m gam hỗn hợp đã dùng là
A. 16,8 gam.
B. 18,6 gam.
C. 25,6 gam.
D. 26,5 gam.
Đáp án: C
Giải thích:
Sơ đồ bài toán:
Bảo toàn nguyên tố lưu huỳnh:
Bảo toàn electron:
⇒ nFe = 0,3 mol ⇒ m
= 0,3.56 + 0,1.88 = 25,6 gam.
Các câu hỏi trắc nghiệm Hóa lớp 10 có đáp án, chọn lọc khác:
Trắc nghiệm Hidro sunfua – lưu huỳnh đioxit – lưu huỳnh trioxit có đáp án
Trắc nghiệm Axit sunfuric và muối sunfat có đáp án
Trắc nghiệm Luyện tập: Nhóm oxi – lưu huỳnh có đáp án
Xem thêm các chương trình khác:
- Trắc nghiệm Sinh học lớp 7 có đáp án
- Trắc nghiệm Toán lớp 7 có đáp án
- Trắc nghiệm Ngữ văn lớp 7 có đáp án
- Trắc nghiệm Sinh học 8 có đáp án
- Trắc nghiệm Toán lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn 8 có đáp án
- Trắc nghiệm Hóa học lớp 8 có đáp án
- Trắc nghiệm Địa Lí lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Tiếng Anh lớp 8 có đáp án
- Trắc nghiệm GDCD lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Lịch sử lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Vật Lí lớp 8 có đáp án
- Trắc nghiệm Công nghệ lớp 8 có đáp án
- Trắc nghiệm Tin học lớp 8 có đáp án
- Trắc nghiệm Sinh học lớp 9 có đáp án
- Trắc nghiệm Toán lớp 9 có đáp án
- Trắc nghiệm Ngữ văn 9 có đáp án
- Trắc nghiệm Hóa học lớp 9 có đáp án
- Trắc nghiệm Địa lí lớp 9 có đáp án
- Trắc nghiệm Tiếng Anh lớp 9 có đáp án
- Trắc nghiệm GDCD lớp 9 có đáp án
- Trắc nghiệm Lịch sử lớp 9 có đáp án
- Trắc nghiệm Vật lí lớp 9 có đáp án
- Trắc nghiệm Công nghệ lớp 9 có đáp án
- Trắc nghiệm Sinh học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Toán lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Hóa học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn lớp 11 có đáp án
- Trắc nghiệm Tiếng Anh lớp 11 có đáp án
- Trắc nghiệm Vật Lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Địa lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm GDCD lớp 11 có đáp án
- Trắc nghiệm Lịch sử lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Công nghệ lớp 11 có đáp án
- Trắc nghiệm Giáo dục quốc phòng - an ninh lớp 11 có đáp án
- Trắc nghiệm Tin học lớp 11 có đáp án
- Trắc nghiệm Toán lớp 12 có đáp án
- Trắc nghiệm Sinh học lớp 12 có đáp án
- Trắc nghiệm Hóa học lớp 12 có đáp án
- Trắc nghiệm Ngữ văn lớp 12 có đáp án
- Trắc nghiệm Tiếng Anh lớp 12 có đáp án
- Trắc nghiệm Địa lí lớp 12 có đáp án
- Trắc nghiệm Vật Lí lớp 12 có đáp án
- Trắc nghiệm Công nghệ lớp 12 có đáp án
- Trắc nghiệm Giáo dục công dân lớp 12 có đáp án
- Trắc nghiệm Lịch sử lớp 12 có đáp án
- Trắc nghiệm Giáo dục quốc phòng - an ninh lớp 12 có đáp án
