Trắc nghiệm Phân loại phản ứng trong hóa học vô cơ có đáp án – Hóa học lớp 10
Bộ 30 bài tập trắc nghiệm Hóa học lớp 10 Bài 18: Phân loại phản ứng trong hóa học vô cơ có đáp án đầy đủ các mức độ giúp các em ôn trắc nghiệm Hóa học 10.
Trắc nghiệm Hóa 10 Bài 18: Phân loại phản ứng trong hóa học vô cơ
Bài giảng Hóa 10 Bài 18: Phân loại phản ứng trong hóa học vô cơ
Câu 1: Loại phản ứng nào au đây luôn là phản ứng oxi hóa – khử?
A. phản ứng phân hủy
B. phản ứng hóa hợp
C. phản ứng trao đổi
D. phản ứng thế
Đáp án: D
Giải thích:
Trong hóa học vô cơ, phản ứng thế bao giờ cũng có sự thay đổi số oxi hóa
→ Phản ứng thế luôn là phản ứng oxi hóa khử.
Câu 2: Phản ứng nào sau đây vừa là phản ứng phân hủy, vừa là phản ứng oxi hóa – khử?
A. CaCO3 to→ CaO + CO2
B. NH4NO3 to→ N2O + 2H2O
C. Fe + 2HCl → FeCl2 + H2
D. 2NH3 + 3CuO to→ N2 + 3Cu + 3H2O
Đáp án: B
Giải thích:
Phản ứng phân hủy là phản ứng một chất bị phân hủy thành hai hay nhiều chất.
→ Loại C và D.
Phản ứng B có sự thay đổi số oxi hóa của N:
−3NH4+5NO3
→ Phản ứng B vừa là phản ứng phân hủy vừa là phản ứng oxi hóa khử.
Câu 3: Phản ứng nào sau đây là phản ứng trao đổi?
A. SO3 + H2O → H2SO4
B. 2Cu(NO3)2 → 2CuO + 4NO2 + O2
C. CO2 + C → 2CO
D. H2S + CuCl2 → CuS ↓ + 2HCl
Đáp án: D
Giải thích:
Câu 4: Phản ứng nào sau đây là phản ứng oxi hóa – khử?
A. NaHCO3 +HCl → NaCl + CO2↑ + H2O
B. H2SO4 + Na2O → Na2SO4 + H2O
C. FeO + 10HNO3 → 3Fe(NO3)3 + NO↑ + 5H2O
D. 2AgNO3 + BaCl2 → Ba(NO3)2 + 2AgCl ↓
Đáp án: C
Giải thích:
Phản ứng oxi hóa khử là phản ứng có sự thay đổi số oxi hóa của một hay nhiều nguyên tố.
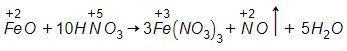
Câu 5: Phản ứng nhiệt phân muối thuộc phản ứng:
A. không oxi hóa – khử.
B. oxi hóa – khử.
C. thuận nghịch.
D. oxi hóa – khử hoặc không.
Đáp án: D
Giải thích:
Phản ứng nhiệt phân muối có thể thay đổi hoặc không thay đổi số oxi hóa → thuộc phản ứng oxi hóa khử hoặc không.
Ví dụ:
CaCO3 CaO + CO2
→ Không phải phản ứng oxi hóa khử.
2KNO3 2KNO2 + O2
→ Thuộc phản ứng oxi hóa khử.
Câu 6: Cặp hóa chất có thể xảy ra phản ứng oxi hóa – khử với nhau là:
A. BaCO3 và H2SO4.
B. Cl2 và KBr.
C. Br2 và NaCl.
D. ZnS và HCl.
Đáp án: B
Giải thích:
A. BaCO3 + H2SO4 → BaSO4↓ + CO2 + H2O
B.
→ Phản ứng oxi hóa khử.
C. Không xảy ra phản ứng.
D. ZnS + 2HCl → H2S↑ + ZnCl2
Câu 7: Những phản ứng nào sau đây chứng minh tính oxi hóa của ozon mạnh hơn oxi ?
(1). O3 + CH4
(2). O3 + KI + H2O →
(3). O3 + Fe
(4). O3 + Ag
A. 1, 2.
B. 2, 3.
C. 2, 4.
D. 1, 4.
Đáp án: C
Giải thích:
Câu 8: Khi cho 7,2 gam Al tác dụng hết với dung dịch H2SO4 đậm đặc, thấy có 49 gam H2SO4 tham gia phản ứng, tạo muối Al2(SO4)3, H2O và sản phẩm khử X. Vậy X là:
A. SO2.
B. H2S.
C. S.
D. SO3.
Đáp án: B
Giải thích:
Al + H2SO4 → Al2(SO4)3 + X + H2O
Nhận thấy: các sản phẩm khử của H2SO4 có thể là SO2, S, H2S đều chỉ có một nguyên tử S.
Bảo toàn nguyên tố Al và S ta có:
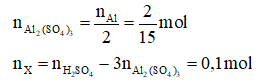
Áp dụng định luật bảo toàn electron ta có:
(k là số electron nhận của H2SO4 bị khử thành X).
→ X là H2S.
Câu 9: Cho các phản ứng sau :
a. FeO + H2SO4 đặc nóng →
b. FeS + H2SO4 đặc nóng →
c. Al2O3 + HNO3 →
d. Cu + Fe2(SO4)3 →
e. Fe(OH)3 + HNO3 →
f. CO + FeO
g. Na + O2
h. Fe + Cu(NO3)2 →
Dãy gồm các phản ứng đều thuộc loại phản ứng oxi hoá – khử là ?
A. a, b, d, e, f, h.
B. a, b, d, f, g, h.
C. a, b, c, d, e, g.
D. a, b, c, d, e, h.
Đáp án: B
Giải thích:
Câu 10: Cho từng chất: Fe, FeO, Fe(OH)2, Fe3O4, Fe2O3, Fe(NO3)3, Fe(NO3)2, FeSO4, Fe2(SO4)3, FeCO3 lần lượt phản ứng với HNO3 đặc nóng. Số lượng phản ứng thuộc loại phản ứng oxi hoá – khử là:
A. 8.
B. 7.
C. 6.
D. 5.
Đáp án: B
Giải thích:
Chất phản ứng được với HNO3 thuộc loại phản ứng oxi hóa khử
→ Chất đó phải là chất khử.
Các chất thỏa mãn: Fe, FeO, Fe(OH)2, Fe3O4, Fe(NO3)2, FeSO4 và FeCO3.
→ Có 7 chất thỏa mãn.
Câu 11: Trong các phản ứng dưới đây, phản ứng nào là không phải là phản ứng oxi hóa - khử?
A. Fe + Cu(NO3)2 → Cu↓ + Fe(NO3)2
B. FeCl2 + Zn → ZnCl2 + Fe
C. Fe2O3 + 3CO 2Fe + 3CO2↑
D. Na2CO3 + 2HCl → 2NaCl + CO2 ↑ + H2O
Đáp án: D
Giải thích:
A, B, C là phản ứng oxi hóa khử.
D không phải phản ứng oxi hóa khử vì các nguyên tố không có sự thay đổi số oxi hóa.
Câu 12: Phản ứng nào sau đây không có sự thay đổi số oxi hóa của các nguyên tố?
A. Phản ứng thế.
B. Phản ứng phân hủy.
C. Phản ứng hóa hợp.
D. Phản ứng trao đổi.
Đáp án: D
Giải thích:
Câu 13: Loại phản ứng vô cơ nào sau đây luôn luôn có sự thay đổi về số oxi hóa của nguyên tố?
A. Phản ứng trao đổi.
B. Phản ứng thế.
C. Phản ứng phân hủy.
D. Phản ứng hóa hợp.
Đáp án: B
Giải thích:
- Phản ứng trao đổi thì không có sự thay đổi số oxi hóa của các nguyên tố.
- Phản ứng hóa hợp và phản ứng phân hủy có thể có sự thay đổi hoặc không thay đổi về số oxi hóa của các nguyên tố.
- Trong phản ứng vô cơ, phản ứng thế bao giờ cũng có sự thay đổi về số oxi hóa.
Câu 14: Phản ứng nào sau đây không phải là phản ứng phân hủy
A. NaNO3
B. Cu + AgNO3 →
C. Fe(OH)2
D. NH4HCO3
Đáp án: B
Giải thích:
Phản ứng phân hủy là một chất bị phân hủy thành hai hay nhiều chất.
→ A, C và D là phản ứng phân hủy.
B là phản ứng thế.
Câu 15: Chất nào sau đây khi bị phân hủy thu được 3 chất?
A. CaCO3
B. Fe(OH)3
C. KMnO4
D. KClO3
Đáp án: C
Giải thích:
CaCO3 CaO + CO2↑
2Fe(OH)3 Fe2O3 + 3H2O
2KMnO4 K2MnO4 + MnO2 + O2↑
2KClO3 2KCl + 3O2↑
Câu 16: Phản ứng nào sau đây là phản ứng tự oxi hóa, tự khử?
A. Cl2 + 2NaOH → NaCl + NaClO + H2O
B. 2KMnO4 K2MnO4 + MnO2 + O2 ↑
C. 4Fe + 3O2 2Fe2O3
D. 4Fe(NO3)3 2Fe2O3 + 12NO2↑ + 3O2 ↑
Đáp án: A
Giải thích:
Phản ứng tự oxi hóa, tự khử là dạng phản ứng mà quá trình oxi hóa và quá trình khử xảy ra với cùng 1 loại nguyên tố.
Chỉ có phản ứng A là có mỗi nguyên tử Cl bị thay đổi số oxi hóa
→ Đây là phản ứng tự oxi hóa khử.
Câu 17: Xét phản ứng sau :
3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O (1)
2NO2 + 2KOH → KNO2 + KNO3 + H2O (2)
Phản ứng (1), (2) thuộc loại phản ứng
A. oxi hóa – khử nhiệt phân.
B. oxi hóa – khử nội phân tử.
C. không oxi hóa – khử.
D. tự oxi hóa – khử.
Đáp án: D
Giải thích:
Phản ứng tự oxi hóa - khử là dạng phản ứng mà quá trình oxi hóa và quá trình khử xảy ra với cùng 1 loại nguyên tố.
Nhận thấy:
- Phản ứng (1) chỉ có nguyên tử Cl bị thay đổi số oxi hóa.
- Phản ứng (2) chỉ có nguyên tử N bị thay đổi số oxi hóa.
→ (1) và (2) đều thuộc loại phản ứng tự oxi hóa – khử.
Câu 18: Phản ứng nào sau đây vừa là phản ứng hóa hợp, vừa là phản ứng oxi hóa – khử ?
A. CaO + CO2 CaCO3
B. 2KMnO4 K2MnO4 + MnO2 + O2↑
C. Fe + 2HCl FeCl2 + H2
D. 4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3↓
Đáp án: D
Giải thích:
- Phản ứng hóa hợp là phản ứng hai hay nhiều chất phản ứng với nhau sinh ra một chất mới.
→ Loại B và C.
- Phản ứng oxi hóa khử là phản ứng mà nguyên tố có sự thay đổi về số oxi hóa.
→ Loại A.
Câu 19: Phản ứng nào sau đây vừa là phản ứng phân hủy, vừa là phản ứng oxi hóa – khử ?
A. 2KMnO4 K2MnO4 + MnO2 + O2↑
B. Ca(OH)2 + CO2 → CaCO3↓ + H2O
C. Ca(HCO3)2 CaCO3 + CO2 + H2O
D. NaOH + HCl → NaCl + H2O
Đáp án: A
Giải thích:
- Phản ứng phân hủy là phản ứng một chất bị phân hủy thành hai hay nhiều chất khác nhau.
→ Loại B và D.
- Phản ứng oxi hóa khử là phản ứng mà nguyên tố có sự thay đổi về số oxi hóa.
→ Loại C.
Câu 20: Phản ứng nào sau đây là phản ứng thế?
A. FeO + HCl → FeCl2 + H2O
B. Fe + Cu(NO3)2 → Cu↓ +Fe(NO3)2
C. Fe(NO3)2 + AgNO3 → Ag↓ + Fe(NO3)3
D. 10Al + 36HNO3 → 10Al(NO3)3 + 3N2 + 18H2O
Đáp án: B
Giải thích:
Câu 21: Loại phản ứng hoá học nào sau đây luôn luôn không phải là phản ứng oxi hoá - khử ?
A. Phản ứng hoá hợp
B. Phản ứng trao đổi
C. Phản ứng thế
D. Phản ứng phân huỷ
Đáp án: B
Giải thích:
- Phản ứng trao đổi thì không có sự thay đổi số oxi hóa của các nguyên tố.
→ Phản ứng trao đổi luôn luôn không phải là phản ứng oxi hoá - khử
Câu 22: Cho sơ đồ phản ứng:
FeS2 + HNO3 Fe(NO3)3 + H2SO4 + NO + H2O.
Sau khi cân bằng, tổng hệ số cân bằng của phản ứng là
A. 25.
B. 23.
C. 19.
D. 21.
Đáp án: C
Giải thích:
FeS2 + 8HNO3 Fe(NO3)3 + 2H2SO4 + 5NO + 2H2O
→ Tổng hệ số sau cân bằng là: 19
Câu 23: Hòa tan hoàn toàn 2,4g kim loại Mg vào dung dịch HNO3 loãng, giả sử chỉ thu được V lít khí N2 duy nhất (đktc). Giá trị của V là
A. 6,72 lít.
B. 0,672lít.
C. 4,48 lít.
D. 0,448 lít
Đáp án: D
Giải thích:
Quá trình nhường electron:
Quá trình nhận electron:
Bảo toàn electron ta có:
Câu 24: Cho phản ứng:
3Fe(OH)2 + 10HNO3 → 3Fe(NO3)3 + NO + 8H2O.
Phản ứng này thuộc loại:
A. Phản ứng phân hủy.
B. Phản ứng thế.
C. Phản ứng oxi hóa - khử.
D. Phản ứng hóa hợp.
Đáp án: C
Giải thích:
Câu 25: Chọn phát biểu đúng?
A. Phản ứng phân hủy luôn có sự thay đổi số oxi hóa của một hoặc vài nguyên tố.
B. Trong phản ứng hóa hợp, số oxi hóa của các nguyên tố có thể thay đổi hoặc không thay đổi.
C. Trong phản ứng vô cơ, phản ứng thế luôn không có sự thay đổi số oxi hóa của các nguyên tố.
D. Trong phản ứng trao đổi, số oxi hóa của các nguyên tố luôn thay đổi.
Đáp án: B
Giải thích:
A sai. Phản ứng phân hủy, số oxi hóa của một hoặc vài nguyên tố có thể thay đổi hoặc không thay đổi.
B đúng.
C sai. Trong phản ứng vô cơ, phản ứng thế luôn có sự thay đổi số oxi hóa của các nguyên tố.
D sai. Trong phản ứng trao đổi, số oxi hóa của các nguyên tố không thay đổi.
Câu 26: Hoà tan 62,1 gam kim loại M trong dung dịch HNO3 loãng thu được 16,8 lít hỗn hợp khí X (ở đktc) gồm 2 khí không màu và không hóa nâu trong không khí. Tỉ khối hơi của X so với H2 là 17,2. Kim loại M là
A. Cu.
B. Al.
C. Fe.
D. Ag.
Đáp án: B
Giải thích:
Ta có:
Mà X gồm 2 khí không màu và không hóa nâu trong không khí
→ X gồm N2 và N2O
Gọi a là số electron mà kim loại M đã nhường.
Bảo toàn electron ta có:
Câu 27: Cho phản ứng sau: Fe + H2SO4 → FeSO4 + H2.
Phản ứng này thuộc loại phản ứng nào ?
A. Phản ứng hoá hợp
B. Phản ứng trao đổi
C. Phản ứng thế
D. Phản ứng phân huỷ
Đáp án: C
Giải thích:
Câu 28: Cho 10,8 gam hỗn hợp A gồm Mg và Fe tác dụng với 500 ml dung dịch AgNO3 sau khi phản ứng xảy ra hoàn toàn thu được dung dịch B và 46 gam chất rắn D. Cho dung dịch B tác dụng với dung dịch NaOH dư sau đó nung kết tủa ngoài không khí đến khối lượng không đổi thì được 12 gam chất rắn E. Tính nồng độ mol/l của dung dịch AgNO3.
A. 0,8M.
B. 0,5M.
C. 1M.
D. 1,25M.
Đáp án: A
Giải thích:
- Giả sử hỗn hợp A chỉ có Mg.
Nếu Mg phản ứng hết thì
mAg =gam
- Giả sử hỗn hợp A chỉ có Fe.
Nếu Fe phản ứng hết thì
mAg =gam
Mà chất rắn D có khối lượng là 46 gam
→ AgNO3 hết, kim loại Fe dư.
Xét dung dịch B
Bảo toàn electron
→ nAg = 2a + 2b (mol)
Chất rắn D gồm Fe dư, Ag
→ 46 = 10,8 – 24a – 56b + 108.(2a + 2b)(1)
12 gam chất rắn E gồm: Fe2O3 (b/2 mol) và MgO (a mol)
→ (2)
Từ (1) và (2) → a = b = 0,1 mol
→ nAg = 0,4 mol
![]()
Câu 29: Ở 4 phản ứng dưới đây, phản ứng nào không có sự thay đổi số oxi hoá của các nguyên tố ?
A. Sự nhiệt phân kali pemanganat.
B. Phản ứng của sắt với khí clo ở nhiệt độ cao.
C. Sự hoà tan nhôm vào dung dịch H2SO4 loãng.
D. Phản ứng của natri clorua và bạc nitrat trong dung dịch.
Đáp án: D
Giải thích:
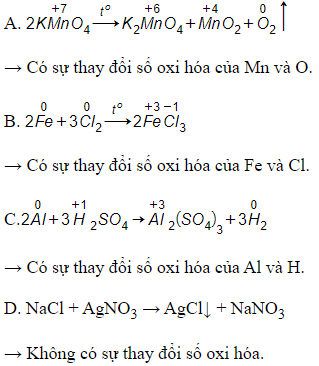
Câu 30: Đốt cháy x mol Fe bởi oxi một thời gian thu được 5,04 gam hỗn hợp A gồm các oxit sắt. Hòa tan hoàn toàn A trong dung dịch HNO3 thu được 0,035 mol hỗn hợp Y gồm NO và NO2. Tỷ khối hơi của Y đối với O2 là 1,1875. Giá trị của x là:
A. 0,065 mol.
B. 0,06 mol.
C. 0,075 mol.
D. 0,07 mol.
Đáp án: D
Giải thích:
Qui đổi hỗn hợp A thành:
Fe (x mol) và O (y mol).
Sử dụng phương pháp đường chéo:
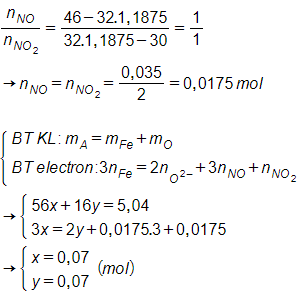
Các câu hỏi trắc nghiệm Hóa lớp 10 có đáp án, chọn lọc khác:
Trắc nghiệm Luyện tập: Phản ứng oxi hóa - khử có đáp án
Trắc nghiệm Thành phần nguyên tử có đáp án
Trắc nghiệm Hạt nhân nguyên tử - Nguyên tố hóa học - Đồng vị có đáp án
Xem thêm các chương trình khác:
- Trắc nghiệm Sinh học lớp 7 có đáp án
- Trắc nghiệm Toán lớp 7 có đáp án
- Trắc nghiệm Ngữ văn lớp 7 có đáp án
- Trắc nghiệm Sinh học 8 có đáp án
- Trắc nghiệm Toán lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn 8 có đáp án
- Trắc nghiệm Hóa học lớp 8 có đáp án
- Trắc nghiệm Địa Lí lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Tiếng Anh lớp 8 có đáp án
- Trắc nghiệm GDCD lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Lịch sử lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Vật Lí lớp 8 có đáp án
- Trắc nghiệm Công nghệ lớp 8 có đáp án
- Trắc nghiệm Tin học lớp 8 có đáp án
- Trắc nghiệm Sinh học lớp 9 có đáp án
- Trắc nghiệm Toán lớp 9 có đáp án
- Trắc nghiệm Ngữ văn 9 có đáp án
- Trắc nghiệm Hóa học lớp 9 có đáp án
- Trắc nghiệm Địa lí lớp 9 có đáp án
- Trắc nghiệm Tiếng Anh lớp 9 có đáp án
- Trắc nghiệm GDCD lớp 9 có đáp án
- Trắc nghiệm Lịch sử lớp 9 có đáp án
- Trắc nghiệm Vật lí lớp 9 có đáp án
- Trắc nghiệm Công nghệ lớp 9 có đáp án
- Trắc nghiệm Sinh học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Toán lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Hóa học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn lớp 11 có đáp án
- Trắc nghiệm Tiếng Anh lớp 11 có đáp án
- Trắc nghiệm Vật Lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Địa lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm GDCD lớp 11 có đáp án
- Trắc nghiệm Lịch sử lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Công nghệ lớp 11 có đáp án
- Trắc nghiệm Giáo dục quốc phòng - an ninh lớp 11 có đáp án
- Trắc nghiệm Tin học lớp 11 có đáp án
- Trắc nghiệm Toán lớp 12 có đáp án
- Trắc nghiệm Sinh học lớp 12 có đáp án
- Trắc nghiệm Hóa học lớp 12 có đáp án
- Trắc nghiệm Ngữ văn lớp 12 có đáp án
- Trắc nghiệm Tiếng Anh lớp 12 có đáp án
- Trắc nghiệm Địa lí lớp 12 có đáp án
- Trắc nghiệm Vật Lí lớp 12 có đáp án
- Trắc nghiệm Công nghệ lớp 12 có đáp án
- Trắc nghiệm Giáo dục công dân lớp 12 có đáp án
- Trắc nghiệm Lịch sử lớp 12 có đáp án
- Trắc nghiệm Giáo dục quốc phòng - an ninh lớp 12 có đáp án
