Trắc nghiệm Oxi - ozon có đáp án - Hóa học 10
Bộ 30 bài tập trắc nghiệm Hóa học lớp 10 Bài 29: Oxi - ozon có đáp án đầy đủ các mức độ giúp các em ôn trắc nghiệm Hóa học 10.
Trắc nghiệm Hóa học lớp 10 Bài 29: Oxi - ozon
Bài 1: Phát biểu nào sau đây không đúng?
A. Oxi là một chất khí không màu, không mùi, nặng hơn không khí
B. Oxi ít tan trong nước, oxi hóa lỏng khi bị nén ở áp suất thấp và nhiệt độ thấp
C. Oxi lỏng là một chất lỏng màu xanh nhạt, sôi ở -183oC.
D. Oxi có dạng thù hình là ozon (O3).
Đáp án: B
Giải thích:
A, C, D đúng
B sai vì oxi chỉ bị nén trong điều kiện nhiệt độ thấp và áp suất cao.
Bài 2: Sản xuất oxi từ không khí bằng cách
A. hoá lỏng không khí.
B. chưng cất không khí.
C. chưng cất phân đoạn không khí.
D. chưng cất phân đoạn không khi lỏng.
Đáp án: D
Giải thích:
Trong công nghiệp, người ta điều chế oxi bằng cách chưng cất phân đoạn không khí lỏng.
Bài 3: Trong phản ứng: 2H2O2 → 2H2O + O2
Phát biểu nào sau đây đúng khi nói về phân tử H2O2?
A. Là chất oxi hoá
B. Là chất khử
C. Vừa là chất oxi hoá, vừa là chất khử.
D. Không là chất oxi hoá, không là chất khử
Đáp án: C
Giải thích:
−1O+1e→−2O2−1O→0O2+2e
Vậy H2O2 vừa là chất oxi hóa vừa là chất khử.
Bài 4: Hiện tượng quan sát được khi sục khí ozon vào dung dịch kali iotua (KI)
A. Nếu nhúng giấy quỳ tím vào thì giấy quỳ chuyển sang màu xanh.
B. Nếu nhúng giấy tẩm hồ tinh bột vào thì chuyển sang màu xanh.
C. Có khí không màu, không mùi thoát ra.
D. Tất cả các hiện tượng trên.
Đáp án: D
Giải thích:
PTHH:
O3 + 2 KI + H2O → O2 ↑ + 2KOH + I2
A đúng vì dd thu được có KOH làm quỳ chuyển xanh
B đúng vì dung dịch thu được chứa I2 tạo với tinh bột hợp chất xanh tím
C đúng vì thoát ra O2 là khí không màu, không mùi
Bài 5: Trong các cách dưới đây, cách nào được dùng để điều chế oxi trong phòng thí nghiệm
A. Điện phân H2O.
B. Phân huỷ H2O2 với chất xúc tác là MnO2.
C. Điện phân CuSO4.
D. Chưng cất phân đoạn không khí lỏng.
Đáp án: B
Giải thích:
Trong phòng thí nghiệm, người ta có thể điều chế O2 bằng cách phân hủy H2O2 với xúc tác là MnO2:
2H2O2MnO2→2H2O+O2
Bài 6: Phản ứng không xảy ra là
A. 2Mg + O2 to→ 2MgO.
B. C2H5OH + 3O2 to→ 2CO2 + 3H2O.
C. 2Cl2 + 7O2 to→ 2Cl2O7.
D. 4P + 5O2 to→ 2P2O5.
Đáp án: C
Giải thích:
O2 không phản ứng trực tiếp với Cl2.
Bài 7: Khi cho 20 lít khí oxi đi qua máy tạo ozon, có 9% thể tích oxi chuyển thành ozon. Hỏi thể tích khí bị giảm bao nhiêu lít? (các điều kiện khác không thay đổi)
A. 2 lít
B. 0,9 lít
C. 0,18 lít
D. 0,6 lít
Đáp án: D
Giải thích:
PTHH: 3O2 → 2O3
→VO2(phan ung)=20.9
lít
Bài 8: Cho nổ hỗn hợp gồm 2ml hiđro và 6ml oxi trong bình kín. Hỏi sau khi nổ, đưa bình về nhiệt độ phòng, nếu giữ nguyên áp suất ban đầu, trong bình còn khí nào với thể tích bằng bao nhiêu?
A. 4ml O2
B. 2ml O2
C. 1ml H2
D. 5ml O2
Đáp án: D
Giải thích:
PTHH: 2H2 + O2 2H2O
Bđ: 2 6 ml
Pư: 2 → 1 → 2 ml
Sau: 0 5 ml
Bài 9: Đốt cháy chất X bằng O2 vừa đủ ta thu được hỗn hợp khí duy nhất là CO2 và SO2 có tỉ khối so với hiđro bằng 28,667 và tỉ khối hơi của X so với không khí nhỏ hơn 3. Xác định công thức phân tử của X.
A. CS2
B. CS
C. H2S
D. C3S2
Đáp án: A
Giải thích:
Gọi số mol CO2 là x, số mol SO2 là y
⇒ Trong hợp chất X số mol nguyên tử C là 1 và số mol nguyên tử S là 2
⇒ Công thức đơn giản là (CS2)nOz
Vì tỉ khối hơi của X so với không khí nhỏ hơn 3
⇒ n = 1, z = 0
Vậy công thức của X là CS2
Câu 10: Hai bình cầu có thể tích bằng nhau. Nạp oxi vào bình thứ nhất. Nạp oxi đã được ozon hóa vào bình thứ hai. Nhiệt độ và áp suất ở hai bình như nhau. Đặt hai bình trên hai đĩa cân thấy khối lượng của hai bình khác nhau 0,21 gam. Số gam ozon có trong bình oxi đã được ozon hóa là
A. 0,63
B. 0,65
C. 0,67
D. 0,69
Đáp án: A
Giải thích:
Khối lượng 2 bình khác nhau chính là chênh lệch khối lượng giữa x mol O3 bình 2 và x mol O2 ở bình 1
⇒ 0,21 = 48x – 32x ⇒ x = 0,013125 mol
⇒ Số gam O3 = 0,63g
Bài 11: Sau khi ozon hoá một thể tích oxi thì thấy thể tích giảm đi 5,00ml. Tính thể tích ozon đã được tạo thành và thể tích của oxi đã tham gia phản ứng để tạo thành ozon? Biết các thể tích nói trên đều đo ở cùng điều kiện .
A. 10; 15
B. 15; 10
C. 5; 15
D. 15; 5
Đáp án: A
Giải thích:
3O2 2O3
3 ml 2ml giảm 1ml
xml yml giảm 5ml
Vậy x = 15 ml và y =10 ml
Bài 12: Hỗn hợp khí A gồm O2 và O3, tỷ khối của hỗn hợp A đối với H2 là 19,2. Một mol hỗn hợp khí A có thể đốt cháy bao nhiêu mol khí CO (ở cùng điều kiện)
A. 2
B. 1,2
C. 2,4
D. 1
Đáp án: C
Giải thích:
MA = 38,4. Giả sử A có công thức trung bình là On, ta có:
16n = 38,4 ⇒ n = 2,4
A có công thức trung bình là O2,4
Ta có nA = 1 mol ⇒ nO = 2,4 mol
PT đốt cháy: CO + [O] CO2
2,4 mol 2,4 mol
Bài 13: Để thu được 6,72 lít O2 (đktc), cần phải nhiệt phân hoàn toàn bao nhiêu gam tinh thể KClO3.5H2O (khi có MnO2 xúc tác)?
A. 21,25 gam
B. 42,50 gam
C. 63,75 gam
D. 85,00 gam
Đáp án: B
Giải thích:
Phương trình hóa học
2KClO3 2KCl + 3O2
Bài 14: Thêm 3,0 gam MnO2 vào 197 gam hỗn hợp muối KCl và KClO3. Trộn kĩ và đun nóng hỗn hợp đến phản ứng hoàn toàn, thu được chất rắn cân nặng 152 gam. Hãy xác định thành phần phần trăm khối lượng của hỗn hợp muối đã dùng.
A.
B.
C.
D.
Đáp án: A
Giải thích:
Ta có khối lượng chất rắn giảm là khối lượng oxi thoát ra ngoài
Phương trình hóa học:
2KClO3 2KCl + 3O2
Bài 15: Khi nhiệt phân hoàn toàn 100 gam mỗi chất sau: KClO3 (xúc tác MnO2), KMnO4, KNO3 và AgNO3. Chất tạo ra lượng O2 lớn nhất là
A. KMnO4.
B. KNO3.
C. KClO3.
D. AgNO3.
Đáp án: C
Giải thích:
2KClO3 2KCl + 3O2
122,5............................48 (g)
100...............................39 (g)
2KMnO4 O2 + K2MnO4 + MnO2
158....................16 (g)
100....................10,1 (g)
2KNO3 O2 + 2KNO2
101.................16 (g)
100................15,84 (g)
2AgNO3 O2 + 2Ag + 2NO2
170.....................16 (g)
100.....................9,4 (g)
Vậy KClO3 tạo ra lượng O2 lớn nhất.
Bài 16: Hỗn hợp A gồm oxi và ozon có tỉ khối so với hiđro là 19,2. Hỗn hợp B gồm H2 và CO. Số mol hỗn hợp A cần để đốt cháy hoàn toàn 1 mol hỗn hợp B là
A. 2,08 mol.
B. 0,417 mol.
C. 2,40 mol.
D. 1,25 mol.
Đáp án: B
Giải thích:
MA = 19,2.2 = 38,4 g/mol
Quy hỗn hợp A là O
Sơ đồ phản ứng:
H2 + O → H2O; CO + O → CO2
mA = 16 gam
Bài 17: Cho 6,72 lít hỗn hợp gồm oxi và clo (đktc) phản ứng vừa đủ với hỗn hợp rắn gồm 0,1 mol Mg và 0,2 mol Al. Tính % về khối lượng của oxi trong hỗn hợp ban đầu
A. 33,33%
B. 66,67%
C. 18,4%
D. 81,8%
Đáp án: C
Giải thích:
Gọi số mol Cl2 và O2 lần lượt là x , y
⇒ x + y = 0,3 mol (1)
Ta có:
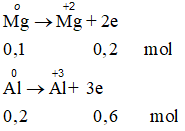
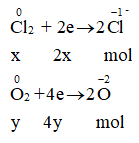
Bảo toàn e: cho = nhận
⇒ 2x + 4y = 0,8 (2)
Từ (1) và (2) → x = 0,2 và y = 0,1
Bài 18: Cho 5,6 lít hỗn hợp khí X gồm Cl2 và O2 (ở đktc) tác dụng vừa hết với 7,5 gam hỗn hợp Y gồm Mg và Al tạo ra 21,35 gam hỗn hợp oxit và muối clorua của hai kim loại. Thành phần % khối lượng của Mg và Al Trong Y lần lượt là
A. 66,67 % và 33,33 %
B. 33,33% và 66,67 %
C. 36 % và 64%
D. 64 % và 36%
Đáp án: D
Giải thích:
Bảo toàn khối lượng:
mX = mhh sau - mkim loại
= 21,35 – 7,5 = 13,85 g
Gọi số mol Cl2 và O2 lần lượt là x, y ta có:
x + y = 0,25 (1) và 71x + 32y = 13,85 (2)
Từ (1) và (2) → x = 0,15 và y = 0,1
Gọi số mol Mg, Al lần lượt là a,b ta có:
24a + 27b = 7,5 (3)
Mà
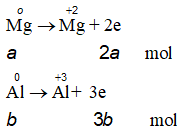
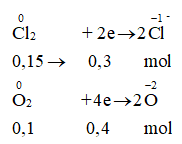
Ta có: ∑ne cho = ∑ne nhận
→ 2a + 3b = 0,7 mol (4)
Từ (3) và (4) → a = 0,2 và y = 0,1
Vậy % mMg = 64% và %mAl = 36 %
Bài 19: Trong bình kín đựng O2 ở to và P1 (atm), bật tia lửa điện, rồi đưa về to ban đầu thì áp suất là P2 (atm). Dẫn khí trong bình qua dung dịch KI dư thu được dung dịch X và 2,2848 lít khí (ở đktc). Dung dịch X phản ứng vừa đủ với 150ml dung dịch H2SO4 0,08M. Hiệu suất phản ứng ozon hóa và giá tị P2 so với P1 là
A. 80% và P2 = 0,9P1
B. 16,667% và P2 = 0,944P1
C. 16,86% và P2 = 0,5P1
D. Đáp án khác
Đáp án: B
Giải thích:
3O2 2O3 (1)
O3 + 2KI + H2O → 2KOH + O2 + I2 (2)
2KOH + H2SO4 → K2SO4 + 2H2O
sinh ra ở phản ứng (2) + dư ở (1) = 0,102
→ dư ở (1) = 0,09 mol
→ ban đầu = 0,09 + 0,018 = 0,108 mol
→ H = 16,667 %
Ta có
→ P2 = 0,944P1
Bài 20: Nhiệt phân hoàn toàn 22,26 gam hỗn hợp X gồm KClO3; KMnO4 và KCl thu được 3,36 lít khí O2 (đktc) và hỗn hợp Y gồm KCl; K2MnO4; MnO2 trong đó KCl chiếm 51,203% về khối lượng. Hòa tan hết hỗn hợp Y cần dùng dung dịch HCl 32,85% (đun nóng) thu được dung dịch Z. Nồng độ phần trăm của KCl có trong dung dịch Z là
A. 17,51%.
B. 21,88%.
C. 26,26%.
D. 24,02%
Đáp án: C
Giải thích:
Bảo toàn khối lượng:
mX = mY + → mY
= 22,26 – 0,15.32 = 17,46 gam
Gọi số mol KClO3, KMnO4, KCl lần lượt là : x, y, z
Ta có hệ phương trình :
K2MnO4 + 8HClđặc → 2KCl + MnCl2 + 2Cl2 + 4H2O
0,03 0,24 0,06 0,06
MnO2 + 4HClđặc → MnCl2 + Cl2 + 2H2O
0,03 0,12 0,03
∑mKCl = 8,94 + 0,06.74,5 = 13,41 gam
∑nHCl = 0,36 mol → mHCl = 13,14 gam
→ mdd HCl = 40 gam
→ mdd sau phản ứng = mY + mdd HCl –
= 17,46+40-6,39 = 51,07gam
→ C%KCl = = 26,26 %
Bài 21: Để thu được 3,36 lít O2 (đktc) cần phải nhiệt phân hoàn toàn một lượng KClO3. 5H2O là:
A. 21,25g
B. 12,25g
C. 31,875g
D. 63,75g
Đáp án: A
Giải thích:
Tính toán theo PTHH :
KClO3 . 5H2O → KCl + 1,5 O2 + 5 H2O
Theo PTHH ta có :
Bài 22: Để nhận biết O2 và O3 ta không thể dùng chất nào?
A. dung dịch KI trong hồ tinh bột
B. Ag
C. PbS (đen)
D. Đốt cháy cacbon
Đáp án: D
Giải thích:
Để nhận biết O2 và O3 ta không thể dùng cách đốt cháy cacbon.
Bài 23: Nguyên nhân nào sau đây làm cho nước ozon có thể bảo quản hoa quả lâu ngày:
A. ozon là một khí độc
B. ozon độc và dễ tan trong nước hơn oxi
C. Ozon có tính tảy màu
D. Ozon có tính chất oxi hóa mạnh, khả năng sát trùng cao và dễ tan trong nước hơn oxi.
Đáp án: D
Giải thích:
Ozon có tính chất oxi hóa mạnh, khả năng sát trùng cao và dễ tan trong nước hơn oxi.
Bài 24: Cấu hình electron lớp ngoài cùng của các nguyên tố nhóm oxi – lưu huỳnh là:
A. ns2np4
B. ns2np5
C. ns2np3
D. (n-1)d10ns2np4
Đáp án: A
Giải thích:
Nhóm oxi – lưu huỳnh hay nhóm VI A, có 6 electron ở lớp ngoài cùng.
Bài 25: Khí nào sau đây duy trì sự sống?
A. N2
B. Cl2
C. CO2
D. O2
Đáp án: D
Giải thích:
O2 Là khí duy trì sự sống, sự cháy . Động vật cần hô hấp để lấy oxi nuôi sống các tế bào.
Bài 26: Cho 6 gam một kim loại R có hóa trị không đổi khi tác dụng với oxi tạo ra 10 gam oxit. Kim loại R là
A. Fe
B. Zn
C. Ca
D. Mg
Đáp án: D
Giải thích:
Bảo toàn electron
→ n R . x = 0,5
với x = 1 → nR = 0,5 mol
→ MR = 12 (loại)
với x = 2 → nR = 0,25 mol
→ MR = 24 (chọn Mg)
với x = 3 → nR = 0,5 / 3 mol
→ MR = 36 (loại)
Kim loại là Mg
Bài 27: Oxi là nguyên tố phi kim hoạt động, có tính oxi hóa mạnh là do
A. oxi có độ âm điện lớn.
B. oxi có 6 electron lớp ngoài cùng
C. oxi có nhiều trong tự nhiên
D. oxi là chất khí
Đáp án: A
Giải thích:
Độ âm điện lớn → dễ nhận e để đạt cấu hình bền vững.
Bài 28: Chọn câu đúng:
A. Khí oxi và ozon là hai dạng thù hình của nguyên tố oxi
B. Oxi lỏng và khí oxi là hai dạng thù hình của nguyên tố oxi
C. Oxi lỏng và ozon là hai dạng thù hình của nguyên tố oxi
D. Cả A và C đều đúng
Đáp án: D
Giải thích:
Oxi lỏng hay oxi ở dạng khí thì đều là O2.
Bài 29: Oxi có thể thu được từ phản ứng nhiệt phân chất nào sau đây?
A. CaCO3
B. KMnO4
C. (NH4)2SO4
D. NaHCO3
Đáp án: B
Giải thích:
2KMnO4 K2MnO4 + MnO2 + O2
Bài 30: Phương pháp nào sau đây có thể dùng để điều chế O2 trong phòng thí nghiệm?
A. Điện phân nước
B. Phân hủy H2O2 với xúc tác MnO2
C. Điện phân dung dịch CuSO4
D. Chưng cất phân đoạn không khí lỏng
Đáp án: B
Giải thích:
2H2O2 → 2H2O + O2
Trong phòng thí nghiệm cần chọn phương pháp đơn giải dễ thực hiện
A, C, D đều có thể sinh ra khí O2 nhưng cần các dụng cụ máy móc phức tạp mới có thể điều chế được.
Các câu hỏi trắc nghiệm Hóa lớp 10 có đáp án, chọn lọc khác:
Trắc nghiệm Lưu huỳnh có đáp án
Trắc nghiệm Hidro sunfua – lưu huỳnh đioxit – lưu huỳnh trioxit có đáp án
Trắc nghiệm Axit sunfuric và muối sunfat có đáp án
Xem thêm các chương trình khác:
- Trắc nghiệm Sinh học lớp 7 có đáp án
- Trắc nghiệm Toán lớp 7 có đáp án
- Trắc nghiệm Ngữ văn lớp 7 có đáp án
- Trắc nghiệm Sinh học 8 có đáp án
- Trắc nghiệm Toán lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn 8 có đáp án
- Trắc nghiệm Hóa học lớp 8 có đáp án
- Trắc nghiệm Địa Lí lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Tiếng Anh lớp 8 có đáp án
- Trắc nghiệm GDCD lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Lịch sử lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Vật Lí lớp 8 có đáp án
- Trắc nghiệm Công nghệ lớp 8 có đáp án
- Trắc nghiệm Tin học lớp 8 có đáp án
- Trắc nghiệm Sinh học lớp 9 có đáp án
- Trắc nghiệm Toán lớp 9 có đáp án
- Trắc nghiệm Ngữ văn 9 có đáp án
- Trắc nghiệm Hóa học lớp 9 có đáp án
- Trắc nghiệm Địa lí lớp 9 có đáp án
- Trắc nghiệm Tiếng Anh lớp 9 có đáp án
- Trắc nghiệm GDCD lớp 9 có đáp án
- Trắc nghiệm Lịch sử lớp 9 có đáp án
- Trắc nghiệm Vật lí lớp 9 có đáp án
- Trắc nghiệm Công nghệ lớp 9 có đáp án
- Trắc nghiệm Sinh học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Toán lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Hóa học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn lớp 11 có đáp án
- Trắc nghiệm Tiếng Anh lớp 11 có đáp án
- Trắc nghiệm Vật Lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Địa lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm GDCD lớp 11 có đáp án
- Trắc nghiệm Lịch sử lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Công nghệ lớp 11 có đáp án
- Trắc nghiệm Giáo dục quốc phòng - an ninh lớp 11 có đáp án
- Trắc nghiệm Tin học lớp 11 có đáp án
- Trắc nghiệm Toán lớp 12 có đáp án
- Trắc nghiệm Sinh học lớp 12 có đáp án
- Trắc nghiệm Hóa học lớp 12 có đáp án
- Trắc nghiệm Ngữ văn lớp 12 có đáp án
- Trắc nghiệm Tiếng Anh lớp 12 có đáp án
- Trắc nghiệm Địa lí lớp 12 có đáp án
- Trắc nghiệm Vật Lí lớp 12 có đáp án
- Trắc nghiệm Công nghệ lớp 12 có đáp án
- Trắc nghiệm Giáo dục công dân lớp 12 có đáp án
- Trắc nghiệm Lịch sử lớp 12 có đáp án
- Trắc nghiệm Giáo dục quốc phòng - an ninh lớp 12 có đáp án
