Trắc nghiệm Hidro sunfua – lưu huỳnh đioxit – lưu huỳnh trioxit có đáp án - Hóa học lớp 10
Bộ 30 bài tập trắc nghiệm Hóa học lớp 10 Bài 32: Hidro sunfua – lưu huỳnh đioxit – lưu huỳnh trioxit có đáp án đầy đủ các mức độ giúp các em ôn trắc nghiệm Hóa học 10.
Trắc nghiệm Hóa 10 Bài 32: Hidro sunfua – lưu huỳnh đioxit – lưu huỳnh trioxit
Bài 1: Cho sơ đồ của phản ứng:
H2S + KMnO4 + H2SO4 → H2O + S + MnSO4 + K2SO4
Hệ số cân bằng (là các số nguyên, tối giản) của các chất tham gia phản ứng là dãy số nào trong các dãy sau?
A. 3, 2, 5
B. 5, 2, 3
C. 2, 2, 5
D. 5, 2, 4
Đáp án: B
Giải thích:
5H2S + 2KMnO4 + 3H2SO4 8H2O + 5S + 2MnSO4 + K2SO4
Bài 2: Cho sơ đồ phản ứng hóa học: H2S + O2 (dư) X + H2O. Chất X có thể là
A. SO2
B. S
C. SO3
D. S hoặc SO2
Đáp án: A
Giải thích:
Do O2 dư nên X là SO2, phương trình hóa học:
H2S + 3O2 (dư) 2SO2 + 2H2O
Bài 3: SO2 luôn thể hiện tính khử trong các phản ứng với
A. H2S, nước Br2, O2
B. dung dịch NaOH, O2, dung dịch KMnO4
C. dung dịch KOH, CaO, nước Br2
D. O2, nước Br2, dung dịch KMnO4
Đáp án: D
Giải thích:
A loại H2S vì H2S là chất có tính khử nên khi phản ứng với H2S thì SO2 thể hiện tính oxi hóa.
B loại NaOH vì phản ứng giữa SO2 và NaOH không phải là phản ứng oxi hóa khử
C loại KOH vì phản ứng giữa SO2 và KOH không phải là phản ứng oxi hóa khử
D đúng
Các phản ứng là:
2SO2 + O2 2SO3
SO2 + Br2 + 2H2O → 2HBr + H2SO4
5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4
Bài 4: Cho thí nghiệm được lắp như như hình vẽ sau:
Ống nghiệm 1 đựng HCl và Zn, ống nghiệm nằm ngang chứa bột S, ống nghiệm 2 chứa dung dịch Pb(NO3)2 . Phản ứng xảy ra trong ống nghiệm nằm ngang là:
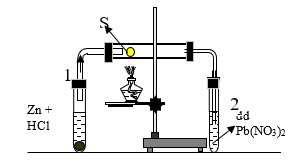
A. Zn + 2HCl → ZnCl2 + H2
B. H2 + S H2S
C. H2S + Pb(NO3)2 → PbS↓ + 2HNO3
D. 2HCl + Pb(NO3)2 → PbCl2↓ + 2HNO3
Đáp án: B
Giải thích:
- Ống nghiệm (1): Zn phản ứng với HCl sinh ra khí H2
Zn + 2HCl → ZnCl2 + H2
- Ống nghiệm nằm ngang: H2 bay ra gặp S (đun nóng) thì có phản ứng:
H2 + S H2S
- Ống nghiệm (2): Khí H2S bay ra khỏi ống nghiệm nằm ngang phản ứng với dung dịch Pb(NO3)2 tạo kết tủa màu đen
H2S + Pb(NO3)2 → PbS ↓ + 2HNO3
Bài 5: Hấp thụ hoàn toàn 2,24 lít khí SO2 (đkc) vào 100 ml dung dịch NaOH 1,5M. Muối thu được gồm:
A. Na2SO4
B. NaHSO3
C. Na2SO3
D. NaHSO3 và Na2SO3
Đáp án: D
Giải thích:
Ta có:
Nên muối thu được gồm: NaHSO3 và Na2SO3
Bài 6: Đốt cháy hoàn toàn 8,96 lít H2S (đktc) trong oxi dư, rồi dẫn tất cả sản phẩm vào 50 ml dung dịch NaOH 25% (D= 1,28). Nồng độ % muối trong dung dịch là
A. 47, 92%
B. 42, 96%
C. 42,69%
D. 24,97%
Đáp án: B
Giải thích:
; n NaOH = = 0,4 mol
2H2S + 3O2 → 2SO2 + 2H2O
Ta thấy: Tạo muối axit:
NaOH + SO2 → NaHSO3
Theo PTHH:
→ m dd sau = 50.1,28 + 0,4.64 + 0,4.18 = 96,8g
→
Bài 7: Từ 1,6 tấn quặng pirit sắt có chứa 60% FeS2 có thể sản xuất được x tấn axit H2SO4, biết hiệu suất của quá trình sản xuất là 80%. Giá trị của x là
A. 1,568.
B. 1,2544.
C. 2,090.
D. 1,865.
Đáp án: B
Giải thích:
Ta có: tấn
Sơ đồ sản xuất H2SO4:
FeS2 → 2SO2 → 2SO3 → 2H2SO4
120 tấn 2.98 = 196 tấn
0,96 tấn → 1,568 tấn
Do hiệu suất cả quá trình là 80% nên lượng H2SO4 thực tế thu được là:
1,568.80% = 1,2544 tấn
Bài 8: Đun nóng hỗn hợp gồm 5,6 gam bột sắt và 3,2 gam bột lưu huỳnh sau phản ứng thu được hỗn hợp A. Cho A tác dụng với dung dịch HCl dư thu được hỗn hợp khí B và m gam chất rắn C. Cho biết tỉ khối hơi của B so với hiđro là 13. Giá trị của m và thành phần phần trăm về thể tích của khí có phân tử khối nhỏ hơn trong B là
A. 0,8 gam; 25%
B. 0,8 gam; 75%
C. 2,4 gam; 25%
D. 2,4 gam; 75%
Đáp án: A
Giải thích:
nFe = 0,1 mol ; nS = 0,1 mol
(I) Fe + S FeS
Do A + HCl tạo hỗn hợp khí và thu được chất rắn C
⇒ Phản ứng không hoàn toàn A gồm Fe, FeS, S; khí B gồm H2 và H2S; chất rắn C là S
Đặt
Khi cho A tác dụng với HCl:
(II) Fe + 2HCl → FeCl2 + H2
(III) FeS + HCl → FeCl2 + H2S
Theo PTHH:
x + y = 0,1 (1)
mB = nB.MB → 2x + 34y = 0,1.26 (2)
Giải (1) và (2) được x = 0,025 và y = 0,075
nS pư = nFeS = = 0,075 mol
→ m = mS dư = 3,2 – 0,075.32 = 0,8 gam
Bài 9: Hòa tan hết 30,4 gam hỗn hợp X gồm Cu, CuS, Cu2S và S bằng dung dịch HNO3 dư thu được 20,16 lít khí NO duy nhất ở đktc và dung dịch Y. Thêm Ba(OH)2 dư vào Y được m gam kết tủa. Giá trị của m là
A. 110,96
B. 101,95
C. 110,95
D. 112,50
Đáp án: C
Giải thích:
Quy đổi hỗn hợp đã cho thành hỗn hợp Cu và S ta có sơ đồ:
- Khối lượng hỗn hợp ban đầu: 64x + 32y = 30,4 (1)
- Bảo toàn e: 2nCu + 6nS = 3nNO → 2x + 6y = 0,9.3 (2)
Giải (1) và (2) được x = 0,3 mol và y = 0,35 mol
→ m = 0,3.98 + 0,35.233 = 110,95 gam.
Câu 10: Thể tích dung dịch NaOH 2M tối thiểu để hấp thụ hết 5,6 lít khí SO2 (đkc) là:
A. 250 ml
B. 500 ml
C. 125 ml
D. 175 ml
Đáp án: C
Giải thích:
Vì NaOH tối thiểu cần dùng nên chỉ xảy ra phản ứng tạo NaHSO3 (tỉ lệ NaOH : SO2 =1:1)
NaOH + SO2 → NaHSO3
Vdd NaOH = 0,125 (lít) = 125 (ml)
Bài 11: Đốt cháy hoàn toàn 4,8 gam lưu huỳnh rồi cho sản phẩm cháy hấp thụ hoàn toàn vào 200 ml dung dịch Ba(OH)2 0,5M. Khối lượng kết tủa thu được là:
A. 10,85 gam
B. 16,725 gam
C. 21,7 gam
D. 32,55 gam
Đáp án: A
Giải thích:
nS = 0,15 (mol)
S + O2 SO2
Theo PTHH:
Ta có tỉ lệ:
→ Thu được 2 muối: BaSO3 và Ba(HSO3)2
SO2 + Ba(OH)2 → BaSO3 + H2O
x → x → x (mol)
2SO2 + Ba(OH)2 → Ba(HSO3)2
2y → y → y (mol)
Ta có hệ phương trình:
Giải hệ phương trình
Vậy
Bài 12: Hòa tan 8,36g oleum vào nước được dung dịch Y, để trung hòa dung dịch Y cần 200 ml dung dịch NaOH 1M. Công thức phân tử của oleum:
A. H2SO4. nSO3
B. H2SO4.3SO3
C. H2SO4. 5SO3
D. H2SO4. 4SO3
Đáp án: D
Giải thích:
Gọi công thức phân tử của oleum là: H2SO4.nSO3
H2SO4.nSO3 + nH2O → (n+1) H2SO4 (1)
← 0,1 mol
Dung dịch Y là dung dịch H2SO4
H2SO4 + 2 NaOH → Na2SO4 + 2H2O (2)
0,1 mol ← 0,2 mol
→ n = 4 → CTPT của oleum: H2SO4.4SO3
Bài 13: Cho sản phẩm khí thu được khi đốt cháy 17,92 lít khí H2S (đktc) sục vào 200 ml dung dịch NaOH 25% (d = 1,28g/ml). Tính nồng độ phần trăm muối trong dung dịch ?
A. 32,81%
B. 23,81%
C. 18,23%
D. 18,32%
Đáp án: A
Giải thích:
BTNT “S”:
m dd NaOH = 200.1,28 = 256 gam
→ mNaOH = 256.25% = 64 gam
→ nNaOH = 1,6 mol
→ Muối sinh ra là Na2SO3
2NaOH + SO2 → Na2SO3 + H2O
Theo PTHH:
Khối lượng dung dịch sau phản ứng :
m dd sau pư = 256 + 0,8.64 = 307,2 gam
Vậy
Bài 14: Dẫn V lít khí SO2 vào dung dịch nước Br2 dư thu được dung dịch X. Cho thêm dung dịch BaCl2 cho đến khi kết tủa đạt cực đại thì dừng lại. Lọc kết tủa và sấy khô thu được 1,165 gam chất rắn. V có giá trị là:
A. 0,112 lít.
B. 0,224 lít.
C. 0,336 lít.
D. 0,448 lít.
Đáp án: A
Giải thích:
Chất rắn sau khi sấy khô là
BaSO4:
SO2 + Br2 +2H2O → H2SO4 + 2HBr
BaCl2 + H2SO4 → BaSO4 ↓ + 2HCl
Mà
lít
Bài 15: Hấp thụ hoàn toàn 3,36 lít SO2 (đktc) vào 125 ml Ba(OH)2 1M thì thu được dung dịch X (coi thể tích dung dịch không đổi). Tính nồng độ chất tan trong dung dịch X
A. 0,4M
B. 0,2M.
C.0,6M
D. 0,8M
Đáp án: B
Giải thích:
sinh ra hỗn hợp muối BaSO3 và Ba(HSO3)2
Gọi số mol BaSO3 và Ba(HSO3)2 lần lượt là x,y
SO2 + Ba(OH)2 → BaSO3 + H2O
x x x
2SO2 + Ba(OH)2 → Ba(HSO3)2
2y y y
Bài 16: Hấp thụ hoàn toàn 2,688 lít khí SO2(đktc) vào 2,5 lít Ba(OH)2 nồng độ a M. Thu được 17,36 gam kết tủa. Giá trị của a là
A. 0,04.
B. 0,03.
C. 0,048.
D. 0,43.
Đáp án: A
Giải thích:
Bảo toàn nguyên tố S:
Bảo toàn nguyên tố Ba:
Bài 17: Biết V lít SO2 (đktc) tác dụng với 500ml dung dịch Ca(OH)2 0,5M tạo thành 12 gam kết tủa.Tìm giá trị lớn nhất của V?
A. 2,24.
B. 3,36.
C. 4,48.
D.8,96.
Đáp án: D
Giải thích:
Ta có:
Giá trị Vmax khi sinh ra hỗn hợp muối CaSO3 và Ca(HSO3)2
Bảo toàn nguyên tố Ca:
Bảo toàn nguyên tố S:
Bài 18: Dẫn V lít khí SO2 (ở đktc) qua 500 ml dung dịch Ca(OH)2 nồng độ x M , sau phản ứng thu được 3,6 gam kết tủa và dung dịch A. Đun nóng dung dịch A thu được thêm 2,4 gam kết tủa nữa. Giá trị của V và x là
A. 1,568 lít và 0,1 M
B. 22,4 lít và 0,05 M.
C. 0,1792 lít và 0,1 M
D. 1,12 lít và 0,2 M.
Đáp án: A
Giải thích:
Đun nóng dung dịch A thu được thêm kết tủa → có muối Ca(HSO3)2
Bảo toàn nguyên tố S:
Bảo toàn nguyên tố Ca:
mol
Bài 19: Cho m gam hỗn hợp bột Fe và S với tỉ lệ số mol sắt bằng 2 lần số mol lưu huỳnh, rồi đem nung (không có oxi), thu được hỗn hợp A. Hòa tan A bằng dung dịch HCl dư thu được 0,4 gam chất rắn B, dung dịch C và khí D. Sục khí D từ từ qua dung dịch CuCl2 dư thấy tạo ra 4,8 gam kết tủa đen. Tính hiệu suất phản ứng tạo thành hỗn hợp A?
A. 90%
B. 85%
C. 80%
D. 70%
Đáp án: C
Giải thích:
Sơ đồ bài toán:
nCuS = y = 0,05 mol
Chất rắn B là lưu huỳnh: nS = x – y = 0,0125 mol
→ x = 0,0625 mol
Hiệu suất của phản ứng: H = 80%
Bài 20: Đốt cháy hoàn toàn m gam FeS2 bằng một lượng O2 vừa đủ, thu được khí X. Hấp thụ hết X vào 1 lít dung dịch chứa Ba(OH)2 0,15M và KOH 0,1M, thu được dung dịch Y và 21,7 gam kết tủa. Cho Y vào dung dịch NaOH, thấy xuất hiện thêm kết tủa. Giá trị của m là
A. 23,2.
B. 18,0.
C. 12,6
D. 24,0.
Đáp án: B
Giải thích:
1 lít dung dịch chứa Ba(OH)2 0,15M và KOH 0,1M
Kết tủa là BaSO3 có
Vì cho dung dịch Y vào dung dịch NaOH, thấy xuất hiện thêm kết tủa, chứng tỏ trong dung dịch có muối của gốc HSO3- tức trường hợp này tạo 2 muối
SO2 + OH- → HSO3-
0,3 ←(0,4-0,1)
HSO3- + OH- dư → SO32- + H2O
0,1 0,1 ←0,1
Ba2+ + SO32- → BaSO3 ↓
0,1 ← 0,1
FeS2 → 2SO2
0,15 ← 0,3
Bài 21: Hãy chỉ ra câu trả lời sai về SO2
A. SO2 làm đỏ quỳ tím
B. SO2 làm mất màu dung dịch Br2
C. SO2 là chất khí, màu vàng
D. SO2 làm mất màu cánh hoa hồng
Đáp án: C
Giải thích:
SO2 là khí không màu.
Bài 22: Khí sunfurơ là chất có:
A. Tính khử mạnh.
B. Tính oxi hóa mạnh.
C. Vùa có tính oxi hóa vừa có tính khử.
D. Tính oxi hóa yếu.
Đáp án: C
Giải thích:
Khí sunfurơ là SO2.
Trong SO2, lưu huỳnh có số oxi hóa +4 là số oxi hóa trung gian nên SO2 vừa có tính oxi hóa và tính khử.
Bài 23: Hóa chất dùng để phân biệt CO2 và SO2 là
A. nước brom
B. Bari hiđroxit
C. phenolphtalein
D. dung dịch nước vôi trong.
Đáp án: A
Giải thích:
SO2 làm mất màu nước brom còn CO2 thì không
SO2 + Br2 + 2 H2O → 2 HBr + H2SO4
Bài 24: Cho các phản ứng sau:
a) 2SO2 + O2 2SO3
b) SO2 + 2H2S 3S + 2H2O
c) SO2 + Br2 + 2H2O → H2SO4 + 2HBr
d) SO2 + NaOH → NaHSO3
Các phản ứng mà SO2 có tính khử là:
A. a, c, d
B. a,b,d
C. a,c
D. a,d
Đáp án: C
Giải thích:
a/ 2SO2 + O2 2SO3
c/ SO2 + Br2 + 2H2O → H2SO4 + 2HBr
Trong hai phản ứng a và c, số oxi hóa của S trong SO2 tăng từ +4 lên +6 do đó SO2 thể hiện tính khử.
Bài 25: Cho khí H2S lội qua dung dịch CuSO4 thấy có kết tủa màu xám đen xuất hiện, chứng tỏ:
A. Có phản ứng oxi hóa - khử xảy ra
B. Có kết tủa CuS tạo thành, không tan trong axit mạnh
C. Axit sunfuhiđric mạnh hơn axit sunfuric
D. axit sunfuric mạnh hơn axit sunfuhiđric
Đáp án: B
Giải thích:
H2S + CuSO4 → CuS↓ + H2SO4
Bài 26: Dung dịch H2S để lâu ngày trong không khí thường có hiện tượng gì:
A. Chuyển thành màu nâu đỏ
B. Bị vẩn đục, màu vàng
C. Vẫn trong suốt không màu
D. Xuất hiện chất rắn màu đen.
Đáp án: B
Giải thích:
2H2S + O2 → 2S (↓ vàng) + 2H2O
Bài 27: Hấp thụ hoàn toàn 1,12 lít khí SO2 (đktc) vào 150 ml dung dịch NaOH 1M. Cô cạn dung dịch thu được
A. hỗn hợp hai muối NaHSO3, Na2SO3 và NaOH dư
B. Hỗn hợp 2 chất NaOH, Na2SO3
C. Hỗn hợp hai chất SO2 dư, NaOH
D. Hỗn hợp hai muối NaHSO3, Na2SO3
Đáp án: B
Giải thích:
= 0,05 mol, n NaOH = 0,15 mol
Vì > 2
→ chỉ tạo 1 muối là Na2SO3
SO2 + 2 NaOH → Na2SO3 + H2O
0,05 0,15 → 0,05
→ NaOH dư sau phản ứng
→ Dung dịch chứa 2 chất NaOH, Na2SO3
Bài 28: Cho V lít SO2 (đktc) tác dụng hết với dung dịch Br2 dư. Thêm tiếp vào dung dịch sau phản ứng BaCl2 dư thu được 2,33 gam kết tủa. Thể tích V là:
A. 0,112 lít
B. 1,12 lít
C. 0,224 lít
D. 2,24 lít
Đáp án: C
Giải thích:
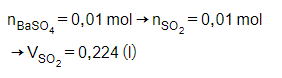
Bài 29: Sục một lượng khí SO2 vào dung dịch Ba(OH)2, thu được dung dịch B kết tủa C. Đun nóng dung dịch B lại thấy xuất hiện kết tủa. Dung dịch B tác dụng với Ba(OH)2 sinh ra được kết tủa. Thành phần của dung dịch B là:
A. BaSO3 và Ba(OH)2 dư
B. Ba(HSO3)2
C. Ba(OH)2
D. BaHSO3 và Ba(HSO3)2
Đáp án: B
Giải thích:
SO2 + Ba(OH)2 → BaSO3 ↓ + H2O
2SO2 + Ba(OH)2 → Ba(HSO3)2
Ba(HSO3)2 BaSO3↓ + SO2 + H2O
Ba(HSO3)2 + Ba(OH)2 → 2BaSO3↓ + 2H2O
Bài 30: Sục 2,24 lít khí H2S (đktc) vào dung dịch 0,2 mol Ba(OH)2 thì khối lượng muối tan thu được là:
A. 40,6 g
B. 33,8 g
C. 16,9 g
D. Kết quả khác
Đáp án: C
Giải thích:
→ Tỉ lệ : < 1
→ tạo muối BaS
H2S + Ba(OH)2 → BaS + 2H2O
0,1 0,2 → 0,1
→ m BaS = 0,1 . 169 = 16,9 g
Các câu hỏi trắc nghiệm Hóa lớp 10 có đáp án, chọn lọc khác:
Trắc nghiệm Axit sunfuric và muối sunfat có đáp án
Trắc nghiệm Luyện tập: Nhóm oxi – lưu huỳnh có đáp án
Trắc nghiệm Tốc độ phản ứng hóa học có đáp án
Trắc nghiệm Cân bằng hóa học có đáp án
Trắc nghiệm Luyện tập: Tốc độ phản ứng và cân bằng hóa học có đáp án
Xem thêm các chương trình khác:
- Trắc nghiệm Sinh học lớp 7 có đáp án
- Trắc nghiệm Toán lớp 7 có đáp án
- Trắc nghiệm Ngữ văn lớp 7 có đáp án
- Trắc nghiệm Sinh học 8 có đáp án
- Trắc nghiệm Toán lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn 8 có đáp án
- Trắc nghiệm Hóa học lớp 8 có đáp án
- Trắc nghiệm Địa Lí lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Tiếng Anh lớp 8 có đáp án
- Trắc nghiệm GDCD lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Lịch sử lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Vật Lí lớp 8 có đáp án
- Trắc nghiệm Công nghệ lớp 8 có đáp án
- Trắc nghiệm Tin học lớp 8 có đáp án
- Trắc nghiệm Sinh học lớp 9 có đáp án
- Trắc nghiệm Toán lớp 9 có đáp án
- Trắc nghiệm Ngữ văn 9 có đáp án
- Trắc nghiệm Hóa học lớp 9 có đáp án
- Trắc nghiệm Địa lí lớp 9 có đáp án
- Trắc nghiệm Tiếng Anh lớp 9 có đáp án
- Trắc nghiệm GDCD lớp 9 có đáp án
- Trắc nghiệm Lịch sử lớp 9 có đáp án
- Trắc nghiệm Vật lí lớp 9 có đáp án
- Trắc nghiệm Công nghệ lớp 9 có đáp án
- Trắc nghiệm Sinh học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Toán lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Hóa học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn lớp 11 có đáp án
- Trắc nghiệm Tiếng Anh lớp 11 có đáp án
- Trắc nghiệm Vật Lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Địa lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm GDCD lớp 11 có đáp án
- Trắc nghiệm Lịch sử lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Công nghệ lớp 11 có đáp án
- Trắc nghiệm Giáo dục quốc phòng - an ninh lớp 11 có đáp án
- Trắc nghiệm Tin học lớp 11 có đáp án
- Trắc nghiệm Toán lớp 12 có đáp án
- Trắc nghiệm Sinh học lớp 12 có đáp án
- Trắc nghiệm Hóa học lớp 12 có đáp án
- Trắc nghiệm Ngữ văn lớp 12 có đáp án
- Trắc nghiệm Tiếng Anh lớp 12 có đáp án
- Trắc nghiệm Địa lí lớp 12 có đáp án
- Trắc nghiệm Vật Lí lớp 12 có đáp án
- Trắc nghiệm Công nghệ lớp 12 có đáp án
- Trắc nghiệm Giáo dục công dân lớp 12 có đáp án
- Trắc nghiệm Lịch sử lớp 12 có đáp án
- Trắc nghiệm Giáo dục quốc phòng - an ninh lớp 12 có đáp án
