50 bài tập về điện phân (có đáp án 2025) và cách giải
Với cách giải bài toán đốt điện phân môn Hoá học lớp 12 gồm phương pháp giải chi tiết, bài tập minh họa có lời giải và bài tập tự luyện sẽ giúp học sinh biết cách làm bài toán điện phân lớp 12. Mời các bạn đón xem:
Các dạng bài toán điện phân và cách giải
A. Lý thuyết ngắn gọn
a/ Khái niệm : sự điện phân là quá trình oxi hóa – khử xảy ra trên bề mặt các điện cực, khi cho dòng điện một chiều đi qua dung dịch chất điện li hoặc chất điện li nóng chảy.
b/ Các quá trình oxi hóa – khử xảy ra ở điện cực :
- Tại catot (cực âm) : xảy ra quá trình khử (quá trình nhận e)

Ví dụ: điện phân dung dịch chứa các ion sau : Cu2+ , Fe2+, Fe3+ , Ag+ , H+ . Thứ tự điện phân sẽ xảy ra như sau :
Ag+ + 1e → Ag ;
Fe3+ + 1e → Fe2+ ;
Cu2+ + 2e → Cu ;
2H+ + 2e → H2 ;
Fe2+ + 2e → Fe
.....
2H2O + 2e → 2OH– + H2
→Tại anot (cực dương) : xảy ra quá trình oxi hóa (quá trình nhường e)
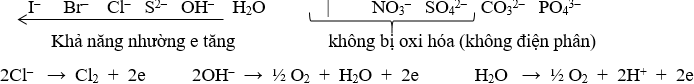
c/ Công thức Faraday : tính khối lượng chất thu được tại các điện cực
m=AItnF
ne=ItF
Trong đó :
m là khối lượng chất thu được ở điện cực (gam)
A là khối lượng mol nguyên tử thu được ở điện cực (gam).
n là số e mà nguyên tử hoặc ion đã cho hoặc nhận.
I là cường độ dòng điện (ampe)
t là thời gian điện phân (giây)
F là hằng số Faraday (F = 96500) / ne là số mol e
d/ Phương pháp điều chế :
- Điện phân nóng chảy : dùng điều chế kim loại mạnh IA , IIA , Al
- Điều chế kim loại nhóm IA : điện phân nóng chảy muối clorua hoặc hidroxit.
Ví dụ 1: Điều chế K bằng cách điện phân nóng chảy KCl
Catot ( – ) ← KCl → Anot (+)
K+ + e → K 2Cl– → Cl2 + 2e
Phương trình điều chế :
2KCl dpnc→ 2K + Cl2
Ví dụ 2: Điều chế Na bằng cách điện phân nóng chảy NaOH
Catot (–) ← NaOH → Anot (+)
Na+ + e → Na 2OH– → ½ O2 + H2O + 2e
Phương trình điều chế :
2NaOH dpnc→ 2Na + ½ O2 + H2O
Tổng quát:
2MOH
- Điều chế kim loại nhóm IIA : điện phân nóng chảy muối clorua
Ví dụ 3: Điều chế Mg bằng cách điện phân nóng chảy MgCl2
Catot (–) ← MgCl2 → Anot (+)
Mg2+ + 2e → Mg 2Cl– → Cl2 + 2e
Phương trình điều chế :
MgCl2 Mg + Cl2
Tổng quát :
- Điều chế Al : điện phân nóng chảy Al2O3
Catot (–) ← Al2O3 → Anot (+)
Al3+ + 3e → Al 2O2– → O2 + 4e
Phương trình điều chế:
2Al2O3 4Al + 3O2
- Điện phân dung dịch : dùng điều chế kim loại trung bình yếu (sau Al) bằng cách điện phân dung dịch muối của chúng.
Ví dụ 4: Điện phân dung dịch AgNO3 để điều chế kim loại Ag.
Catot ( – ) ← AgNO3 → Anot (+)
Ag+ , H2O NO3– , H2O
Ag+ + e → Ag H2O → 2H+ + ½ O2 + 2e
Phương trình điều chế :
2AgNO3 + H2O 2Ag + ½ O2 + 2HNO3
Ví dụ 5: điện phân dung dịch CuCl2 để điều chế Cu
Catot ( – ) ← CuCl2 → Anot (+)
Cu2+ , H2O Cl– , H2O
Cu2+ + 2e → Cu 2Cl– → Cl2 + 2e
Phương trình điều chế :
CuCl2 Cu + Cl2
Chú ý: Khi điện phân các dung dịch sau:
+ Hidroxit của kim loại hoạt động mạnh: KOH, NaOH, Ba(OH)2,..
+ Axit có oxi: HNO3, H2SO4, HClO4,…
+ Muối tạo bởi axit có oxi và bazơ kiềm: KNO3, Na2SO4,…
Thực tế là điện phân H2O sinh ra khí H2 (catot) và khí O2 (anot)
B. Phương pháp giải
Công thức Faraday:
Bước 1: Tính ne trao đổi:
Bước 2:Viết quá trình điện phân.
Bước 3: Tính lượng chất đã điện phân hoặc lượng chất thu được sau điện phân.
Chú ý:
Vkhí = Vkhí (anot) + Vkhí (catot)
mdung dịch giảm = mkim loại + mkhí thoát ra
mcatot = mkim loại (catot)
Chú ý: Nếu biết catot bắt đầu thoát khí → khí thoát ra ở cả hai điện cực. Khi đó nước bắt đầu điện phân ở catot.
2H2O + 2e → 2OH– + H2
C. Ví dụ minh họa
Ví dụ 1: Điện phân 100 ml dung dịch CuSO4 1M với điện cực trơ, cường độ dòng điện là 5A trong thời gian 25 phút 44 giây thì dừng lại. Khối lượng dung dịch giảm sau điện phân là
A. 2,88 gam.
B. 3,84 gam.
C. 2,56 gam.
D. 3,20 gam.
Lời giải chi tiết
Đổi 25 phút 44 giây = 25.60 + 44 = 1544 giây
Theo hệ quả của công thức Faraday:
Quá trình điện phân:
Ở catot (–): Cu2+ + 2e → Cu
0,08 → 0,04 mol
Ở anot (+): 2H2O → O2 + 4H+ + 4e
0,02 ← 0,08 mol
Ta có: mdung dịch giảm = mCu + m
→ mdung dịch giảm = 2,56 + 0,64 = 3,2 gam
Chọn D.
Ví dụ 2: Điện phân 200 ml dung dịch AgNO3 0,4M với điện cực trơ, I = 5A. Sau 19 phút 18 giây, khối lượng Ag thu được ở catot là
A. 7,56 gam.
B. 4,32 gam.
C. 8,64 gam.
D. 6,48 gam.
Lời giải chi tiết
Đổi 19 phút 18 giây = 19.60 + 18 = 1158 giây
Theo công thức Faraday:
→ mAg = 6,48 gam
Chọn D.
Ví dụ 3: Điện phân 100 ml dung dịch CuSO4 0,2M và AgNO3 0,1M với cường độ dòng điện I = 3,86A. Sau t giây, khối lượng kim loại bám trên catot là 1,72 gam. Giá trị của t là
A. 250.
B. 1000.
C. 500.
D. 750.
Lời giải chi tiết
Ở catot (–):
Ag+ + 1e → Ag (1)
Cu2+ + 2e → Cu (2)
Nếu Ag+ điện phân hết, Cu2+ chưa điện phân: mkim loại = mAg = 0,01.108 = 1,08 gam
Nếu Ag+ và Cu2+ đều điện phân hết: mkim loại = mAg + mCu = 0,01.108 + 0,02.64 = 2,36 gam
Ta thấy: 1,08 < 1,72 < 2,36 → Ag+ điện phân hết, Cu2+ điện phân một phần
Ta có: mCu = mkim loại – mAg = 1,72 – 1,08 = 0,64 gam
→ nCu = 0,01 mol
Theo (1) và (2): ne trao đổi = nAg + 2nCu = 0,01 + 2.0,01 = 0,03 mol
Chọn D.
D. Bài tập tự luyện
Câu 1: Điện phân 500 ml dung dịch CuSO4 0,1M (điện cực trơ) với cường độ dòng điện 10A, thời gian điện phân là 32 phút 10 giây. Tổng thể tích khí (đktc) sinh ra ở catot và anot là
A. 1,12 lít.
B. 0,56 lít.
C. 3,36 lít.
D. 2,24 lít.
Câu 2: Điện phân dung dịch chứa m gam hỗn hợp gồm Cu(NO3)2 và KCl bằng điện cực trơ, màng ngăn xốp với cường độ dòng điện không đổi. Sau thời gian t giây, ở anot thoát ra 2,688 lít hỗn hợp khí (đktc). Nếu thời gian điện phân là 2t giây, thể tích khí thoát ra ở anot gấp 3 lần thể tích khí thoát ra ở catot (đo cùng điều kiện), đồng thời khối lượng catot tang 18,56 gam. Giá trị của m là
A. 55,34.
B. 63,46.
C. 53,42.
D. 69,87.
Câu 3: Điện phân với điện cực trơ dung dịch chứa 0,2 mol Cu(NO3)2, cường độ dòng điện 2,68A, trong thời gian t giờ, thu được dung dịch X. Cho 14,4 gam bột Fe vào X, thu được khí NO (sản phẩm khử duy nhất của N+5) và 13,5 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn và hiệu suất của quá trình điện phân là 100%. Giá trị của t là
A. 1,00.
B. 1,20.
C. 0,50.
D. 0,25.
Câu 4: Điện phân nóng chảy muối MCln với điện cực trơ. Khi catot thu được 16 gam kim loại M thì ở anot thu được 5,6 lít khí Cl2 (đktc). Kim loại M là
A. Mg.
B. Fe.
C. Cu.
D. Ca.
Câu 5: Điện phân đến hết 0,2 mol Cu(NO3)2 trong dung dịch với điện cực trơ, thì sau điện phân khối lượng dung dịch đã giảm bao nhiêu gam?
A. 3,2 gam
B. 12,8 gam
C. 16,0 gam
D. 20,0 gam
Câu 6: Điện phân 500 ml dung dịch CuSO4 0,4M (điện cực trơ) cho đến khi ở catot thu được 9,6 gam kim loại thì thể tích khí (đktc) thu được ở anot là
A. 4,48 lít.
B. 2,24 lít.
C. 1,12 lít.
D. 1,68 lít.
Câu 7: Điện phân dung dịch hỗn hợp gồm 14,9 gam KCl và 28,2 gam Cu(NO3)2 (điện cực trơ, màng ngăn xốp) đến khi khối lượng dung dịch giảm 15,1 gam thì ngừng điện phân (giả thiết lượng nước bay hơi không đáng kể). Khối lượng kim loại thu được ở catot là
A. 15,1 gam.
B. 6,4 gam.
C. 7,68 gam.
D. 9,6 gam.
Câu 8: Điện phân 200 ml dung dịch CuSO4 với điện cực trơ bằng dòng điện một chiều I = 9,65A. Khi thể tích khí thoát ra ở cả hai điện cực đều là 1,12 lít (đktc) thì dừng điện phân. Khối lượng kim loại sinh ra ở catot và thời gian điện phân là
A. 3,2 gam và 2000s
B. 2,2 gam và 800s
C. 6,4 gam và 3600s
D. 5,4 gam và 800s
Câu 9: Điện phân dùng điện cực trơ dung dịch muối sunfat kim loại hóa trị II với cường độ dòng điện 3A. Sau 1930 giây thấy khối lượng catot tăng 1,95 gam. Muối sunfat đã điện phân là
A. CuSO4
B. NiSO4
C. MgSO4
D. ZnSO4
Câu 10: Điện phân có màng ngăn 500 ml dung dịch chứa hỗn hợp gồm CuCl2 0,1M và NaCl 0,5M (điện cực trơ, hiệu suất 100%) với cường độ dòng điện 5A trong 3860 giây. Dung dịch thu được sau điện phân có khả năng hòa tan m gam Al. Giá trị lớn nhất của m là
A. 4,05
B. 2,70
C. 1,35
D. 5,40
ĐÁP ÁN
|
Câu 1 |
Câu 2 |
Câu 3 |
Câu 4 |
Câu 5 |
Câu 6 |
Câu 7 |
Câu 8 |
Câu 9 |
Câu 10 |
|
D |
B |
A |
C |
C |
D |
C |
A |
D |
B |
Xem thêm các dạng bài tập và công thức Hoá học lớp 12 hay, chi tiết khác:
Trắc nghiệm lý thuyết Chương 6 Kim loại kiềm, kiềm thổ, nhôm có lời giải
Bài tập xác định kim loại và cách giải
Các dạng toán cho hỗn hợp kim loại kiềm, kim loại kiềm thổ, nhôm tác dụng với nước và cách giải
Các dạng toán CO2, SO2 tác dụng với dung dịch kiềm và cách giải
Xem thêm các chương trình khác:
- Giải sgk Toán 12 (sách mới) | Giải bài tập Toán 12 Tập 1, Tập 2
- Các dạng bài tập Toán lớp 12
- Lý thuyết Toán 12
- Chuyên đề Toán lớp 12 mới nhất
- Bài tập Toán lớp 12 mới nhất
- Giáo án Toán lớp 12 mới nhất
- Tóm tắt tác phẩm Ngữ văn 12
- Soạn văn 12 (hay nhất) | Để học tốt Ngữ văn 12 (sách mới)
- Soạn văn 12 (ngắn nhất)
- Tác giả tác phẩm Ngữ văn lớp 12
- Văn mẫu lớp 12
- Giải sgk Sinh học 12 (sách mới) | Giải bài tập Sinh học 12
- Lý thuyết Sinh học 12 | Kiến thức trọng tâm Sinh 12
- Giải sgk Địa Lí 12 (sách mới) | Giải bài tập Địa lí 12
- Lý thuyết Địa Lí 12
- Giải Tập bản đồ Địa Lí 12
- Giải sgk Vật Lí 12 (sách mới) | Giải bài tập Vật lí 12
- Giải sbt Vật Lí 12
- Lý thuyết Vật Lí 12
- Các dạng bài tập Vật lí lớp 12
- Giáo án Vật lí lớp 12 mới nhất
- Giải sgk Lịch sử 12 (sách mới) | Giải bài tập Lịch sử 12
- Giải Tập bản đồ Lịch sử 12
- Lý thuyết Lịch sử 12
- Giải sgk Giáo dục công dân 12
- Lý thuyết Giáo dục công dân 12
- Giải sgk Giáo dục quốc phòng - an ninh 12 (sách mới) | Giải bài tập GDQP 12
- Lý thuyết Giáo dục quốc phòng 12 | Kiến thức trọng tâm GDQP 12
- Lý thuyết Tin học 12
- Lý thuyết Công nghệ 12
