Công thức tính số mol OH- trong bài toán thủy phân peptit hay nhất (có đáp án 2024) – Hoá học 12
Với công thức tính số mol OH- trong bài toán thủy phân peptit Hoá học lớp 12 chi tiết nhất giúp học sinh dễ dàng nhớ toàn bộ các công thức tính số mol OH- trong bài toán thủy phân peptit từ đó biết cách làm bài tập Hoá học 12. Mời các bạn đón xem:
Công thức tính số mol OH- trong bài toán thủy phân peptit hay nhất – Hoá học lớp 12
Việc viết phương trình và tính theo phương trình bài toán thủy phân peptit rất mất thời gian khi giải trắc nghiệm. Vậy có cách nào để tính nhanh bài toán thủy phân peptit? Bài viết dưới đây sẽ giúp em hiểu rõ vấn đề này.
1. Công thức tính
– Phương trình thủy phân hoàn toàn peptit trong môi trường kiềm
n–peptit + (n – 1 + b)NaOH → n muối của ∝–amino axit + bH2O
Trong đó: b là tổng số nhóm – COOH còn tự do trong peptit (các nhóm –COOH không tạo liên kết peptit)
Ví dụ:
Gly–Glu–Gly + 4NaOH → 2H2N–CH2–COONa + NaOOC–(CH2)2–CH(NH2)–COONa + 2H2O
– Tỉ lệ mol:
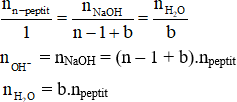
– Định luật bảo toàn khối lượng:
mpeptit + mNaOH = mmuối + m
– Bảo toàn gốc ∝–amino axit:
n một muối ∝–amino axit = (số lượng nhóm ∝–amino axit đó có mặt trong n–peptit).npepetit
– Công thức tính phân tử khối của n–peptit
Ví dụ: Đun nóng m gam hỗn hợp gồm a mol tetrapeptit mạch hở X và 2a mol tripeptit mạch hở Y với 600 ml dung dich NaOH 1M vừa đủ. Sau khi các phản ứng kết thúc, cô cạn dung dịch thu được 72,48 gam muối khan của các amino axit đều có một nhóm –COOH và một nhóm –NH2 trong phân tử. Giá trị của m là:
A. 51,72.
B. 54,30.
C. 66,00.
D. 44,48.
Hướng dẫn giải
Phương trình phản ứng
X + 4NaOH → 4Muối + H2O
a 4a a
Y + 3NaOH → 3Muối + H2O
2a 6a 2a
Ta có:
nNaOH = 4a + 2.3a = 10a = 0,6
→ a = 0,06 mol
n = a + 2a = 3a = 3.0,06 = 0,18 mol
Áp dụng định luật bảo toàn khối lượng:
mpeptit + mNaOH = mmuối + m
m + 0,6.40 = 72,48 + 0,18.18
→ m= 51,72 gam
→ Đáp án A
2. Kiến thức mở rộng
– Thủy phân hoàn toàn peptit trong môi trường trung tính (xúc tác enzim)
n–peptit X + (n–1)H2O n–amino axit
Ví dụ:
Gly–Gly–Gly + 2H2O → 3H2N–CH2–COOH
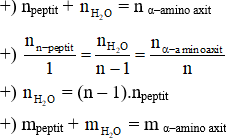
– Thủy phân hoàn toàn peptit trong môi trường axit
n–peptit+ (n – 1)H2O + aHCl → nmuối của ∝–amino axit
Trong đó:
a là số nguyên tử N trong peptit
Ví dụ:
Gly–Gly–Lys + 2H2O + 4HCl → 2ClH3N–CH2–COOH + ClH3N–(CH2)4–CH(NH3Cl)–COOH
– Tỉ lệ mol:
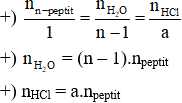
– Định luật bảo toàn khối lượng:
mpeptit + m + mHCl = mmuối
– Bảo toàn gốc ∝–amino axit:
n một muối ∝–amino axit = (số lượng nhóm ∝–amino axit đó có mặt trong n–peptit).npepetit
3. Bài tập minh họa
Câu 1: Thủy phân hoàn toàn 32,55 gam tripeptit mạch hở (Ala–Gly–Ala) bằng dung dịch NaOH (vừa đủ), sau phản ứng thu được dung dịch X. Cô cạn X thu được m gam muối khan. Giá trị m là:
A. 47,85 gam
B. 42,45 gam
C. 35,85 gam
D. 44,45 gam
Hướng dẫn giải
nAla–Gly–Ala = 0,15 mol. Vì Glyxin và Alanin đều chứa 1 nhóm –COOH trong phân tử nên ta có:
nNaOH = 3. nAla–Gly–Ala = 3.0,15 = 0,45 mol
n = 1. nAla–Gly–Ala = 0,15 mol
Áp dụng định luật bảo toàn khối lượng:
mpeptit + mNaOH = mmuối + m
32,55 + 0,45.40 = mmuối + 0,15.18
→ mmuối = 47,85 gam.
→ Đáp án A
Câu 2: Thủy phân hoàn toàn 24,6 gam một peptit X chỉ được tạo bởi từ một amino axit thu được 30 gam gly. X thuộc loại
A. đipeptit
B. tripeptit
C. tetrapeptit
D. pentapeptit
Hướng dẫn giải
Phương trình phản ứng
Peptit X + (n – 1)H2O → ngly
Áp dụng định luật bảo toàn khối lượng:
mpeptit + m = m α–amino axit
→ 24,6 + = 30
→ m = 5,4 gam
→ n = 0,3 mol
ngly = 0,4 mol
Ta có tỉ lệ
→ n = 4
→ X là tetrapeptit (gly–gly–gly–gly)
→ Đáp án C
Xem thêm các dạng bài tập và công thức Hoá học lớp 12 hay, chi tiết khác:
Công thức tính số mắt xích (hệ số polime hóa) polime hay nhất
Công thức tính lượng chất thu được ở điện cực hay nhất
Công thức tính bài toán nhiệt nhôm hay nhất
Công thức tính nhanh số mol H+ khi cho từ từ axit vào muối AlO2 (muối aluminat) hay nhất
Xem thêm các chương trình khác:
- Giải sgk Toán 12 (sách mới) | Giải bài tập Toán 12 Tập 1, Tập 2
- Các dạng bài tập Toán lớp 12
- Lý thuyết Toán 12
- Chuyên đề Toán lớp 12 mới nhất
- Bài tập Toán lớp 12 mới nhất
- Giáo án Toán lớp 12 mới nhất
- Tóm tắt tác phẩm Ngữ văn 12
- Soạn văn 12 (hay nhất) | Để học tốt Ngữ văn 12 (sách mới)
- Soạn văn 12 (ngắn nhất)
- Tác giả tác phẩm Ngữ văn lớp 12
- Văn mẫu lớp 12
- Giải sgk Sinh học 12 (sách mới) | Giải bài tập Sinh học 12
- Lý thuyết Sinh học 12 | Kiến thức trọng tâm Sinh 12
- Giải sgk Địa Lí 12 (sách mới) | Giải bài tập Địa lí 12
- Lý thuyết Địa Lí 12
- Giải Tập bản đồ Địa Lí 12
- Giải sgk Vật Lí 12 (sách mới) | Giải bài tập Vật lí 12
- Giải sbt Vật Lí 12
- Lý thuyết Vật Lí 12
- Các dạng bài tập Vật lí lớp 12
- Giáo án Vật lí lớp 12 mới nhất
- Giải sgk Lịch sử 12 (sách mới) | Giải bài tập Lịch sử 12
- Giải Tập bản đồ Lịch sử 12
- Lý thuyết Lịch sử 12
- Giải sgk Giáo dục công dân 12
- Lý thuyết Giáo dục công dân 12
- Giải sgk Giáo dục quốc phòng - an ninh 12 (sách mới) | Giải bài tập GDQP 12
- Lý thuyết Giáo dục quốc phòng 12 | Kiến thức trọng tâm GDQP 12
- Lý thuyết Tin học 12
- Lý thuyết Công nghệ 12
