50 bài tập về sắt và hợp chất của sắt tác dụng với HNO3 hoặc H2SO4 đặc (có đáp án 2024) – Hoá học 12
Với cách giải các dạng bài tập về sắt và hợp chất của sắt tác dụng với HNO3 hoặc H2SO4 đặc môn Hoá học lớp 12 gồm phương pháp giải chi tiết, bài tập minh họa có lời giải và bài tập tự luyện sẽ giúp học sinh biết cách làm bài tập về sắt và hợp chất của sắt tác dụng với HNO3 hoặc H2SO4 đặc lớp 12. Mời các bạn đón xem:
Các dạng bài tập về sắt và hợp chất của sắt tác dụng với HNO3 hoặc H2SO4 đặc hay nhất – Hoá học lớp 12
A. Lý thuyết trọng tâm
- Fe thụ động với H2SO4 đặc nguội và HNO3 đặc nguội → có thể dùng thùng làm bằng Fe chuyên chở axit HNO3 đặc nguội và H2SO4 đặc nguội.
- Với dung dịch HNO3 loãng: tạo muối sắt (III) + NO + H2O
Fe + 4HNO3(loãng) → Fe(NO3)3 + NO + 2H2O
- Với dung dịch HNO3 đậm đặc: tạo muối muối sắt (III) + NO2 + H2O
Fe + 6HNO3 → Fe(NO3)3 + 3NO2 + 3H2O
- Với dung dịch H2SO4 đậm đặc, nóng: tạo muối sắt (III) + SO2 + H2O
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O
(**) Chú ý: Sản phẩm sinh ra trong phản ứng của Fe với HNO3 hoặc H2SO4 đậm đặc là muối sắt (III), nhưng nếu sau phản ứng có Fe dư hoặc có Cu thì tiếp tục xảy ra phản ứng:
2Fe3+ + Fe → 3Fe2+
hoặc 2Fe3+ + Cu → 2Fe2+ + Cu2+
B. Phương pháp giải
Phương pháp giải các bài tập dạng này chủ yếu là sử dụng định luật bảo toàn electron. Ngoài ra có thể sử dụng định luật bảo toàn khối lượng, bảo toàn nguyên tố, bảo toàn điện tích, phương pháp đường chéo và tính toán theo phương trình phản ứng.
Fe khi tác dụng với các chất oxi hóa mạnh như dung dịch HNO3, H2SO4 đặc nóng, nếu kim loại dư thì muối sắt tạo thành trong dung dịch là muối sắt (II).
C. Ví dụ minh họa
Ví dụ 1: Cho a gam Fe tác dụng với dung dịch HNO3 thu được 2,24 lít khí NO (sản phẩm khử duy nhất, ở đktc), dung dịch X và còn dư 5,6 gam Fe. Cô cạn X thu được b gam muối khan. Giá trị của a, b lần lượt là
A. 14,0; 27,0.
B. 8,4; 27,0.
C. 14,0; 36,3.
D. 11,2; 27,0.
Lời giải chi tiết
Do sau phản ứng còn dư Fe nên muối thu được là muối sắt (II)
Quá trình cho nhận electron:
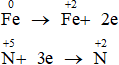
Bảo toàn electron: 2nFe phản ứng = 3nNO
Ta có: a = mFe phản ứng + mFe dư = 0,15.56 + 5,6 = 14 gam
Bảo toàn nguyên tố:
Chọn A.
Ví dụ 2: Cho a gam Fe vào 100 ml dung dịch hỗn hợp gồm HNO3 0,8M và Cu(NO3)2 1M. Sau khi các phản ứng xảy ra hoàn toàn, thu được 0,92a gam hỗn hợp kim loại và khí NO (sản phẩm khử duy nhất của N+5). Giá trị của a là
A. 8,4.
B. 11,0.
C. 11,2.
D. 5,6.
Lời giải chi tiết
Gọi số mol của Fe phản ứng là x mol
Quá trình cho nhận electron:
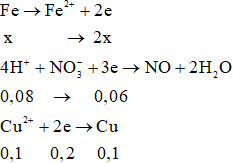
Bảo toàn electron: 2x = 0,06 + 0,2
→ x = 0,13
Ta có: mgiảm = a – 0,92a = 0,08a gam
Lại có mgiảm = mFe phản ứng – mCu = 0,13.56 – 0,1.64 = 0,88 gam
→ 0,08a = 0,88
→ a = 11
Chọn B.
Ví dụ 3: Cho m gam bột Fe vào dung dịch HNO3 lấy dư, ta được hỗn hợp gồm hai khí NO2 và NO có thể tích 8,96 lít (đktc) và tỉ khối đối với O2 bằng 1,3125. Thành phần phần trăm theo thể tích của NO, NO2 và khối lượng m của Fe đã dùng là
A. 25% và 75%; 1,12 gam.
B. 25% và 75%; 11,2 gam.
C. 35% và 65%; 11,2 gam.
D. 45% và 55%; 1,12 gam.
Lời giải chi tiết
Đặt số mol của NO2 và NO là x và y
Áp dụng định luật bảo toàn electron cho các chất khử và oxi hóa ta có:
Chọn B.
D. Bài tập tự luyện
Câu 1: Cho m gam Fe vào dung dịch chứa 1,38 mol HNO3, đun nóng đến kết thúc phản ứng còn 0,75m gam chất rắn không tan và có 0,38 mol hỗn hợp NO, NO2 (không còn sản phẩm khử khác) thoát ra ở đktc. Giá trị của m là
A. 70.
B. 56.
C. 84.
D. 112.
Câu 2: Cho 8,4 gam Fe vào dung dịch HNO3 loãng. Sau khi phản ứng xảy ra hoàn toàn thu được 2,688 lít khí NO (đktc, là sản phẩm khử duy nhất) và dung dịch A. Khối lượng Fe(NO3)3 trong dung dịch A là
A. 14,95 gam.
B. 21,95 gam.
C. 16,54 gam.
D. 14,52 gam.
Câu 3: Cho 27,75 gam hỗn hợp A gồm Fe, Fe3O4 tác dụng với 300 ml dung dịch HNO3 aM. Sau khi phản ứng xảy ra hoàn toàn thu được 3,36 lít khí NO, là sản phẩm khử duy nhất (đktc), dung dịch B và 2,19 gam kim loại chưa tan. Giá trị của a là
A. 3,2.
B. 1,2.
C. 2,4.
D. 1,6.
Câu 4: Hòa tan hoàn toàn 12 gam hỗn hợp Fe, Cu (tỉ lệ mol 1:1) bằng axit HNO3, thu được V lít (đktc) hỗn hợp khí X (gồm NO và NO2) và dung dịch Y (chỉ chứa hai muối và axit dư). Tỉ khối của X đối với H2 bằng 19. Giá trị của V là
A. 2,24 lít
B. 4,48 lít
C. 5,60 lít
D. 3,36 lít
Câu 5: Cho 12 gam hỗn hợp hai kim loại Fe, Cu tác dụng vừa đủ với dung dịch HNO3 63%. Sau phản ứng thu được dung dịch A và 11,2 lít khi NO2 duy nhất (đktc). Nồng độ % các chất có trong dung dịch A là
A. 33,66% và 28,48%.
B. 27,19% và 21,12%.
C. 27,19% và 72,18%.
D. 78,88% và 21,12%.
Câu 6: Hòa tan hoàn toàn 11,2 gam Fe vào HNO3 dư, thu được dung dịch A và 6,72 lít hỗn hợp khí B gồm NO và một khí X, với tỉ lệ thể tích là 1:1. Khí X là
A. NO2.
B. N2.
C. N2O.
D. NO.
Câu 7: Cho hỗn hợp gồm 1,12 gam Fe và 1,92 gam Cu vào 400 ml dung dịch chứa hỗn hợp gồm H2SO4 0,5M và NaNO3 0,2M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và khí NO (sản phẩm khử duy nhất). Cho V ml dung dịch NaOH 1M vào dung dịch X thì khối lượng kết tủa thu được là lớn nhất. Giá trị tối thiểu của V là
A. 240.
B. 120.
C. 360.
D. 400.
Câu 8: Cho m gam Fe vào dung dịch chứa đồng thời H2SO4 và HNO3 thu được dung dịch X và 4,48 lít NO (duy nhất). Thêm tiếp H2SO4 vào X thì lại thu được thêm 1,792 lít khí NO duy nhất nữa và dung dịch Y. Dung dịch Y hòa tan vừa hết 8,32 gam Cu không có khí bay ra (các khí đo ở đktc). Khối lượng của Fe đã cho vào là
A. 11,2 gam.
B. 16,24 gam.
C. 16,8 gam.
D. 9,6 gam.
Câu 9: Cho m gam bột Fe vào 800 ml dung dịch hỗn hợp gồm AgNO3 0,2M và HNO3 0,25M. Sau khi các phản ứng xảy ra hoàn toàn thu được 1,4m gam hỗn hợp kim loại và V lít khí NO (duy nhất, ở đktc). Giá trị của m và V lần lượt là
A. 21,50 và 1,12
B. 25,00 và 2,24
C. 8,60 và 1,12
D. 28,73 và 2,24
Câu 10: Hòa tan hoàn toàn một lượng hỗn hợp X gồm Fe3O4 và FeS2 trong 63 gam HNO3, thu được 1,568 lít NO2 (đktc). Dung dịch thu được cho tác dụng vừa đủ với 200 ml dung dịch NaOH 2M, lọc kết tủa đem đến khối lượng không đổi thu được 9,76 gam chất rắn. Nồng độ % của dung dịch HNO3 có giá trị là
A. 47,2%
B. 46,2%
C. 46,6%
D. 44,2%
ĐÁP ÁN
|
Câu 1 |
Câu 2 |
Câu 3 |
Câu 4 |
Câu 5 |
Câu 6 |
Câu 7 |
Câu 8 |
Câu 9 |
Câu 10 |
|
D |
D |
A |
C |
B |
A |
C |
B |
A |
B |
Xem thêm các dạng bài tập và công thức Hoá học lớp 12 hay, chi tiết khác:
Cách xác định công thức oxit sắt, hợp chất của sắt hay nhất
Các dạng bài toán quy đổi và cách giải
Bài tập tổng hợp về Cu, Zn, Cr, Sn, Pb và cách giải
Trắc nghiệm lý thuyết Chương 8 Phân biệt một số hợp chất vô cơ có lời giải
Trắc nghiệm lý thuyết Chương 9 Hóa học và vấn đề Phát triển kinh tế, xã hội, môi trường có lời giải
Xem thêm các chương trình khác:
- Giải sgk Toán 12 (sách mới) | Giải bài tập Toán 12 Tập 1, Tập 2
- Các dạng bài tập Toán lớp 12
- Lý thuyết Toán 12
- Chuyên đề Toán lớp 12 mới nhất
- Bài tập Toán lớp 12 mới nhất
- Giáo án Toán lớp 12 mới nhất
- Tóm tắt tác phẩm Ngữ văn 12
- Soạn văn 12 (hay nhất) | Để học tốt Ngữ văn 12 (sách mới)
- Soạn văn 12 (ngắn nhất)
- Tác giả tác phẩm Ngữ văn lớp 12
- Văn mẫu lớp 12
- Giải sgk Sinh học 12 (sách mới) | Giải bài tập Sinh học 12
- Lý thuyết Sinh học 12 | Kiến thức trọng tâm Sinh 12
- Giải sgk Địa Lí 12 (sách mới) | Giải bài tập Địa lí 12
- Lý thuyết Địa Lí 12
- Giải Tập bản đồ Địa Lí 12
- Giải sgk Vật Lí 12 (sách mới) | Giải bài tập Vật lí 12
- Giải sbt Vật Lí 12
- Lý thuyết Vật Lí 12
- Các dạng bài tập Vật lí lớp 12
- Giáo án Vật lí lớp 12 mới nhất
- Giải sgk Lịch sử 12 (sách mới) | Giải bài tập Lịch sử 12
- Giải Tập bản đồ Lịch sử 12
- Lý thuyết Lịch sử 12
- Giải sgk Giáo dục công dân 12
- Lý thuyết Giáo dục công dân 12
- Giải sgk Giáo dục quốc phòng - an ninh 12 (sách mới) | Giải bài tập GDQP 12
- Lý thuyết Giáo dục quốc phòng 12 | Kiến thức trọng tâm GDQP 12
- Lý thuyết Tin học 12
- Lý thuyết Công nghệ 12
