50 bài tập về quy đổi (có đáp án 2025) và cách giải
Với cách giải các dạng bài toán quy đổi môn Hoá học lớp 12 gồm phương pháp giải chi tiết, bài tập minh họa có lời giải và bài tập tự luyện sẽ giúp học sinh biết cách làm bài toán quy đổi lớp 12. Mời các bạn đón xem:
Các dạng bài toán quy đổi và cách giải
A. Lý thuyết ngắn gọn
- Khi quy đổi hỗn hợp nhiều chất (hỗn hợp X) (từ ba chất trở lên) thành hỗn hợp hai chất hay chỉ còn một chất ta phải bảo toàn số mol nguyên tố và bảo toàn khối lượng hỗn hợp.
- Có thể quy đổi hỗn hợp X về bất kì cặp chất nào, thậm chí quy đổi về một chất. Tuy nhiên ta nên chọn cặp chất nào đơn giản có ít phản ứng oxi hóa khử nhất để đơn giản việc tính toán.
- Trong quá trình tính toán theo phương pháp quy đổi đôi khi ta gặp số âm đó là sự bù trừ khối lượng của các chất trong hỗn hợp. Trong trường hợp này ta vẫn tính toán bình phương và kết quả cuối cùng vẫn thỏa mãn.
Khi quy đổi hỗn hợp X về một chất là FexOy thì oxit FexOy tìm được chỉ là oxit giả định không có thực.
B. Phương pháp giải
Hỗn hợp gồm Fe và oxit sắt được quy đổi về Fe, O.
Hỗn hợp gồm Fe, FeS, FeS2 được quy đổi về Fe, S.
Bước 1: Viết quá trình nhường nhận electron cho cả quá trình (đầu – cuối) và áp dụng định luật bảo toàn electron.
Bước 2: Kết hợp bảo toàn khối lượng, bảo toàn nguyên tố tính theo yêu cầu đề bài.
C. Ví dụ minh họa
Ví dụ 1: Nung nóng 12,6 gam Fe ngoài không khí, sau một thời gian thu được m gam hỗn hợp X gồm Fe, FeO, Fe2O3 và Fe3O4. Hỗn hợp này phản ứng với dung dịch H2SO4 đặc, nóng dư, thu được 4,2 lít khí SO2 (sản phẩm khử duy nhất, ở đktc). Giá trị của m là
A. 18.
B. 16.
C. 15.
D. 12.
Lời giải chi tiết
nFe=0,225 mol;nSO2=0,1875 mol
Coi hỗn hợp X gồm Fe (0,225 mol) và O (x mol)
Quá trình cho nhận electron:
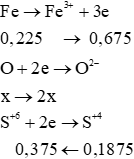
Bảo toàn electron: 0,675 = 2x + 0,375
→ x = 0,15
Bảo toàn khối lượng: mX = mFe + mO
→ mX = 0,225.56 + 0,15.16 = 15 gam
Chọn C.
Ví dụ 2: Cho 6,72 gam hỗn hợp gồm Fe, FeO, Fe2O3, Fe3O4 phản ứng hết với 500 ml dung dịch HNO3 aM loãng dư thu được 0,448 lít khí NO (đktc, là sản phẩm khử duy nhất) và dung dịch X. Dung dịch X có thể hòa tan tối đa 8,4 gam Fe. Giá trị của a là
A. 1,50.
B. 1,14.
C. 1,11.
D. 0,57
Lời giải chi tiết
nNO=0,02 mol
Coi hỗn hợp gồm Fe (x mol) và O (y mol)
→ 56x + 16y = 6,72 (*)
Quá trình cho nhận electron:
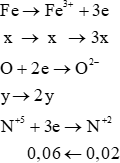
Bảo toàn electron: 3x = 2y + 0,06
→ 3x – 2y = 0,06 (**)
Từ (*) và (**) suy ra: x = 0,09; y = 0,105
Dung dịch X gồm Fe3+ (0,09 mol) và H+, còn dư phản ứng tối đa với 0,15 mol Fe
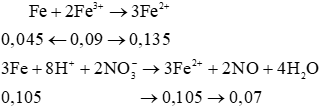
Ta có:
nNO−3=2nFe2+=2.(0,135+0,105)=0,48 mol
nNO=0,07+0,02=0,09 mol
Xét cả quá trình:
nHNO3=nNO−3(trong muoi)+nNO=0,48+0,09=0,57 mol
→a=0,570,5=1,14
Chọn B.
Ví dụ 3: Hòa tan hoàn toàn 3,76 gam hỗn hợp X ở dạng bột gồm S, FeS và FeS2 trong dung dịch HNO3 đặc, nóng, dư, thu được 0,48 mol NO2 (sản phẩm khử duy nhất) và dung dịch Y. Cho dung dịch Y tác dụng với dung dịch Ba(OH)2 dư, lọc và nung kết tủa đến khối lượng không đổi thu được m gam hỗn hợp rắn Z. Giá trị của m là
A. 11,650.
B. 12,815.
C. 17,545.
D. 15,145.
Lời giải chi tiết
Coi hỗn hợp X gồm Fe (a mol) và S (b mol)
→ 56a + 32b = 3,76 (*)
Quá trình cho nhận electron:
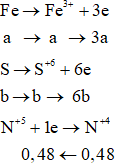
Bảo toàn electron: 3a + 6b = 0,48 (**)
Từ (*) và (**) suy ra: a = 0,03; b = 0,065
Bảo toàn nguyên tố Fe:
nFe2O3=12nFe3+=0,015 mol
Bảo toàn nguyên tố S:
nBaSO4=nS+6=0,065 mol
→m=mFe2O3+mBaSO4=0,015.160
Chọn C.
D. Bài tập tự luyện
Câu 1: Hòa tan 1,16 gam hỗn hợp FeO, Fe2O3, Fe3O4 (trong đó số mol FeO bằng số mol Fe2O3), cần vừa đủ V ml dung dịch HCl 0,1 M. Giá trị của V là
A. 400.
B. 160.
C. 800.
D. 180.
Câu 2: Cho khí CO đi qua ống chứa 10 gam Fe2O3 đốt nóng, thu được m gam hỗn hợp X (gồm ba oxit). Hỗn hợp X đem hoà trong HNO3 đặc, nóng, dư thu được 8,96 lít NO2. Giá trị của m là
A. 8,4.
B. 7,2.
C. 6,8.
D. 5,6.
Câu 3: Đốt cháy x mol Fe bằng oxi thu được 5,04 gam hỗn hợp A. Hòa tan A bằng dung dịch HNO3 dư thu được 0,035 mol hỗn hợp Y gồm NO và NO2 (sản phẩm khử duy nhất). Tỉ khối hơi của Y đối với H2 bằng 19. Giá trị của x là
A. 0,04.
B. 0,05.
C. 0,06.
D. 0,07.
Câu 4: Cho 8,16 gam hỗn hợp X gồm Fe, FeO, Fe3O4 và Fe2O3 phản ứng hết với dung dịch HNO3 loãng (dung dịch Y), thu được 1,344 lít NO (đktc) và dung dịch Z. Dung dịch Z hòa tan tối đa 5,04 gam Fe, sinh ra khí NO. Biết trong các phản ứng, NO là sản phẩm khử duy nhất của N+5. Số mol HNO3 có trong Y là
A. 0,54 mol.
B. 0,78 mol.
C. 0,50 mol.
D. 0,44 mol.
Câu 5: Hòa tan hoàn toàn 4,56 gam hỗn hợp X ở dạng bột gồm FeS và FeS2 và S trong dung dịch HNO3 đặc nóng dư thu được 0,48 mol NO2 (là sản phẩm khử duy nhất) và dung dịch Y. Cho dung dịch Y tác dụng với dung dịch Ba(OH)2 dư, lọc và nung kết tủa đến khối lượng không đổi, được m gam hỗn hợp rắn Z. Giá trị gần nhất của m là
A. 15,8.
B. 20,5.
C. 16,5.
D. 18,5.
Câu 6: Hỗn hợp X gồm Fe, Fe2O3, Fe3O4, FeO với số mol mỗi chất là 0,1 mol, hòa tan hết vào dung dịch Y gồm HCl và H2SO4 loãng dư thu được dung dịch Z. Nhỏ từ từ dung dịch Cu(NO3)2 1M vào dung dịch Z cho tới khi ngưng thoát khí NO. Thể tích dung dịch Cu(NO3)2 cần dùng và thể tích khí thoát ra (ở đktc) là
A. 25 ml; 1,12 lít.
B. 0,5 lít; 22,4 lít.
C. 50 ml; 2,24 lít.
D. 50 ml; 1,12 lít.
Câu 7: Cho m gam hỗn hợp gồm FeO, Fe2O3, Fe3O4 tác dụng với dung dịch HCl dư. Sau khi các phản ứng xảy ra hoàn toàn, được dung dịch Y. Cô cạn Y thu được 7,62 gam FeCl2 và 9,75 gam FeCl3. Giá trị của m là
A. 9,12
B. 8,75
C. 7,80
D. 6,50
Câu 8: Để hòa tan hoàn toàn 23,2 gam hỗn hợp gồm FeO, Fe3O4, Fe2O3 (trong đó số mol FeO bằng số mol Fe2O3), cần dùng vừa đủ V lít dung dịch HCl 0,5M. Giá trị của V là
A. 1,8
B. 0,8
C. 2,3
D. 1,6
Câu 9: Cho 7,68 gam hỗn hợp gồm FeO, Fe3O4, Fe2O3 tác dụng vừa hết với 260 ml dung dịch HCl 1M thu được dung dịch X. Cho dung dịch X phản ứng với dung dịch NaOH dư thu được kết tủa Y. Nung Y ngoài không khí đến khối lượng không đổi, thu được m gam chất rắn. Giá trị của m là
A. 16,0.
B. 8,0.
C. 24,0.
D. 12,0.
Câu 10: Hỗn hợp A gồm FeO, Fe2O3, Fe3O4 (trong đó số mol FeO bằng số mol Fe2O3. Hòa tan 46,4 gam trong dung dịch H2SO4 loãng dư thu được 200 ml dung dịch X. Thể tích dung dịch KMnO4 0,1 M cần thiết để phản ứng hết 100 ml dung dịch X là
A. 200 ml.
B. 500 ml.
C. 250 ml.
D. 150 ml.
ĐÁP ÁN
|
Câu 1 |
Câu 2 |
Câu 3 |
Câu 4 |
Câu 5 |
Câu 6 |
Câu 7 |
Câu 8 |
Câu 9 |
Câu 10 |
|
A |
C |
D |
C |
C |
C |
A |
D |
B |
A |
Xem thêm các dạng bài tập và công thức Hoá học lớp 12 hay, chi tiết khác:
Các dạng bài tập về sắt và hợp chất của sắt tác dụng với HNO3 hoặc H2SO4 đặc hay nhất
Cách xác định công thức oxit sắt, hợp chất của sắt hay nhất
Bài tập tổng hợp về Cu, Zn, Cr, Sn, Pb và cách giải
Trắc nghiệm lý thuyết Chương 8 Phân biệt một số hợp chất vô cơ có lời giải
Trắc nghiệm lý thuyết Chương 9 Hóa học và vấn đề Phát triển kinh tế, xã hội, môi trường có lời giải
Xem thêm các chương trình khác:
- Giải sgk Toán 12 (sách mới) | Giải bài tập Toán 12 Tập 1, Tập 2
- Các dạng bài tập Toán lớp 12
- Lý thuyết Toán 12
- Chuyên đề Toán lớp 12 mới nhất
- Bài tập Toán lớp 12 mới nhất
- Giáo án Toán lớp 12 mới nhất
- Tóm tắt tác phẩm Ngữ văn 12
- Soạn văn 12 (hay nhất) | Để học tốt Ngữ văn 12 (sách mới)
- Soạn văn 12 (ngắn nhất)
- Tác giả tác phẩm Ngữ văn lớp 12
- Văn mẫu lớp 12
- Giải sgk Sinh học 12 (sách mới) | Giải bài tập Sinh học 12
- Lý thuyết Sinh học 12 | Kiến thức trọng tâm Sinh 12
- Giải sgk Địa Lí 12 (sách mới) | Giải bài tập Địa lí 12
- Lý thuyết Địa Lí 12
- Giải Tập bản đồ Địa Lí 12
- Giải sgk Vật Lí 12 (sách mới) | Giải bài tập Vật lí 12
- Giải sbt Vật Lí 12
- Lý thuyết Vật Lí 12
- Các dạng bài tập Vật lí lớp 12
- Giáo án Vật lí lớp 12 mới nhất
- Giải sgk Lịch sử 12 (sách mới) | Giải bài tập Lịch sử 12
- Giải Tập bản đồ Lịch sử 12
- Lý thuyết Lịch sử 12
- Giải sgk Giáo dục công dân 12
- Lý thuyết Giáo dục công dân 12
- Giải sgk Giáo dục quốc phòng - an ninh 12 (sách mới) | Giải bài tập GDQP 12
- Lý thuyết Giáo dục quốc phòng 12 | Kiến thức trọng tâm GDQP 12
- Lý thuyết Tin học 12
- Lý thuyết Công nghệ 12
