Lý thuyết Phản ứng hóa học (mới 2023 + Bài Tập) - Hóa học 8
Tóm tắt lý thuyết Hóa 8 Bài 13: Phản ứng hóa học ngắn gọn, chi tiết sẽ giúp học sinh nắm vững kiến thức trọng tâm Hóa 8 Bài 13.
Lý thuyết Hóa 8 Bài 13: Phản ứng hóa học
Bài giảng Hóa 8 Bài 13: Phản ứng hóa học
I. Định nghĩa
- Phản ứng hóa học là quá trình biến đổi từ chất này thành chất khác.
+ Chất ban đầu, bị biến đổi trong phản ứng gọi là chất phản ứng (hay chất tham gia).
+ Chất mới sinh ra là chất sản phẩm.
- Cách ghi phương trình hóa học dạng phương trình chữ:
Tên các chất phản ứng → tên sản phẩm
Ví dụ: Natri + nước → Natri hiđroxit + hiđro
Đọc là: Natri tác dụng với nước tạo thành natri hiđroxit và khí hiđro.
- Trong quá trình phản ứng, lượng chất phản ứng giảm dần, lượng chất sản phẩm tăng dần.
II. Diễn biến của phản ứng hóa học
- Xét sự tạo thành phân tử nước từ oxi và hiđro.
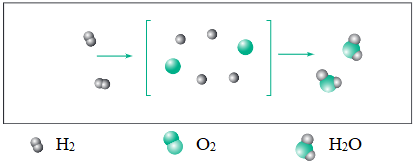
Hình 1: Sơ đồ tượng trưng cho phản ứng hóa học giữa khí hiđro và khí oxi tạo ra nước
- Nhận xét:
+ Trước phản ứng, 2 nguyên tử oxi liên kết với nhau, 2 nguyên tử hiđro liên kết với nhau.
+ Sau phản ứng, một nguyên tử oxi liên kết với 2 nguyên tử hiđro.
+ Trong quá trình phản ứng, liên kết giữa 2 nguyên tử hiđro và liên kết giữa 2 nguyên tủ oxi bị đứt gãy.
- Kết luận: Trong phản ứng hóa học chỉ có liên kết giữa các nguyên tử thay đổi làm cho phân tử này biến đổi thành phân tử khác. Kết quả là chất này biến đổi thành chất khác.
- Lưu ý: Nếu có đơn chất kim loại tham gia phản ứng thì sau phản ứng nguyên tử kim loại phải liên kết với nguyên tử nguyên tố khác.
III. Phản ứng hóa học xảy ra khi nào?
- Phản ứng hóa học xảy ra khi các chất phản ứng được tiếp xúc với nhau. Bề mặt tiếp xúc càng lớn, phản ứng xảy ra càng nhanh.
Ví dụ: Phản ứng sắt và lưu huỳnh, sử dụng sắt và lưu huỳnh ở dạng bột giúp phản ứng xảy ra nhanh hơn.
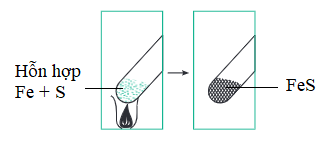
Hình 2: Phản ứng giữa sắt và lưu huỳnh
- Một số phản ứng cần đun nóng đến một nhiệt độ nào đó, một số phản ứng thì không cần đun nóng, nhưng có phản ứng cần đun liên tục trong suốt thời gian phản ứng.
Ví dụ:
+ Phản ứng giữa lưu huỳnh và sắt chỉ cần đun nóng lúc đầu để khơi mào.
+ Phản ứng phân hủy đường cần đun nóng liên tục trong suốt thời gian phản ứng.
+ Phản ứng giữa kẽm và axit clohiđric xảy ra mà không cần đun nóng.

Hình 3: Kẽm phản ứng với axit clohđric
- Một số phản ứng cần chất xúc tác. Chất xúc tác là chất kích thích cho phản ứng xảy ra nhanh hơn nhưng không biến đổi sau khi phản ứng kết thúc.
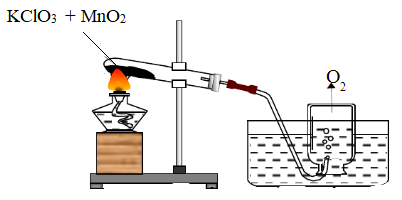
Hình 4: Nhiệt phân KClO3 với xúc tác là MnO2
IV. Cách nhận biết phản ứng hóa học xảy ra
Dấu hiệu nhận biết có phản ứng hóa học xảy ra:
- Có chất mới xuất hiện, có tính chất khác với chất phản ứng (kết tủa, bay hơi, chuyển màu,…).
Ví dụ: CuSO4 phản ứng với NaOH xuất hiện kết tủa xanh.

Hình 5: CuSO4 phản ứng với NaOH
- Sự tỏa nhiệt và phát sáng.
Ví dụ: Phản ứng cháy của cây nến

Hình 6: Cây nến đang cháy
Trắc nghiệm Hóa học lớp 8 Bài 13: Phản ứng hóa học
Câu 1: Phản ứng hóa học là
A. Quá trình biến hợp chất thành đơn chất.
B. Quá trình biến đổi trạng thái của chất.
C. Quá trình biến đổi chất này thành chất khác.
D. Quá trình biến một chất thành nhiều chất.
Câu 2: Dấu hiệu nào giúp ta có khẳng định có phản ứng hoá học xảy ra?
A. Có chất kết tủa (chất không tan).
B. Có chất khí thoát ra (sủi bọt).
C. Có sự thay đổi màu sắc.
D. Một trong số các dấu hiệu trên.
Câu 3: Hiện tượng nào sau đây chứng tỏ có phản ứng hoá học xảy ra?
A. Từ màu này chuyển sang màu khác.
B. Từ trạng thái rắn chuyển sang trạng thái lỏng.
C. Từ trạng thái lỏng chuyển sang trạng thái hơi.
D. Từ trạng rắn chuyển sang trạng thái hơi.
Câu 4: Trong một phản ứng hoá học, các chất phản ứng và chất tạo thành phải chứa cùng:
A. Số nguyên tử của mỗi nguyên tố.
B. Số nguyên tử trong mỗi chất.
C. Số phân tử trong mỗi chất.
D. Số nguyên tố tạo ra chất.
Câu 5: Khẳng định sau đây gồm 2 ý: “Trong phản ứng hóa học, chỉ có phân tử bị biến đổi còn các nguyên tử vẫn giữ nguyên, nên tổng khối lượng trước phản ứng luôn bằng tổng khối lượng sau phản ứng”. Hãy chọn phương án đúng dưới đây?
A. Ý 1 đúng, ý 2 sai.
B. Ý 1 sai, ý 2 đúng.
C. Cả hai ý đều đúng nhưng ý 1 không giải thích cho ý 2.
D. Cả hai ý đều đúng và ý 1 giải thích cho ý 2.
Câu 6: Loại hạt vi mô nào luôn được bảo toàn trong phản ứng hóa học?
A. Phân tử.
B. Nguyên tử.
C. Cả A và B đúng.
D.Cả A và B sai.
Câu 7: Kết luận nào dưới đây là đúng trong mọi phản ứng hóa học?
A. Phản ứng hóa học chỉ xảy ra được khi có chất xúc tác.
B. Lượng các chất sản phẩm tăng dần, lượng các chất tham gia giảm dần.
C. Lượng các chất tham gia không thay đổi.
D. Lượng các chất sản phẩm giảm dần, lượng các chất tham gia tăng dần.
Câu 8: Câu nào sau đây đúng?
A. Trong phản ứng hoá học, các nguyên tử bị phá vỡ.
B. Trong phản ứng hoá học, liên kết trong các phân tử bị phá vỡ.
C. Trong phản ứng hoá học, liên kết trong các phân tử không bị phá vỡ.
D. Trong phản ứng hoá học các phân tử được bảo toàn.
Câu 9: Các câu sau, câu nào sai?
A. Trong phản ứng hoá học các nguyên tử được bảo toàn, không tự nhiên sinh ra hoặc mất đi.
B. Trong phản ứng hoá học, các nguyên tử bị phân chia.
C. Trong phản ứng hoá học, các phân tử bị phân chia.
D. Trong phản ứng hoá học, các phân tử không bị phá vỡ.
Câu 10: Bỏ quả trứng vào dung dịch axit clohiđric thấy sủi bọt ở vỏ trứng. Biết rằng axit clohiđric đã tác dụng với canxi cacbonat (chất này trong vỏ trứng) tạo ra canxi clorua (chất này tan), nước và khí cacbon đioxit thoát ra. Ý nào dưới đây biểu diễn đúng phương trình chữ của phản ứng trên.
A. Axit clohiđric + canxi cacbonat → canxi clorua + cacbon đioxit + nước.
B. Canxi clorua + cacbon đioxit + nước → Axit clohiđric + canxi cacbonat.
C. Axit clohiđric + canxi cacbonat → canxi clorua + cacbon đioxit.
D. Canxi clorua + nước → Axit clohiđric + canxi cacbonat.
Xem thêm các bài tổng hợp lý thuyết Hóa lớp 8 đầy đủ, chi tiết khác:
Lý thuyết Bài 15: Định luật bảo toàn khối lượng
Lý thuyết Bài 16: Phương trình hóa học
Lý thuyết Bài 17: Bài luyện tập 3
Lý thuyết Bài 19: Chuyển đổi giữa khối lượng, thể tích và lượng chất
Xem thêm các chương trình khác:
- Tóm tắt tác phẩm Ngữ văn 8 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Soạn văn 8 (hay nhất) | Để học tốt Ngữ văn lớp 8 (sách mới)
- Soạn văn 8 (ngắn nhất) | Để học tốt Ngữ văn lớp 8 (sách mới)
- Văn mẫu lớp 8 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Tác giả - tác phẩm Ngữ văn 8 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Vật Lí 8
- Giải sbt Vật Lí 8
- Lý thuyết Vật Lí 8
- Giải vở bài tập Vật lí 8
- Giải SGK Toán 8 | Giải bài tập Toán 8 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Toán 8 (sách mới) | Sách bài tập Toán 8
- Bài tập Ôn luyện Toán lớp 8
- Các dạng bài tập Toán lớp 8
- Lý thuyết Toán lớp 8 (sách mới) | Kiến thức trọng tâm Toán 8
- Giáo án Toán lớp 8 mới nhất
- Bài tập Toán lớp 8 mới nhất
- Chuyên đề Toán lớp 8 mới nhất
- Giải sgk Tiếng Anh 8 (sách mới) | Giải bài tập Tiếng Anh 8 Học kì 1, Học kì 2
- Giải sgk Tiếng Anh 8 | Giải bài tập Tiếng Anh 8 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Tiếng Anh 8 (sách mới) | Sách bài tập Tiếng Anh 8
- Giải sbt Tiếng Anh 8 (thí điểm)
- Giải sgk Tin học 8 | Giải bài tập Tin học 8 Học kì 1, Học kì 2 (sách mới)
- Giải sgk Lịch Sử 8 | Giải bài tập Lịch sử 8 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Lịch sử 8 (sách mới) | Kiến thức trọng tâm Lịch sử 8
- Giải vở bài tập Lịch sử 8
- Giải Tập bản đồ Lịch sử 8
- Đề thi Lịch Sử 8
- Giải vở bài tập Sinh học 8
- Giải sgk Sinh học 8
- Lý thuyết Sinh học 8
- Giải sgk Giáo dục công dân 8 | Giải bài tập Giáo dục công dân 8 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Giáo dục công dân 8 (sách mới) | Kiến thức trọng tâm GDCD 8
- Lý thuyết Địa Lí 8 (sách mới) | Kiến thức trọng tâm Địa Lí 8
- Giải sgk Địa Lí 8 | Giải bài tập Địa Lí 8 Học kì 1, Học kì 2 (sách mới)
- Giải Tập bản đồ Địa Lí 8
- Đề thi Địa lí 8
