Lý thuyết Điều chế khí hiđro – Phản ứng thế (mới 2023 + Bài Tập) - Hóa học 8
Tóm tắt lý thuyết Hóa 8 Bài 33: Điều chế khí hiđro – Phản ứng thế ngắn gọn, chi tiết sẽ giúp học sinh nắm vững kiến thức trọng tâm Hóa 8 Bài 33.
Lý thuyết Hóa 8 Bài 33: Điều chế khí hiđro – Phản ứng thế
Bài giảng Hóa 8 Bài 33: Điều chế khí hiđro – Phản ứng thế
1. Điều chế hiđro
a. Trong phòng thí nghiệm
- Điều chế khí hiđro bằng cách cho kim loại kẽm (hoặc Fe, Al) tác dụng với dung dịch axit (HCl, H2SO4 loãng).
- Phương trình hóa học:
Zn + 2HCl → ZnCl2 + H2↑
Fe + 2HCl → FeCl2 + H2↑
3Al + 6HCl → 2AlCl3 + 3H2↑
- Khí H2 được thu bằng cách đẩy không khí hay đẩy nước.
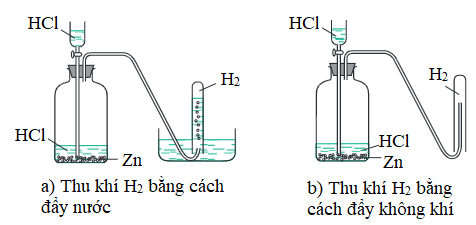
Hình 1: Điều chế và thu khí H2
- Nhận ra khí H2 bằng que đóm còn tàn đỏ (khí thoát ra không làm than hồng bùng cháy). Đưa que đóm đang cháy vào đầu ống dẫn khí, khí thoát ra sẽ cháy trong không khí với ngọn lửa màu xanh nhạt.
b. Trong công nghiệp
- Hiđro được điều chế bằng cách điện phân nước hoặc dùng than khử oxi của H2O trong lò khí than hoặc điều chế H2 từ khí tự nhiên, khí dầu mỏ.
- Phương trình hóa học điện phân nước:
2H2O 2H2↑ + O2↑
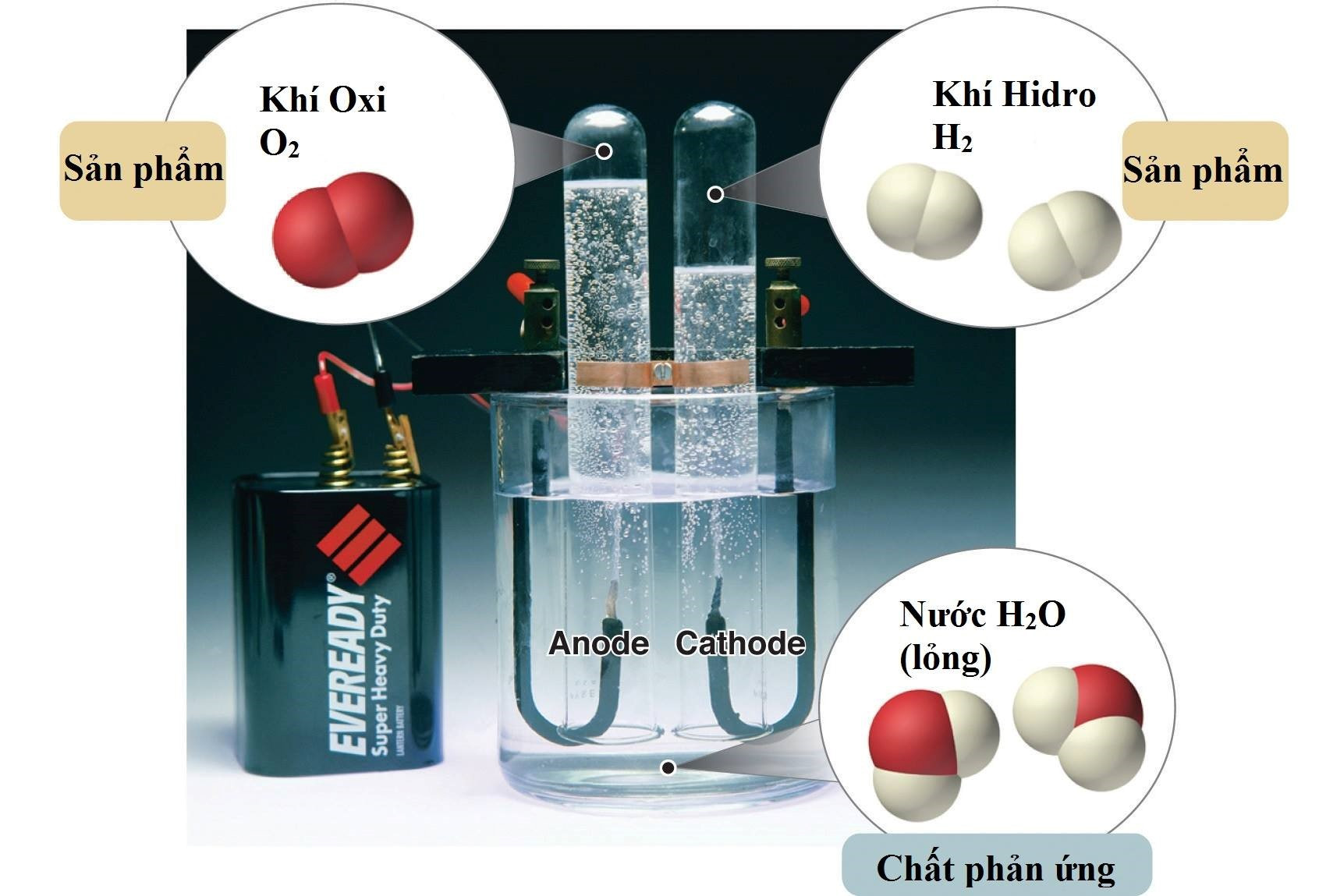
Hình 2: Thí nghiệm về nguyên tắc điều chế H2 bằng cách điện phân nước
2. Phản ứng thế
- Phản ứng thế là phản ứng hóa học của đơn chất và hợp chất, trong đó nguyên tử của đơn chất thay thế nguyên tử của một nguyên tố khác trong hợp chất.
Ví dụ:
Fe + 2HCl → FeCl2 + H2↑
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
→ Nguyên tử của đơn chất Fe (hoặc Al) đã thay thế nguyên tử của nguyên tố hiđro trong hợp chất axit.
Trắc nghiệm Hóa 8 Bài 33: Điều chế khí hidro – phản ứng thế
Câu 1: Trong phòng thí nghiệm, khí hiđro được điều chế bằng cách
A. điện phân nước.
B. khử oxit kim loại.
C. cho axit (HCl hoặc H2SO4 loãng) tác dụng với kim loại kẽm (hoặc sắt, nhôm).
D. chưng chất phân đoạn không khí lỏng.
Câu 2: Trong công nghiệp, điều chế H2 bằng cách
A. cho axit HCl tác dụng với kim loại kẽm.
B. điện phân nước.
C. khử oxit kim loại.
D. nhiệt phân hợp chất giàu hiđro.
Câu 3: Phát biểu nào sau đây không đúng?
A. Thu khí H2 vào ống nghiệm bằng cách đẩy không khí hay đẩy nước.
B. Nhận ra khí H2 bằng que đóm đang cháy.
C. Khí hiđro khử đồng(II) oxit ở nhiệt độ cao thành kim loại Cu.
D. Khí hiđro có tính oxi hóa.
Câu 4: Phản ứng thế là phản ứng hóa học
A. giữa đơn chất và hợp chất, trong đó nguyên tử của đơn chất thay thế nguyên tử của một nguyên tố khác trong hợp chất.
B. xảy ra giữa 2 hợp chất vô cơ.
C. trong đó một chất mới được tạo thành từ hai hay nhiều chất ban đầu.
D. trong đó một chất sinh ra hai hay nhiều chất mới.
Câu 5: Phản ứng nào sau đây là phản ứng thế?
A. 3CO + Fe2O3 2Fe + 3CO2.
B. Fe + CuCl2 FeCl2 + Cu.
C. 2KClO3 2KCl + 3O2↑.
D. CaO + CO2 → CaCO3.
Câu 6: Cho các phản ứng hóa học sau:
(1) Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
(2) K2O + H2O → 2KOH
(3) Zn + H2SO4 → ZnSO4 + H2↑
(4) CuO + 2HCl → CuCl2 + H2O
(5) Mg + CuCl2 → MgCl2 + Cu
(6) HCl + NaOH → NaCl + H2O
Số phản ứng thuộc loại phản ứng thế là
A. 2.
B. 3.
C. 4.
D. 5.
Câu 7: Thí nghiệm nào sau đây có sinh ra khí hiđro?
A. Cho nhôm vào dung dịch H2SO4 loãng.
B. Đốt một mẩu cacbon.
C. Cho cacbon oxit tác dụng với đồng(II) oxit ở nhiệt độ cao.
D. Nhiệt phân KMnO4.
Câu 8: Cho kim loại kẽm tác dụng với dung dịch HCl dư. Để điều chế được 1,12 lít khí hiđro (ở đktc) thì khối lượng kẽm cần dùng là
A. 0,65 gam.
B. 1,95 gam.
C. 2,60 gam.
D. 3,25 gam.
Câu 9: Điện phân hoàn toàn 2,4 lít nước ở trạng thái lỏng (biết khối lượng riêng D của nước là 1 kg/lít), thể tích khí hiđro và thể tích khí oxi thu được (ở đktc) lần lượt là
A. 1493,3 lít và 2986,6 lít.
B. 2986,6 lít và 1493,3 lít.
C. 2589,8 lít và 1256,6 lít.
D. 1256,6 lít và 2589,8 lít.
Câu 10: Cho 2,7 gam nhôm tác dụng với dung dịch H2SO4 loãng, dư. Thể tích khí H2 (ở đktc) thu được sau phản ứng là
A. 1,12 lít.
B. 2,24 lít.
C. 3,36 lít.
D. 4,48 lít.
Xem thêm các bài tổng hợp lý thuyết Hóa lớp 8 đầy đủ, chi tiết khác:
Lý thuyết Bài 34: Bài luyện tập 6
Lý thuyết Bài 37: Axit – Bazơ – Muối
Xem thêm các chương trình khác:
- Tóm tắt tác phẩm Ngữ văn 8 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Soạn văn 8 (hay nhất) | Để học tốt Ngữ văn lớp 8 (sách mới)
- Soạn văn 8 (ngắn nhất) | Để học tốt Ngữ văn lớp 8 (sách mới)
- Văn mẫu lớp 8 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Tác giả - tác phẩm Ngữ văn 8 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Vật Lí 8
- Giải sbt Vật Lí 8
- Lý thuyết Vật Lí 8
- Giải vở bài tập Vật lí 8
- Giải SGK Toán 8 | Giải bài tập Toán 8 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Toán 8 (sách mới) | Sách bài tập Toán 8
- Bài tập Ôn luyện Toán lớp 8
- Các dạng bài tập Toán lớp 8
- Lý thuyết Toán lớp 8 (sách mới) | Kiến thức trọng tâm Toán 8
- Giáo án Toán lớp 8 mới nhất
- Bài tập Toán lớp 8 mới nhất
- Chuyên đề Toán lớp 8 mới nhất
- Giải sgk Tiếng Anh 8 (sách mới) | Giải bài tập Tiếng Anh 8 Học kì 1, Học kì 2
- Giải sgk Tiếng Anh 8 | Giải bài tập Tiếng Anh 8 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Tiếng Anh 8 (sách mới) | Sách bài tập Tiếng Anh 8
- Giải sbt Tiếng Anh 8 (thí điểm)
- Giải sgk Tin học 8 | Giải bài tập Tin học 8 Học kì 1, Học kì 2 (sách mới)
- Giải sgk Lịch Sử 8 | Giải bài tập Lịch sử 8 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Lịch sử 8 (sách mới) | Kiến thức trọng tâm Lịch sử 8
- Giải vở bài tập Lịch sử 8
- Giải Tập bản đồ Lịch sử 8
- Đề thi Lịch Sử 8
- Giải vở bài tập Sinh học 8
- Giải sgk Sinh học 8
- Lý thuyết Sinh học 8
- Giải sgk Giáo dục công dân 8 | Giải bài tập Giáo dục công dân 8 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Giáo dục công dân 8 (sách mới) | Kiến thức trọng tâm GDCD 8
- Lý thuyết Địa Lí 8 (sách mới) | Kiến thức trọng tâm Địa Lí 8
- Giải sgk Địa Lí 8 | Giải bài tập Địa Lí 8 Học kì 1, Học kì 2 (sách mới)
- Giải Tập bản đồ Địa Lí 8
- Đề thi Địa lí 8
