Lý thuyết Điều chế khí oxi – Phản ứng phân hủy (mới 2023 + Bài Tập) - Hóa học 8
Tóm tắt lý thuyết Hóa 8 Bài 27: Điều chế khí oxi – Phản ứng phân hủy ngắn gọn, chi tiết sẽ giúp học sinh nắm vững kiến thức trọng tâm Hóa 8 Bài 27.
Lý thuyết Hóa 8 Bài 27: Điều chế khí oxi – Phản ứng phân hủy
Bài giảng Hóa 8 Bài 27: Điều chế khí oxi – Phản ứng phân hủy
I. Điều chế khí oxi
1. Trong phòng thí nghiệm
- Phương pháp: Đun nóng hợp chất giàu oxi và dễ bị phân hủy ở nhiệt độ cao như kali pemanganat KMnO4 hoặc kali clorat KClO3 trong ống nghiệm.
- Phương trình hóa học:
2KMnO4 K2MnO4 + MnO2 + O2↑
2KClO3 2KCl + 3O2↑
- Thu khí oxi bằng phương pháp đẩy không khí hoặc đẩy nước.
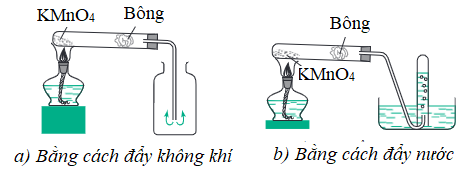
Hình 1: Thu khí oxi
2. Trong công nghiệp
Nguyên liệu để sản xuất khí oxi trong công nghiệp là không khí hoặc nước.
- Sản xuất từ không khí: Đầu tiên hóa lỏng không khí ở nhiệt độ thấp và áp suất cao, sau đó cho không khí lỏng bay hơi. Trước hết thu được khí nitơ (– 196°C ), sau đó là khí oxi ( – 183°C).
- Sản xuất từ nước: Điện phân nước trong các bình điện phân, sẽ thu được hai khí riêng biệt là O2 và H2.
2H2O 2H2↑ + O2↑
II. Phản ứng phân hủy
- Là phản ứng hóa học trong đó từ một chất sinh ra hai hay nhiều chất mới.
Ví dụ:
2KMnO4 K2MnO4 + MnO2 + O2↑
2KClO3 2KCl + 3O2↑
CaCO3 CaO + CO2↑
Trắc nghiệm Hóa 8 Bài 27: Điều chế oxi - Phản ứng phân hủy
Câu 1: Phản ứng phân hủy là
A. Phản ứng phân hủy là phản ứng hóa học trong đó một chất sinh ra một chất mới.
B. Phản ứng phân hủy là phản ứng hóa học trong đó một chất sinh ra hai chất mới.
C. Phản ứng phân hủy là phản ứng hóa học trong đó một chất sinh ra hai hay nhiều chất mới.
D. Phản ứng phân hủy là phản ứng hóa học có chất khí thoát ra.
Câu 2: Các chất có thể dùng điều chế Oxi trong phòng thí nghiệm là
A. KClO3
B. KMnO4
C. CaCO3
D. Cả A và B
Câu 3: Số gam KClO3 cần dùng để điều chế 3,36 lít O2 ở điều kiện tiêu chuẩn là
A. 12,25 gam
B. 24,5 gam
C. 18,375 gam
D. 36,75 gam
Câu 4: Có thể sử dụng cách nào dưới đây để điều chế được oxi trong công nghiệp?
A. Dùng nguyên liệu là không khí.
B. Dùng nước làm nguyên liệu.
C. Dùng đá vôi làm nguyên liệu.
D. A và B.
Câu 5: Phản ứng nào dưới đây là phản ứng phân hủy?
A. Ba + 2HCl → BaCl2 + H2
B. Cu + H2S → CuS + H2
C. MgO + CO2 → MgCO3
D. 2KMnO4 K2MnO4 + O2 + MnO2
Câu 6: Nhiệt phân 12,25 gam KClO3 thấy có V lít khí bay lên ở điều kiện tiêu chuẩn. Giá trị của V là
A. 4,8 lít
B. 3,36 lít
C. 2,24 lít
D. 3,2 lít
Câu 7: Tổng hệ số của chất tham gia và tổng hệ số của chất sản phẩm ở phản ứng: 2KClO3 2KCl + 3O2 là
A. 2 và 5
B. 5 và 2
C. 2 và 2
D. 2 và 3
Câu 8: Hóa chất nào không dùng để điều chế oxi?
A. KClO3
B. KMnO4
C. CaCO3
D. H2O
Câu 9: Số sản phẩm tạo thành của phản ứng phân hủy là
A. 2
B. 3
C. 2 hay nhiều sản phẩm.
D. 1
Câu 10: Chọn nhận xét đúng
A. Phản ứng phân hủy luôn tạo ra 2 sản phẩm.
B. Phản ứng phân hủy có thể cho 1 đến nhiều sản phẩm.
C. Phản ứng phân hủy là phản ứng sinh ra 2 hoặc nhiều sản phẩm.
D. Cả A và C đều đúng
Xem thêm các bài tổng hợp lý thuyết Hóa lớp 8 đầy đủ, chi tiết khác:
Lý thuyết Bài 28: Không khí – Sự cháy
Lý thuyết Bài 29: Bài luyện tập 5
Lý thuyết Bài 31: Tính chất - Ứng dụng của hiđro
Xem thêm các chương trình khác:
- Tóm tắt tác phẩm Ngữ văn 8 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Soạn văn 8 (hay nhất) | Để học tốt Ngữ văn lớp 8 (sách mới)
- Soạn văn 8 (ngắn nhất) | Để học tốt Ngữ văn lớp 8 (sách mới)
- Văn mẫu lớp 8 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Tác giả - tác phẩm Ngữ văn 8 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Vật Lí 8
- Giải sbt Vật Lí 8
- Lý thuyết Vật Lí 8
- Giải vở bài tập Vật lí 8
- Giải SGK Toán 8 | Giải bài tập Toán 8 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Toán 8 (sách mới) | Sách bài tập Toán 8
- Bài tập Ôn luyện Toán lớp 8
- Các dạng bài tập Toán lớp 8
- Lý thuyết Toán lớp 8 (sách mới) | Kiến thức trọng tâm Toán 8
- Giáo án Toán lớp 8 mới nhất
- Bài tập Toán lớp 8 mới nhất
- Chuyên đề Toán lớp 8 mới nhất
- Giải sgk Tiếng Anh 8 (sách mới) | Giải bài tập Tiếng Anh 8 Học kì 1, Học kì 2
- Giải sgk Tiếng Anh 8 | Giải bài tập Tiếng Anh 8 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Tiếng Anh 8 (sách mới) | Sách bài tập Tiếng Anh 8
- Giải sbt Tiếng Anh 8 (thí điểm)
- Giải sgk Tin học 8 | Giải bài tập Tin học 8 Học kì 1, Học kì 2 (sách mới)
- Giải sgk Lịch Sử 8 | Giải bài tập Lịch sử 8 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Lịch sử 8 (sách mới) | Kiến thức trọng tâm Lịch sử 8
- Giải vở bài tập Lịch sử 8
- Giải Tập bản đồ Lịch sử 8
- Đề thi Lịch Sử 8
- Giải vở bài tập Sinh học 8
- Giải sgk Sinh học 8
- Lý thuyết Sinh học 8
- Giải sgk Giáo dục công dân 8 | Giải bài tập Giáo dục công dân 8 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Giáo dục công dân 8 (sách mới) | Kiến thức trọng tâm GDCD 8
- Lý thuyết Địa Lí 8 (sách mới) | Kiến thức trọng tâm Địa Lí 8
- Giải sgk Địa Lí 8 | Giải bài tập Địa Lí 8 Học kì 1, Học kì 2 (sách mới)
- Giải Tập bản đồ Địa Lí 8
- Đề thi Địa lí 8
