Lý thuyết Phản ứng oxi hóa – khử (mới 2023 + Bài Tập) - Hóa học 8
Tóm tắt lý thuyết Hóa 8 Bài 32: Phản ứng oxi hóa – khử ngắn gọn, chi tiết sẽ giúp học sinh nắm vững kiến thức trọng tâm Hóa 8 Bài 32.
Lý thuyết Hóa 8 Bài 32: Phản ứng oxi hóa – khử
Bài giảng Hóa 8 Bài 32: Phản ứng oxi hóa – khử
1. Sự khử. Sự oxi hóa
a) Sự khử
- Sự khử là sự tách oxi khỏi hợp chất.
- Ví dụ:
3H2 + Fe2O3 to→ 2Fe + 3H2O
- Quá trình tách nguyên tử oxi ra khỏi hợp chất Fe2O3, ta nói đã xảy ra sự khử Fe2O3 thành Fe.
- Ở các nhiệt độ cao khác nhau, khí H2 có thể chiếm được nguyên tố oxi của một số oxit kim loại khác, người ta nói: Trong các phản ứng hóa học này, xảy ra sự khử hoặc (sự khử oxi) oxit kim loại.
b) Sự oxi hóa
- Sự oxi hóa là sự tác dụng của oxi với một chất.
- Ví dụ:
3H2 + Fe2O3 to→ 2Fe + 3H2O
- Quá trình kết hợp của nguyên tử O trong Fe2O3 với H2, ta nói đã xảy ra sự oxi hóa H2 tạo thành H2O.
2. Chất khử. Chất oxi hóa
- Chất chiếm oxi của chất khác gọi là chất khử.
- Chất nhường oxi cho chất khác là chất oxi hóa.
Lưu ý: Trong phản ứng của oxi với các chất khác thì bản thân oxi là chất oxi hóa.
Ví dụ:
S + O2 to→ SO2
- S là chất khử
- O2 chất oxi hóa
3. Phản ứng oxi hóa – khử
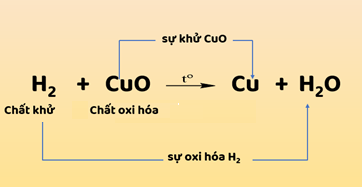
Hình 1: Sơ đồ biểu diễn quá trình sự khử và sự oxi hóa
- Sự khử và sự oxi hóa là hai quá trình tuy ngược nhau nhưng xảy ra đồng thời trong cùng một phản ứng hóa học. Phản ứng hóa học này được gọi là phản ứng oxi hóa – khử.
- Phản ứng oxi hóa – khử là phản ứng hóa trong đó xảy ra đồng thời sự oxi oxi hóa và sự khử.
4. Tầm quan trọng của phản ứng oxi hóa – khử
- Phản ứng oxi hóa khử là cơ sở của nhiều công nghệ sản xuất trong luyện kim và công nghiệp hóa học. Người ta sử dụng hợp lí các phản ứng oxi hóa – khử để tăng hiệu suất, nâng cao chất lượng sản phẩm.
- Nhiều phản ứng oxi hóa - khử diễn ra trong quá trình kim loại bị phá hủy trong tự nhiên. Người ta đã tìm được nhiều biện pháp hạn chế các phản ứng oxi hóa – khử không có lợi.
Trắc nghiệm Hóa 8 Bài 32: Phản ứng oxi hóa – khử
Câu 1: Sự tách oxi khỏi hợp chất gọi là
A. sự oxi hóa.
B. sự khử.
C. sự phân hủy.
D. sự lên men.
Câu 2: Trong phản ứng hóa học giữa khí H2 và CuO ở nhiệt độ cao đã xảy ra
A. sự oxi hóa H2 tạo thành H2O.
B. sự khử H2 tạo thành H2O.
C. sự oxi hoá CuO tạo ra Cu.
D. sự phân hủy CuO thành Cu.
Câu 3: Phát biểu nào sau đây không đúng?
A. Chất chiếm oxi của chất khác là chất khử.
B. Chất nhường oxi cho chất khác là chất oxi hóa.
C. Sự tác dụng của oxi với một chất là sự oxi hóa.
D. Trong phản ứng của oxi với cacbon, bản thân oxi cũng chất khử.
Câu 4: Trong phản ứng: CuO + H2 to→ Cu + H2O, chất khử và chất oxi hóa lần lượt là:
A. CuO, H2.
B. H2, CuO.
C. Cu, H2O.
D. H2O, Cu.
Câu 5: Phản ứng oxi hóa – khử là phản ứng trong đó
A. xảy ra đồng thời sự oxi hóa và sự khử.
B. chỉ xảy ra sự oxi hóa.
C. chỉ xảy ra sự khử.
D. không xảy ra sự oxi hóa và sự khử.
Câu 6: Phản ứng nào sau đây không phải là phản ứng oxi hóa – khử?
A. C + O2 to→ CO2.
B. Fe2O3 + 3CO to→ 2Fe + 3CO2.
C. CaCO3 to→ CaO + CO2.
D. 3Fe + 2O2 to→ Fe3O4.
Câu 7: Cho phương trình hóa học của phản ứng: Fe2O3 + 3H2 to→ 2Fe + 3H2O. Phát biểu đúng là:
A. Phản ứng hóa học trên không là phản ứng oxi hóa – khử.
B. Phản ứng hóa học trên là phản ứng oxi hóa – khử; Fe2O3 là chất oxi hóa, H2 là chất khử.
C. Phản ứng hóa học trên là phản ứng oxi hóa – khử; Fe2O3 là chất khử, H2 là chất oxi hóa.
D. Phản ứng hóa học trên là phản ứng phân hủy.
Câu 8: Thực hiện các thí nghiệm sau:
(1) Sục khí CO2 vào dung dịch Ca(OH)2.
(2) Cho khí H2 qua sắt(III) oxit nung nóng.
(3) Đốt cháy Fe trong bình đựng khí Cl2.
(4) Sục khí SO2 vào dung dịch KOH.
Số thí nghiệm có xảy ra phản ứng oxi hóa – khử là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 9: Cho phương trình hóa học: 2Al + Fe2O3 to→ Al2O3 + 3Fe. Quá trình Al tạo thành Al2O3 và quá trình Fe2O3 tạo thành Fe được gọi lần lượt là
A. sự oxi hóa, sự khử.
B. sự khử, sự oxi hóa.
C. sự phân hủy, sự khử.
D. sự oxi hóa, sự phân hủy.
Câu 10: Cho những biến đổi hóa học sau:
(1) Nung nóng canxi cacbonat.
(2) Sắt tác dụng với lưu huỳnh.
(3) Khí CO đi qua đồng(II) oxit nung nóng.
Những biến đổi hóa học trên thuộc loại phản ứng nào?
A. (1) và (3) là phản ứng oxi hóa – khử, (2) là phản ứng hóa hợp.
B. (1) là phản ứng phân hủy, (2) là phản ứng hóa hợp, (3) là phản ứng oxi hóa – khử.
C. (1) là phản ứng phân hủy, (2) là phản ứng oxi hóa – khử, (3) là phản ứng hóa hợp.
D. (1) là phản ứng hóa hợp, (2) và (3) là phản ứng oxi hóa – khử.
Xem thêm các bài tổng hợp lý thuyết Hóa lớp 8 đầy đủ, chi tiết khác:
Lý thuyết Bài 33: Điều chế khí hiđro – Phản ứng thế
Lý thuyết Bài 34: Bài luyện tập 6
Xem thêm các chương trình khác:
- Tóm tắt tác phẩm Ngữ văn 8 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Soạn văn 8 (hay nhất) | Để học tốt Ngữ văn lớp 8 (sách mới)
- Soạn văn 8 (ngắn nhất) | Để học tốt Ngữ văn lớp 8 (sách mới)
- Văn mẫu lớp 8 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Tác giả - tác phẩm Ngữ văn 8 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Vật Lí 8
- Giải sbt Vật Lí 8
- Lý thuyết Vật Lí 8
- Giải vở bài tập Vật lí 8
- Giải SGK Toán 8 | Giải bài tập Toán 8 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Toán 8 (sách mới) | Sách bài tập Toán 8
- Bài tập Ôn luyện Toán lớp 8
- Các dạng bài tập Toán lớp 8
- Lý thuyết Toán lớp 8 (sách mới) | Kiến thức trọng tâm Toán 8
- Giáo án Toán lớp 8 mới nhất
- Bài tập Toán lớp 8 mới nhất
- Chuyên đề Toán lớp 8 mới nhất
- Giải sgk Tiếng Anh 8 (sách mới) | Giải bài tập Tiếng Anh 8 Học kì 1, Học kì 2
- Giải sgk Tiếng Anh 8 | Giải bài tập Tiếng Anh 8 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Tiếng Anh 8 (sách mới) | Sách bài tập Tiếng Anh 8
- Giải sbt Tiếng Anh 8 (thí điểm)
- Giải sgk Tin học 8 | Giải bài tập Tin học 8 Học kì 1, Học kì 2 (sách mới)
- Giải sgk Lịch Sử 8 | Giải bài tập Lịch sử 8 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Lịch sử 8 (sách mới) | Kiến thức trọng tâm Lịch sử 8
- Giải vở bài tập Lịch sử 8
- Giải Tập bản đồ Lịch sử 8
- Đề thi Lịch Sử 8
- Giải vở bài tập Sinh học 8
- Giải sgk Sinh học 8
- Lý thuyết Sinh học 8
- Giải sgk Giáo dục công dân 8 | Giải bài tập Giáo dục công dân 8 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Giáo dục công dân 8 (sách mới) | Kiến thức trọng tâm GDCD 8
- Lý thuyết Địa Lí 8 (sách mới) | Kiến thức trọng tâm Địa Lí 8
- Giải sgk Địa Lí 8 | Giải bài tập Địa Lí 8 Học kì 1, Học kì 2 (sách mới)
- Giải Tập bản đồ Địa Lí 8
- Đề thi Địa lí 8
