Lý thuyết Bài luyện tập 4 (mới 2023 + Bài Tập) - Hóa học 8
Tóm tắt lý thuyết Hóa 8 Bài 23: Bài luyện tập 4 ngắn gọn, chi tiết sẽ giúp học sinh nắm vững kiến thức trọng tâm Hóa 8 Bài 23.
Lý thuyết Hóa 8 Bài 23: Bài luyện tập 4
Bài giảng Hóa 8 Bài 23: Bài luyện tập 4
Kiến thức cần nhớ
I. Mol
- Mol là lượng chất chứa N ( hay 6.1023) nguyên tử hoặc phân tử chất đó.
- Ví dụ:
1 mol nguyên tử Cu sẽ chứa 6.1023 nguyên tử đồng.
0,15 mol phân tử H2O sẽ chứa 0,15. 6.1023 = 9.1022 phân tử nước.
II. Khối lượng mol
- Khối lượng mol của một chất là khối lượng của N nguyên tử hoặc phân tử chất đó, tính bằng gam, có số trị bằng nguyên tử khối hoặc phân tử khối.
- Ví dụ:
+ Khối lượng mol nguyên tử của hiđro là 1 g/mol có nghĩa là khối lượng của N nguyên tử hiđro (H) là 1 gam.
+ Khối lượng mol phân tử của hiđro là 2 g/mol có nghĩa là khối lượng của N phân tử hiđro (H2) là 2 gam.
III. Thể tích mol chất khí
- Thể tích mol của chất khí là thể tích chiếm bởi N phân tử chất đó.
- Ở cùng điều kiện về nhiệt độ và áp suất, 1 mol của bất kì chất khí nào cũng chiếm những thể tích bằng nhau.
- Ở điều kiện tiêu chuẩn (0oC và 1 atm) thì thể tích của 1 mol khí là 22,4 lít.
- Có những chất khí khác nhau (H2, CO2, O2,…) tuy có khối lượng mol không bằng nhau nhưng chúng có thể tích bằng nhau (cùng to và p) nên ta có sự chuyển đổi sau:
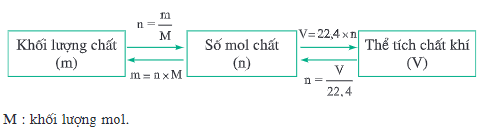
Hình 1: Sơ đồ sự chuyển đổi giữa lượng chất (số mol) – khối lượng chất – thể tích chất khí (đktc)
- Ví dụ: Cho thể tích của khí CO2 là 2,24 lít (đktc), hãy tính khối lượng của khí CO2?
Hướng dẫn:
Số mol khí CO2 là:
Khối lượng của khí CO2 là:
IV. Tỉ khối của chất khí
- Tỉ khối của chất khí A so với chất khí B:
với MA, MB là khối lượng mol của chất A, B.
- Tỉ khối của chất khí A so với không khí:
⇒ Tỉ khối của chất khí cho ta biết chất khí A nặng hay nhẹ hơn chất B (hoặc không khí).
- Ví dụ: Tỉ khối của khí CO2 đối với không khí bằng 1,52.
⇒ Khối lượng mol của CO2 lớn hơn khối lượng của mol không khí là 1,52 lần hoặc khối lượng của 1 thể tích khí CO2 lớn hơn khối lượng của 1 thể tích không khí là 1,52 lần (các thể tích khí đo cùng nhiệt độ, áp suất).
Trắc nghiệm Hóa học lớp 8 Bài 23: Bài luyện tập 4
Câu 1: 0,5 mol mol nước chứa số phân tử là
A. 3,01.1023
B. 6,02.1023
C. 3.1023
D. 4.1023
Câu 2: Số nguyên tử có trong 1,8 mol Fe là
A. 10,85.1023 nguyên tử
B. 10,8.1023 nguyên tử
C. 11.1023 nguyên tử
D. 1,8.1023 nguyên tử
Câu 3: Cho hỗn hợp khí sau: H2, CH4, SO2, CO2, NO2, NH3. Số chất khí nặng hơn không khí là
A. 5
B. 3
C. 4
D. 2
Câu 3: Thành phần phần trăm của cacbon trong 1 mol hợp chất NaHCO3 là
A. 11,28 %
B. 11,3%
C. 14,29%
D. 14,53%
Câu 4: Số mol của 11,2 gam Fe là
A. 0,1 mol.
B. 0,2 mol.
C. 0,21 mol.
D. 0,12 mol.
Câu 5: Số mol nguyên tử hiđro có trong 36 gam nước là
A. 1 mol
B.1,5 mol
C. 2 mol
D. 4 mol
Câu 6: Cho số mol của Nitơ là 0,5 mol, số mol của Oxi là 0,5 mol. Kết luận nào sau đây là đúng?
A. Khối lượng của nitơ là 16 gam
B. Khối lượng của oxi là 14 gam
C. Nitơ và oxi có thể tích bằng nhau ở điều kiện tiêu chuẩn.
D. Nitơ và oxi có khối lượng bằng nhau.
Câu 7: Tỉ khối của khí A đối với không khí có giá trị nhỏ hơn 1. A có thể là khí nào trong các khí sau?
A. O2
B. H2S
C. CO2
D. N2
Câu 8: Đốt cháy hoàn toàn 13 gam Zn trong oxi thu được ZnO. Thể tích khí oxi đã dùng (đktc) là
A. 11,2 lít.
B. 3,36 lít.
C. 2,24 lít.
D. 4,48 lít
Câu 9: 0,5 mol khí CO2 đo ở điều kiện tiêu chuẩn (đktc) có thể tích là
A. 22,4 lít
B. 11,2 lít
C. 44,8 lít
D. 24 lít.
Câu 10: Kết luận đúng khi nói về khí clo và khí metan?
A. Khí clo và khí metan có 1khối lượng mol bằng nhau.
B. Khí clo nặng hơn 4,4375 lần khí metan.
C. Khí metan nặng hơn khí clo 2,5 lần.
D. Khí metan nặng hơn khí clo 4,4375 lần.
Xem thêm các bài tổng hợp lý thuyết Hóa lớp 8 đầy đủ, chi tiết khác:
Lý thuyết Bài 24: Tính chất của oxi
Lý thuyết Bài 25: Sự oxi hóa – Phản ứng hóa hợp - Ứng dụng của oxi
Lý thuyết Bài 27: Điều chế khí oxi – Phản ứng phân hủy
Lý thuyết Bài 28: Không khí – Sự cháy
Xem thêm các chương trình khác:
- Tóm tắt tác phẩm Ngữ văn 8 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Soạn văn 8 (hay nhất) | Để học tốt Ngữ văn lớp 8 (sách mới)
- Soạn văn 8 (ngắn nhất) | Để học tốt Ngữ văn lớp 8 (sách mới)
- Văn mẫu lớp 8 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Tác giả - tác phẩm Ngữ văn 8 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Vật Lí 8
- Giải sbt Vật Lí 8
- Lý thuyết Vật Lí 8
- Giải vở bài tập Vật lí 8
- Giải SGK Toán 8 | Giải bài tập Toán 8 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Toán 8 (sách mới) | Sách bài tập Toán 8
- Bài tập Ôn luyện Toán lớp 8
- Các dạng bài tập Toán lớp 8
- Lý thuyết Toán lớp 8 (sách mới) | Kiến thức trọng tâm Toán 8
- Giáo án Toán lớp 8 mới nhất
- Bài tập Toán lớp 8 mới nhất
- Chuyên đề Toán lớp 8 mới nhất
- Giải sgk Tiếng Anh 8 (sách mới) | Giải bài tập Tiếng Anh 8 Học kì 1, Học kì 2
- Giải sgk Tiếng Anh 8 | Giải bài tập Tiếng Anh 8 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Tiếng Anh 8 (sách mới) | Sách bài tập Tiếng Anh 8
- Giải sbt Tiếng Anh 8 (thí điểm)
- Giải sgk Tin học 8 | Giải bài tập Tin học 8 Học kì 1, Học kì 2 (sách mới)
- Giải sgk Lịch Sử 8 | Giải bài tập Lịch sử 8 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Lịch sử 8 (sách mới) | Kiến thức trọng tâm Lịch sử 8
- Giải vở bài tập Lịch sử 8
- Giải Tập bản đồ Lịch sử 8
- Đề thi Lịch Sử 8
- Giải vở bài tập Sinh học 8
- Giải sgk Sinh học 8
- Lý thuyết Sinh học 8
- Giải sgk Giáo dục công dân 8 | Giải bài tập Giáo dục công dân 8 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Giáo dục công dân 8 (sách mới) | Kiến thức trọng tâm GDCD 8
- Lý thuyết Địa Lí 8 (sách mới) | Kiến thức trọng tâm Địa Lí 8
- Giải sgk Địa Lí 8 | Giải bài tập Địa Lí 8 Học kì 1, Học kì 2 (sách mới)
- Giải Tập bản đồ Địa Lí 8
- Đề thi Địa lí 8
