Lý thuyết Axit nitric và muối nitrat (mới 2023 + Bài Tập) - Hóa học 11
Tóm tắt lý thuyết Hóa 11 Bài 9: Axit nitric và muối nitrat ngắn gọn, chi tiết sẽ giúp học sinh nắm vững kiến thức trọng tâm Hóa 11 Bài 9.
Lý thuyết Hóa 11 Bài 9: Axit nitric và muối nitrat
Bài giảng Hóa 11 Bài 9: Axit nitric và muối nitrat
A. AXIT NITRIC
I. Cấu tạo phân tử
- Công thức cấu tạo của HNO3: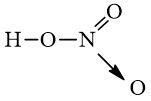
Chú ý: Mũi tên trong công thức cấu tạo trên cho biết cặp electron liên kết chỉ do nguyên tử N cung cấp.
- Trong hợp chất HNO3, nitơ có số oxi hóa cao nhất là +5.
II. Tính chất vật lý
- Axit nitric tinh khiết là chất lỏng không màu, bốc khói mạnh trong không khí ẩm.
- Axit nitric không bền, khi có ánh sáng phân hủy một phần sinh ra khí NO2. Khí này tan trong dung dịch axit, làm cho dung dịch có màu vàng.
4HNO34NO2↑ + O2↑ + 2H2O
- Axit nitric tan vô hạn trong nước. Trong phòng thí nghiệm thường có loại HNO3 đặc nồng độ 68%, D = 1,4 g/cm3.
III. Tính chất hóa học
1. Tính axit
- Axit nitric là một trong số các axit mạnh nhất, trong dung dịch phân li hoàn toàn:
- Dung dịch axit HNO3 có đầy đủ tính chất của một dung dịch axit: làm đỏ quỳ tím, tác dụng với oxit bazơ, bazơ, muối của axit yếu hơn.
Thí dụ:
CuO + 2HNO3 → Cu(NO3)2 + H2O
NaOH + HNO3 → NaNO3 + H2O
CaCO3 + 2HNO3 → Ca(NO3)2 + CO2↑ + H2O
2. Tính oxi hóa
- HNO3 có tính oxi hóa mạnh.
- Kim loại hay phi kim khi gặp axit HNO3 đều bị oxi hóa lên trạng thái có mức oxi hóa cao nhất.
a) Tác dụng với kim loại
- HNO3 oxi hóa hầu hết các kim loại trừ vàng (Au) và platin (Pt).
* Với những kim loại có tính khử yếu: Cu, Ag, ...
Cu+4HNO3 (đặc)→Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3 (loãng)→3Cu(NO3)2+2NO↑+4H2O
* Khi tác dụng với những kim loại có tính khử mạnh hơn: Mg, Zn, Al, ... thì HNO3 loãng có thể bị khử đến N2O, N2 hoặc NH4NO3.
8Al+30HNO3 (loãng)→8Al(NO3)3+3N2O+15H2O
4Zn+10HNO3 (loãng)→4Zn(NO3)2+NH4NO3+3H2O
* Lưu ý: Fe, Al, Cr bị thụ động hóa trong dung dịch HNO3 đặc, nguội.
b) Tác dụng với phi kim
- Khi đun nóng, HNO3 đặc có thể tác dụng với phi kim: C, P, S, …(trừ N2 và halogen).
Thí dụ:
S+6HNO3(đ)→H2SO4+6NO2↑+2H2O
c) Tác dụng với hợp chất
- H2S, HI, SO2, FeO, muối sắt (II), … có thể tác dụng với HNO3.
Thí dụ:
3FeO+10HNO3(đ)→3Fe(NO3)3+NO↑+5H2O
3H2S+2HNO3(đ)→ 3S↓+2NO↑+4H2O
- Nhiều hợp chất hữu cơ như giấy, vải, dầu thông, … bốc cháy khi tiếp xúc với HNO3 đặc.
IV. Ứng dụng
- Phần lớn sử dụng để điều chế phân đạm NH4NO3, …
- Ngoài ra, sử dụng sản xuất thuốc nổ, thuốc nhuộm, dược phẩm, …
V. Điều chế
1. Trong phòng thí nghiệm
Axit HNO3 được điều chế bằng cách cho natri nitrat hoặc kali nitrat rắn tác dụng với axit H2SO4 đặc, nóng:
NaNO3(rắn) +H2SO4(đặc)HNO3+NaHSO4
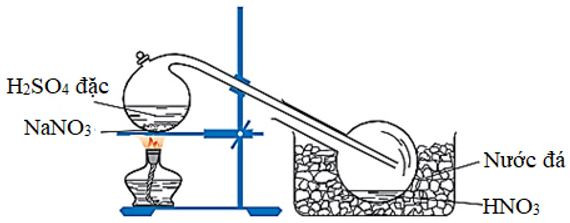
Hình 1: Điều chế axit nitric trong phòng thí nghiệm
2. Trong công nghiệp
- Được điều chế từ NH3 qua ba giai đoạn:
NH3NONO2HNO3.
a) Oxi hóa khí amoniac bằng oxi không khí
4NH3+5O24NO+6H2O;
b) Oxi hóa NO thành NO2 bằng oxi không khí ở điều kiện thường
2NO+O2→2NO2
c) Chuyển hóa NO2 thành HNO3
4NO2+2H2O+O2→4HNO3
Dung dịch HNO3 thu được thường có nồng độ 52 – 68%. Để có HNO3 có nồng độ cao hơn 68% người ta thường chưng cất axit này với HNO3 đậm đặc.
B. MUỐI NITRAT
- Muối của axit nitric được gọi là nitrat.
Thí dụ: natri nitrat NaNO3, bạc nitrat AgNO3,…
I. Tính chất vật lý
- Tất cả các muối nitrat đều dễ tan trong nước, là chất điện li mạnh trong dung dịch phân li hoàn toàn thành các ion.
Thí dụ:
Ca(NO3)2→ Ca2++ 2
- Ion không màu, màu của 1 số muối nitrat là do màu của cation kim loại.
II. Tính chất hóa học
1. Nhiệt phân muối nitrat
a) Muối nitrat của các kim loại hoạt động mạnh (kali, natri,…)
Muối nitratMuối nitrit + O2↑
Thí dụ:
2NaNO32NaNO2 + O2↑
b) Muối nitrat của Mg, Zn, Fe, Pb, Cu,…
Muối nitratOxit kim loại + NO2↑ + O2↑
Thí dụ:
2Cu(NO3)22CuO + 4NO2↑ + O2↑
4Fe(NO3)22Fe2O3 + 8NO2↑ + O2↑
c) Muối nitrat của những kim loại Ag, Au, Hg,…
Muối nitratKim loại + NO2↑ + O2↑
Thí dụ:
2AgNO32Ag + 2NO2↑ + O2↑
2. Nhận biết ion nitrat
- Trong môi trường trung tính không có tính oxi hóa.
- Trong môi trường axit, ion thể hiện tính oxi hóa giống như HNO3.
⇒ Thuốc thử dùng để nhận biết ion là một ít vụn đồng và dung dịch H2SO4 loãng, đun nóng.
Hiện tượng: dung dịch có màu xanh, khí không màu hóa nâu đỏ trong không khí.
3Cu+8H++2→3Cu2++2NO↑+4H2O
2NO+O2(không khí)→2NO2(màu nâu đỏ)
III. Ứng dụng
- Các muối nitrat được sử dụng chủ yếu làm phân bón hóa học (phân đạm) trong nông nghiệp như NH4NO3, NaNO3, KNO3, Ca(NO3)2.

Hình 2: Một số loại phân đạm
- KNO3 còn được sử dụng để chế thuốc nổ đen (thuốc nổ khói). Thuốc nổ đen chứa 75% KNO3, 10%S và 15% C.
C. Chu trình của nitơ trong tự nhiên
Nguyên tố nitơ rất cần cho sự sống trên Trái Đất. Trong tự nhiên, luôn luôn diễn ra các quá trình chuyển hóa nitơ từ dạng này sang dạng khác theo một chu trình tuần hoàn khép kín.
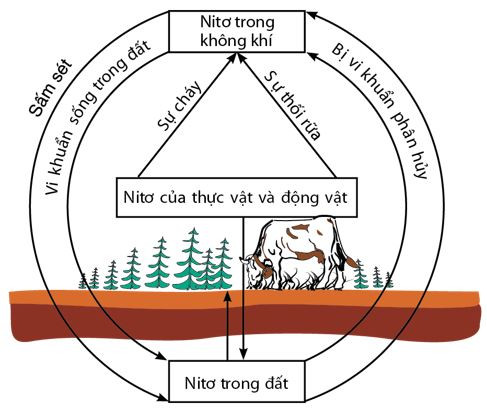
Hình 3: Chu trình của nitơ trong tự nhiên
Trắc nghiệm Hóa 11 Bài 9: Axit nitric và muối nitrat
Câu 1: Hòa tan 1,12 gam Fe bằng 300 ml dung dịch HCl 0,2M, thu được dung dịch X và khí H2. Cho dung dịch AgNO3 dư vào X, thu được khí NO (sản phẩm khử duy nhất của và m gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
A. 7,36.
B. 10,23.
C. 9,15.
D. 8,61.
Đáp án: C
Giải thích:
Fe + 2HCl → FeCl2 + H2
= 0,06 – 0,02.2 = 0,02 mol
Câu 2: Dãy gồm các chất không bị hòa tan trong dung dịch HNO3 đặc nguội là
A. Al, Zn, Cu
B. Al, Cr, Fe
C. Zn, Cu, Fe
D. Al, Fe, Mg
Đáp án: B
Giải thích: Các kim loại Al, Cr, Fe bị thụ động hóa trong H2SO4 và HNO3 đặc, nguội do tạo trên bề mặt kim loại một lớp màng oxit đặc biệt, bền với axit và ngăn cản hoặc ngừng hẳn sự tiếp diễn của phản ứng.
Câu 3: Cho Cu tác dụng với dung dịch hỗn hợp gồm NaNO3 và H2SO4 loãng giải phóng khí X (không màu, dễ hoá nâu trong không khí). Khí X là
A. NO.
B. NO2.
C. N2O.
D. NH3.
Đáp án: A
Giải thích:
3Cu +
2NO + O2 → 2NO2 (nâu đỏ)
Câu 4: Cho 19,2 gam Cu vào 500 ml dung dịch NaNO3 1M, sau đó thêm 500 ml dung dịch HCl 2M đến phản ứng hoàn toàn thu được khí NO và dung dịch X. Phải thêm bao nhiêu lít dung dịch NaOH 0,4M để kết tủa hết ion Cu2+ trong dung dịch X?
A. 1 lít.
B. 1,25 lít.
C. 1,5 lít.
D. 2 lít.
Đáp án: D
Giải thích:
→ Cu phản ứng hết,dư.
→dư = 2.0,3 + (1 - 0,8) = 0,8 mol
→ lít
Câu 5: HNO3 phản ứng với tất cả các chất trong nhóm nào sau đây ?
A. NH3, Al2O3, Cu2S, BaSO4.
B. Cu(OH)2, BaCO3, Au, Fe2O3.
C. CuS, Pt, SO2, Ag.
D. Fe(NO3)2, S, NH4HCO3, Mg(OH)2.
Đáp án: D
Giải thích: Loại A, B và C do HNO3 không phản ứng với BaSO4; Au; Pt.
Câu 6: Khi hòa tan hoàn toàn một lượng CuO có màu đen vào dung dịch HNO3 thì dung dịch thu được có màu
A. xanh
B. vàng
C. da cam
D. không màu
Đáp án: A
Giải thích:
Phương trình phản ứng:
CuO + 2HNO3 → Cu(NO3)2 + H2O
Dung dịch thu được có màu xanh.
Câu 7: Hòa tan hoàn toàn hỗn hợp gồm 0,03 mol Cu và 0,09 mol Mg vào dung dịch chứa 0,07 mol KNO3 và 0,16 mol H2SO4 loãng thì thu được dung dịch Y chỉ chứa các muối sunfat trung hòa và 1,12 lít (đktc) hỗn hợp khí X gồm các oxit của nitơ có tỉ khối so với H2 là x. Giá trị của x là
A. 19,5.
B. 20,1.
C. 18,2.
D. 19,6.
Đáp án: D
Giải thích:
Dung dịch Y gồm
Bảo toàn điện tích ta có:
0,03.2 + 0,09.2 + 0,07.1 + a.1 = 0,16.2
→ a = 0,01 mol
Bảo toàn H:
Bảo toàn khối lượng cho phương trình:
→ mkhí = 0,07.62 + 0,16.2.1 – 0,01.18 – 0,14.18 = 1,96 gam
→
Câu 8: Chất nào sau đây tác dụng với dung dịch HNO3 loãng, dư sinh ra khí NO?
A. Fe2O3.
B. FeO.
C. Fe(OH)3.
D. Fe2(SO4)3.
Đáp án: B
Giải thích:
Chất tác dụng với dung dịch HNO3 loãng, dư sinh ra khí NO
→ Chất này đóng vai trò là chất khử.
→ FeO thỏa mãn.
3FeO + 10HNO3 → 3Fe(NO3)3 + NO↑ + 5H2O
Câu 9: Hòa tan hoàn toàn 26,52 gam Al2O3 bằng một lượng vừa đủ dung dịch HNO3, thu được 247 gam dung dịch X. Làm lạnh X đến 20 thì có m gam tinh thể Al(NO3)3.9H2O tách ra. Biết ở 20, cứ 100 gam H2O hòa tan được tối đa 75,44 gam Al(NO3)3. Giá trị của m gần nhất với giá trị nào sau đây?
A. 90.
B. 14.
C. 19.
D. 33.
Đáp án: D
Giải thích:
→ 247 gam dung dịch X
ntinh thể = a mol
→ Sau kết tinh, dung dịch chứa
Câu 10: Cho hỗn hợp X gồm a mol Fe và 0,21 mol Mg vào dung dịch Y chứa Cu(NO3)2 và AgNO3 (tỉ lệ mol tương ứng 3:2). Sau khi các phản ứng kết thúc, thu được dung dịch Z và 27,84 gam chất rắn T gồm ba kim loại. Hòa tan toàn bộ T trong lượng dư dung dịch H2SO4 đặc nóng, thu được 0,33 mol SO2 (sản phẩm khử duy nhất của H2SO4). Giá trị của a là
A. 0,09.
B. 0,08
C. 0,12.
D. 0,06.
Đáp án: A
Giải thích:
27,84 gam chất rắn T gồm Fe (x mol), Cu (3y mol) và Ag (2y mol)
Bảo toàn khối lượng:
56x + 64.3y + 108.2y = 27,84 (1)
Bảo toàn electron:
3x + 2.3y + 1.2y = 0,33.2 (2)
Từ (1) và (2) → x = y = 0,06 mol
Bảo toàn electron khi X tác dụng với Y:
Xem thêm các bài tổng hợp lý thuyết Hóa học lớp 11 đầy đủ, chi tiết khác:
Lý thuyết Bài 11: Axit photphoric và muối photphat
Lý thuyết Bài 12: Phân bón hóa học
Lý thuyết Bài 13: Luyện tập: Tính chất của nitơ, photpho và các hợp chất của chúng
Xem thêm các chương trình khác:
- Tóm tắt tác phẩm Ngữ văn 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Soạn văn 11 (hay nhất) | Để học tốt Ngữ Văn 11 (sách mới)
- Soạn văn 11 (ngắn nhất) | Để học tốt Ngữ văn 11 (sách mới)
- Tác giả tác phẩm Ngữ văn 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Văn mẫu 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Toán 11 | Giải bài tập Toán 11 Học kì 1, Học kì 2 (sách mới)
- Các dạng bài tập Toán lớp 11
- Lý thuyết Toán lớp 11 (sách mới) | Kiến thức trọng tâm Toán 11
- Giáo án Toán lớp 11 mới nhất
- Bài tập Toán lớp 11 mới nhất
- Chuyên đề Toán lớp 11 mới nhất
- Giải sgk Tiếng Anh 11 (thí điểm)
- Giải sgk Tiếng Anh 11 | Giải bài tập Tiếng anh 11 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Tiếng Anh 11 (sách mới) | Sách bài tập Tiếng Anh 11
- Giải sbt Tiếng Anh 11 (thí điểm)
- Giải sgk Lịch sử 11 | Giải bài tập Lịch sử 11 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Lịch Sử 11(sách mới) | Kiến thức trọng tâm Lịch Sử 11
- Giải Tập bản đồ Lịch sử 11
- Giải sgk Vật Lí 11 | Giải bài tập Vật lí 11 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 11 (sách mới) | Sách bài tập Vật Lí 11
- Lý thuyết Vật Lí 11 (sách mới) | Kiến thức trọng tâm Vật Lí 11
- Các dạng bài tập Vật Lí lớp 11
- Giáo án Vật lí lớp 11 mới nhất
- Giải sgk Sinh học 11 | Giải bài tập Sinh học 11 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Sinh học 11 (sách mới) | Kiến thức trọng tâm Sinh 11
- Giải sgk Giáo dục công dân 11
- Lý thuyết Giáo dục công dân 11
- Lý thuyết Địa Lí 11 (sách mới) | Kiến thức trọng tâm Địa lí 11
- Giải Tập bản đồ Địa Lí 11
- Giải sgk Giáo dục quốc phòng - an ninh 11
