Lý thuyết Phản ứng trao đổi ion trong dung dịch các chất điện li (mới 2023 + Bài Tập) - Hóa học 11
Tóm tắt lý thuyết Hóa 11 Bài 4: Phản ứng trao đổi ion trong dung dịch các chất điện li ngắn gọn, chi tiết sẽ giúp học sinh nắm vững kiến thức trọng tâm Hóa 11 Bài 4.
Lý thuyết Hóa 11 Bài 4: Phản ứng trao đổi ion trong dung dịch các chất điện li
Bài giảng Hóa 11 Bài 4: Phản ứng trao đổi ion trong dung dịch các chất điện li
1. Điều kiện xảy ra phản ứng trao đổi ion trong dung dịch các chất điện li
Xét phản ứng:
Dung dịch A + dung dịch B → Sản phẩm.
- Phản ứng xảy ra trong dung dịch các chất điện li là phản ứng giữa các ion.
- Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi các ion kết hợp được với nhau tạo thành ít nhất 1 trong số các chất sau:
+ Chất kết tủa.
+ Chất điện li yếu.
+ Chất khí.
Thí dụ:
+ Phản ứng tạo thành chất kết tủa:
Na2SO4 + BaCl2 → 2NaCl + BaSO4↓

Kết tủa BaSO4
+ Phản ứng tạo thành chất điện li yếu:
HCl + NaOH → NaCl + H2O
+ Phản ứng tạo thành chất khí:
Fe + H2SO4 loãng → FeSO4 + H2↑
2. Phương trình ion rút gọn
- Phương trình ion rút gọn cho biết bản chất của phản ứng trong dung dịch các chất điện li.
- Cách chuyển từ phương trình dưới dạng phân tử thành phương trình ion rút gọn như sau:
Bước 1:
+ Chuyển các chất vừa dễ tan, vừa điện li mạnh thành ion.
+ Các chất khí, chất kết tủa, chất điện li yếu để nguyên ở dạng phân tử.
⇒ Khi này, phương trình thu được gọi là phương trình ion đầy đủ.
Thí dụ: Xét phản ứng:
Na2SO4 + BaCl2 → 2NaCl + BaSO4↓
Phương trình ion đầy đủ là:
2Na+ ++ Ba2+ + 2Cl- → BaSO4↓ + 2Na+ + 2Cl-
Bước 2: Lược bỏ những ion không tham gia phản ứng, ta được phương trình ion rút gọn.
Ba2+ +→ BaSO4↓
Từ phương trình này ta thấy rằng, muốn điều chế kết tủa BaSO4 chỉ cần trộn 2 dung dịch, một dung dịch chứa Ba2+, dung dịch kia chứa ion SO42-.
Trắc nghiệm Hóa 11 Bài 4: Phản ứng trao đổi ion trong dung dịch các chất điện li
Câu 1: Dãy ion không thể tồn tại đồng thời trong dung dịch là
A. Na+, , Mg2+,
B. K+, H+, ,
C. , Mg+, Ca2+,
D. , Na+, Ba2+,
Đáp án: A
Giải thích:
![]()
Câu 2: Phương trình phản ứng: Ba(OH)2 + 2HCl → BaCl2 + 2H2O có phương trình ion rút gọn là:
A. H+ + OH– → H2O
B. Ba2+ + 2OH– + 2H+ + 2Cl– → BaCl2 + 2H2O
C. Ba2+ + 2Cl– → BaCl2
D. Cl– + H+ → HCl
Đáp án: A
Giải thích:
Phương trình phân tử:
Ba(OH)2 + 2HCl → BaCl2 + 2H2O
Phương trình ion đầy đủ:
Ba2+ + 2OH– + 2H+ + 2 → Ba2+ + 2 + 2H2O
Phương trình ion rút gọn:
H+ + OH– → H2O
Câu 3: Cho phản ứng: Mg(OH)2 + 2HCl → MgCl2 + H2O.
Phương trình ion thu gọn của phản ứng trên là
A. HCl + OH – → H2O + .
B. 2H+ + Mg(OH)2 → Mg2+ + 2H2O.
C. H+ + OH – → H2O.
D. 2HCl + Mg(OH)2 → Mg2+ + 2 + 2H2O.
Đáp án: B
Giải thích:
Ta có phản ứng: Mg(OH)2 + 2HCl → MgCl2 + 2H2O.
Phương trình ion đầy đủ là:
Mg(OH)2 + 2H+ + 2 → Mg2+ + 2 + 2H2O.
→ Phương trình ion thu gọn là: Mg(OH)2 + 2H+ → Mg2+ + 2H2O.
Câu 4: Phương trình ion rút gọn Ba2+ + → BaSO4 tương ứng với phương trình phân tử nào sau đây?
A. Ba(OH)2 + CuSO4 → BaSO4 + Cu(OH)2.
B. H2SO4 + BaCO3 → BaSO4 + CO2 + H2O.
C. Na2SO4 + Ba(NO3)2 → BaSO4 + 2NaNO3.
D. H2SO4 + Ba(OH)2 → BaSO4 + 2H2O.
Đáp án: C
Giải thích: 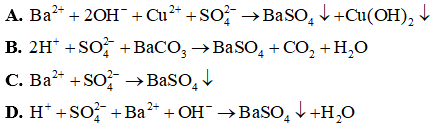
Câu 5: Phản ứng nào sau đây là phản ứng trao đổi ion trong dung dịch các chất điện li?
A. 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
B. 2HCl + FeS → FeCl2 + H2S
C. NaOH + HCl → NaCl + H2O
D. Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Đáp án: C
Giải thích: Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi các ion kết hợp được với nhau tạo thành ít nhất một trong các chất sau: chất kết tủa, chất điện li yếu, chất khí.
Câu 6: Trong dung dịch, ion OH- không tác dụng được với ion
A. K+.
B. H+.
C.
D. Fe3+.
Đáp án: A
Giải thích:
A. K+ không phản ứng được với
B.
C.
D.
Câu 7: Cho dung dịch X chứa các ion: vào dung dịch Y chứa các ion: . Số phản ứng xảy ra là
A. 1.
B. 2.
C. 3.
D. 4.
Đáp án: D
Câu 8: Cho các phản ứng hóa học sau:
(1) NaHS + NaOH
(2) Ba(HS)2 + KOH
(3) Na2S + HCl
(4) CuSO4 + Na2S
(5) FeS + HCl
(6) NH4HS + NaOH
Các phản ứng đều có cùng một phương trình ion rút gọn là:
A. (3), (4), (5).
B. (1), (2).
C. (1), (2), (6).
D. (1), (6).
Đáp án: B
Giải thích:
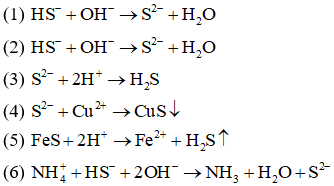
Câu 9: Phương trình ion thu gọn: là của phản ứng xảy ra giữa cặp chất nào sau đây?
(1) CaCl2 + Na2CO3
(2) Ca(OH)2 + CO2
(3) Ca(HCO3)2 + NaOH
(4) Ca(NO3)2 + (NH4)2CO3
A. (1) và (2).
B. (2) và (3).
C. (1) và (4).
D. (2) và (4).
Đáp án: C
Giải thích:
(1), (4) có cùng phương trình ion thu gọn là
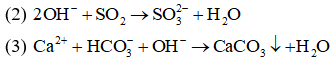
Câu 10: Phản ứng nào dưới đây là phản ứng trao đổi ion trong dung dịch?
A. Zn + H2SO4 ZnSO4 + H2
B. Fe(NO3)3 + 3NaOH Fe(OH)3 + 3NaNO3
C. 2Fe(NO3)3 + 2KI 2Fe(NO3)2 + I2 + 2KNO3
D. Zn + 2Fe(NO3)3 Zn(NO3)2 + 2Fe(NO3)2
Đáp án: B
Giải thích:
A, C, D là phản ứng oxi hóa khử
B là phản ứng trao đổi ion trong dung dịch:
Xem thêm các bài tổng hợp lý thuyết Hóa học lớp 11 đầy đủ, chi tiết khác:
Lý thuyết Bài 8: Amoniac và muối amoni
Xem thêm các chương trình khác:
- Tóm tắt tác phẩm Ngữ văn 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Soạn văn 11 (hay nhất) | Để học tốt Ngữ Văn 11 (sách mới)
- Soạn văn 11 (ngắn nhất) | Để học tốt Ngữ văn 11 (sách mới)
- Tác giả tác phẩm Ngữ văn 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Văn mẫu 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Toán 11 | Giải bài tập Toán 11 Học kì 1, Học kì 2 (sách mới)
- Các dạng bài tập Toán lớp 11
- Lý thuyết Toán lớp 11 (sách mới) | Kiến thức trọng tâm Toán 11
- Giáo án Toán lớp 11 mới nhất
- Bài tập Toán lớp 11 mới nhất
- Chuyên đề Toán lớp 11 mới nhất
- Giải sgk Tiếng Anh 11 (thí điểm)
- Giải sgk Tiếng Anh 11 | Giải bài tập Tiếng anh 11 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Tiếng Anh 11 (sách mới) | Sách bài tập Tiếng Anh 11
- Giải sbt Tiếng Anh 11 (thí điểm)
- Giải sgk Lịch sử 11 | Giải bài tập Lịch sử 11 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Lịch Sử 11(sách mới) | Kiến thức trọng tâm Lịch Sử 11
- Giải Tập bản đồ Lịch sử 11
- Giải sgk Vật Lí 11 | Giải bài tập Vật lí 11 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 11 (sách mới) | Sách bài tập Vật Lí 11
- Lý thuyết Vật Lí 11 (sách mới) | Kiến thức trọng tâm Vật Lí 11
- Các dạng bài tập Vật Lí lớp 11
- Giáo án Vật lí lớp 11 mới nhất
- Giải sgk Sinh học 11 | Giải bài tập Sinh học 11 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Sinh học 11 (sách mới) | Kiến thức trọng tâm Sinh 11
- Giải sgk Giáo dục công dân 11
- Lý thuyết Giáo dục công dân 11
- Lý thuyết Địa Lí 11 (sách mới) | Kiến thức trọng tâm Địa lí 11
- Giải Tập bản đồ Địa Lí 11
- Giải sgk Giáo dục quốc phòng - an ninh 11
