Lý thuyết Cacbon (mới 2023 + Bài Tập) - Hóa học 11
Tóm tắt lý thuyết Hóa 11 Bài 15: Cacbon ngắn gọn, chi tiết sẽ giúp học sinh nắm vững kiến thức trọng tâm Hóa 11 Bài 15.
Lý thuyết Hóa 11 Bài 15: Cacbon
Bài giảng Hóa 11 Bài 15: Cacbon
I. Vị trí, cấu hình electron và tính chất vật lý
1. Vị trí và cấu hình electron nguyên tử
 Hình 1: Ô nguyên tố C
Hình 1: Ô nguyên tố C
- Cacbon ở ô thứ 6, chu kỳ 2, nhóm IVA của bảng tuần hoàn.
- Cấu hình e: 1s22s22p2 ⇒ C có 4 electron lớp ngoài cùng. Vì vậy C có thể tạo được tối đa 4 liên kết cộng hóa trị với các nguyên tử khác.
- Các số oxi hóa của C là: -4, 0, +2 và +4.
2. Tính chất vật lý
- C có ba dạng thù hình chính: Kim cương, than chì và fuleren.

Hình 2: Một số thù hình của cacbon
+ Kim cương là chất tinh thể trong suốt, không màu, không dẫn điện, dẫn nhiệt kém. Kim cương có cấu trúc tinh thể nguyên tử và cứng nhất trong tất cả các chất.
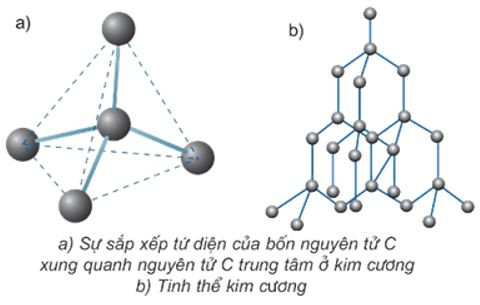
Hình 3: Mô hình cấu trúc tinh thể kim cương
+ Than chì là tinh thể màu xám đen, dẫn điện tốt nhưng kém kim loại. Tinh thể than chì có cấu trúc lớp.
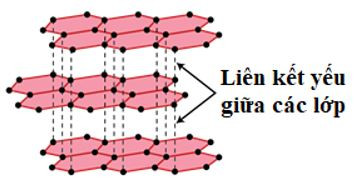
Hình 4: Tinh thể than chì
+ Fuleren gồm các phân tử C60, C70, … Phân tử C60 có cấu trúc rỗng, gồm 32 mặt, với 60 đỉnh là 60 nguyên tử C.
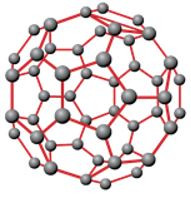
Hình 5: Phân tử fuleren C60.
- Ngoài ra, các than được điều chế nhân tạo (than gỗ, than xương,…) được gọi là cacbon vô định hình.
II. Tính chất hóa học
- Trong các dạng tồn tại của cacbon, cacbon vô định hình hoạt động hơn cả về mặt hóa học. Tuy nhiên, ở nhiệt độ thường cacbon khá trơ.
- Trong các phản ứng hóa học, cacbon thể hiện hai tính chất: Tính oxi hóa và tính khử. Tuy nhiên tính khử vẫn là chủ yếu của cacbon.
1. Tính khử
a) Tác dụng với oxi
Ở nhiệt độ cao, cacbon lại khử CO2 theo phản ứng:
b) Tác dụng với oxit kim loại
- C khử được oxit của các kim loại đứng sau Al trong dãy hoạt động hóa học của kim loại:
CuO + CCu + CO
Fe2O3 + 3C2Fe + 3CO
- Với CaO và Al2O3:
CaO + 3C→CaC2 + CO (trong lò điện)
2Al2O3 + 9CAl4C3 + 6CO
c) Tác dụng với các chất oxi hóa mạnh
- Cacbon tác dụng được với H2SO4 đặc, HNO3, KClO3, K2Cr2O7, ... trong các phản ứng này, C bị oxi hóa đến mức +4 (CO2).
C + 2H2SO4 đặcCO2 + 2SO2 + 2H2O
C + 4HNO3 đặcCO2 + 4NO2 + 2H2O
d) Khi nhiệt độ cao, C tác dụng được với hơi nước:
C + H2O CO + H2
2. Tính oxi hóa
a) Tác dụng với hiđro
b) Tác dụng với kim loại
(nhôm cacbua)
III. Trạng thái tự nhiên
- Kim cương và than chì là cacbon ở dạng tự do gần như tinh khiết.
- Cacbon còn có trong các khoáng vật như canxit (đá vôi, đá hoa, đá phấn đều chứa CaCO3), magiezit (MgCO3), đolomit (CaCO3.MgCO3).

Hình 6: Một số khoáng vật chứa cacbon
- Dầu mỏ, khí thiên nhiên là hỗn hợp của các chất khác nhau chứa cacbon.
- Cơ thể động thực vật cũng chứa nhiều hợp chất của cacbon.
IV. Ứng dụng và điều chế
1. Ứng dụng
- Kim cương được dùng làm đồ trang sức. Trong kĩ thuật, kim cương được dùng làm mũi khoan, dao cắt thuỷ tinh, bột mài.

Hình 7: Một số ứng dụng của kim cương
- Than chì được dùng làm điện cực; làm nồi, chén để nấu chảy các hợp kim chịu nhiệt; chế tạo chất bôi trơn; làm bút chì đen.

Hình 8: Một số ứng dụng của than chì
- Than cốc được dùng làm chất khử trong luyện kim để luyện kim loại từ quặng.

Hình 9: Than cốc
- Than gỗ được dùng để chế thuốc nổ đen, thuốc pháo,...

Hình 10: Than gỗ (than củi)
- Than hoạt tính là than có tính hấp phụ mạnh, được dùng trong mặt nạ phòng độc và công nghiệp hóa chất.

Hình 11: Than hoạt tính
- Than muội được dùng làm chất độn khi lưu hoá cao su, để sản xuất mực in, xi đánh giày.

Hình 12: Than muội
2. Điều chế
- Kim cương nhân tạo được điều chế bằng cách nung than chì ở 2000oC, áp suất từ 50 đến 100 nghìn atm, xúc tác là Fe, Cr, Ni.
- Than chì nhân tạo được điều chế bằng cách nung than cốc ở 2500 - 3000oC trong lò điện, không có không khí.
- Than cốc được điều chế bằng cách nung than mỡ khoảng 1000oC trong lò cốc, không có không khí.
- Than gỗ được tạo nên khi đốt cháy gỗ trong điều kiện thiếu không khí.
- Than mỏ được khai thác trực tiếp từ các vỉa than nằm sâu dưới mặt đất.
- Than muội được tạo nên khi nhiệt phân metan có chất xúc tác:
CH4C + 2H2↑
Trắc nghiệm Hóa 11 Bài 15: Cacbon
Câu 1: Khi đun nấu bằng than tổ ong thường sinh ra khí X không màu, không mùi, bền với nhiệt, hơi nhẹ hơn không khí và dễ gây ngộ độc đường hô hấp. Khí X là
A. N2.
B. CO2.
C. CO.
D. H2.
Đáp án: C
Giải thích: Khi đun nấu than tổ ong sẽ thường sinh ra CO2 và CO. Trong đó, khí CO là không màu, không mùi, bền với nhiệt, hơi nhẹ hơn không khí và dễ gây ngộ độc đường hô hấp.
Câu 2: Khi đốt rơm rạ trên các cánh đồng sau những vụ thu hoạch lúa sinh ra nhiều khói bụi, trong đó có khí X. Khí X nặng hơn không khí và gây hiệu ứng nhà kính. Khí X là
A. N2.
B. O2.
C. CO.
D. CO2.
Đáp án: D
Giải thích: Khí gây ra hiệu ứng nhà kính là khí CO2.
Câu 3: Cho hơi nước đi qua than nóng đỏ, sau phản ứng thu được V lít (ở đktc) hỗn hợp khí X gồm CO, CO2 và H2. Dẫn toàn bộ hỗn hợp X qua dung dịch Ca(OH)2 thu được 2 gam kết tủa và khối lượng dung dịch sau phản ứng giảm 0,68 gam so với khối lượng dung dịch Ca(OH)2 ban đầu; khí còn lại thoát ra gồm CO và H2 có tỉ khối hơi so với H2 là 3,6. Giá trị của V là
A. 2,688.
B. 2,912.
C. 3,360.
D. 3,136.
Đáp án: B
Giải thích:
Ta có:
Ta có phương trình hóa học:
C + H2O CO + H2
C + 2H2O CO2 + 2H2
Gọi số mol của CO là x mol
→ nkhí =
lít
Câu 4: Cacbon có khả năng phản ứng với tất cả các chất trong dãy các chất nào sau đây?
A. CO2, Fe2O3, Na2O, CuO, HNO3 đặc, H2SO4 đặc.
B. CO2, Fe2O3, Na, CuO, HNO3 đặc, H2SO4 đặc, H2.
C. CaO, H2O, CO2, Fe2O3, Na2O, CuO, HNO3 đặc, H2SO4 đặc.
D. PbO, CO2, Fe2O3, Na2O, CuO, Al2O3, H2, HCl đặc.
Đáp án: B
Giải thích: C không phản ứng được với Na2O.
Câu 5: Khí X tạo ra trong quá trình đốt cháy nhiên liệu hóa thạch, gây hiệu ứng nhà kính. Trồng nhiều cây xanh sẽ làm giảm nồng độ khí X trong không khí. Khí X là
A. N2.
B. H2.
C. CO2.
D. O2.
Đáp án: C
Giải thích:
Khí X tạo ra trong quá trình đốt cháy nhiên liệu hóa thạch, gây hiệu ứng nhà kính → X là CO2.
Trồng nhiều cây xanh sẽ làm giảm nồng độ khí CO2 trong không khí do cây xanh cần CO2 để quang hợp.
Câu 6: Cacbon vô định hình được điều chế từ than gỗ hay gáo dừa thường gọi là than hoạt tính. Tính chất nào sau đây của than hoạt tính khiến nó được sử dụng để chế tạo các thiết bị phòng độc, lọc nước?
A. Hấp phụ các chất khí, chất tan trong nước.
B. Khử các chất khí độc, các chất tan trong nước.
C. Đốt cháy than sinh ra khí cacbonic.
D. Bám trên bề mặt các chất độc và chất tan ngăn cản độc tính.
Đáp án: A
Giải thích: Than hoạt tính có khả năng hấp phụ mạnh các chất khí, chất tan trong nước nên được sử dụng để chế tạo các thiết bị phòng độc, lọc nước.
Câu 7: Kim cương và than chì là các dạng:
A. đồng hình của cacbon.
B. đồng vị của cacbon.
C. thù hình của cacbon.
D. đồng phân của cacbon.
Đáp án: C
Giải thích: Kim cương và than chì là các dạng thù hình của cacbon.
Câu 8: Cho cacbon lần lượt tác dụng với Al, H2O, CuO, HNO3 đặc, H2SO4 đặc, KClO3, CO2 ở điều kiện thích hợp. Số phản ứng mà trong đó C đóng vai trò là chất khử:
A. 4
B. 6
C. 7
D. 5
Đáp án: B
Giải thích: Tính khử của C thể hiện khi tác dụng với oxi, CO2, H2O, oxit kim loại và các chất oxi hóa mạnh như HNO3, H2SO4 đặc, KClO3,…
Câu 9: Chất nào sau đây không tác dụng trực tiếp với C:
A. Cl2
B. CO2
C. H2O
D. O2
Đáp án: A
Giải thích:
Cl2 không tác dụng trực tiếp với C.
CO2 + C 2CO
H2O + C CO + H2
O2 + C CO2
Câu 10: Trong những nhận xét dưới đây, nhận xét nào không đúng ?
A. Khi đốt cháy cacbon, phản ứng tỏa nhiều nhiệt, sản phẩm thu được chỉ là khí cacbonic.
B. Than chì mềm do có cấu trúc lớp, các lớp lân cận liên kết với nhau bằng lực tương tác yếu.
C. Kim cương là cacbon hoàn toàn tinh khiết, trong suốt, không màu, không dẫn điện.
D. Than gỗ, than xương có khả năng hấp phụ các chất khí và chất tan trong dung dịch.
Đáp án: A
Giải thích:
Cacbon cháy tỏa nhiều nhiệt, ban đầu tạo CO2. Nếu C dư, C sẽ khử CO2 thành CO
C + O2 CO2
C + CO2 2CO
Xem thêm các bài tổng hợp lý thuyết Hóa học lớp 11 đầy đủ, chi tiết khác:
Lý thuyết Bài 16: Hợp chất của cacbon
Lý thuyết Bài 17: Silic và hợp chất của silic
Lý thuyết Bài 18: Công nghiệp silicat
Lý thuyết Bài 19: Luyện tập: Tính chất của cacbon, silic và hợp chất của chúng
Xem thêm các chương trình khác:
- Tóm tắt tác phẩm Ngữ văn 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Soạn văn 11 (hay nhất) | Để học tốt Ngữ Văn 11 (sách mới)
- Soạn văn 11 (ngắn nhất) | Để học tốt Ngữ văn 11 (sách mới)
- Tác giả tác phẩm Ngữ văn 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Văn mẫu 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Toán 11 | Giải bài tập Toán 11 Học kì 1, Học kì 2 (sách mới)
- Các dạng bài tập Toán lớp 11
- Lý thuyết Toán lớp 11 (sách mới) | Kiến thức trọng tâm Toán 11
- Giáo án Toán lớp 11 mới nhất
- Bài tập Toán lớp 11 mới nhất
- Chuyên đề Toán lớp 11 mới nhất
- Giải sgk Tiếng Anh 11 (thí điểm)
- Giải sgk Tiếng Anh 11 | Giải bài tập Tiếng anh 11 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Tiếng Anh 11 (sách mới) | Sách bài tập Tiếng Anh 11
- Giải sbt Tiếng Anh 11 (thí điểm)
- Giải sgk Lịch sử 11 | Giải bài tập Lịch sử 11 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Lịch Sử 11(sách mới) | Kiến thức trọng tâm Lịch Sử 11
- Giải Tập bản đồ Lịch sử 11
- Giải sgk Vật Lí 11 | Giải bài tập Vật lí 11 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 11 (sách mới) | Sách bài tập Vật Lí 11
- Lý thuyết Vật Lí 11 (sách mới) | Kiến thức trọng tâm Vật Lí 11
- Các dạng bài tập Vật Lí lớp 11
- Giáo án Vật lí lớp 11 mới nhất
- Giải sgk Sinh học 11 | Giải bài tập Sinh học 11 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Sinh học 11 (sách mới) | Kiến thức trọng tâm Sinh 11
- Giải sgk Giáo dục công dân 11
- Lý thuyết Giáo dục công dân 11
- Lý thuyết Địa Lí 11 (sách mới) | Kiến thức trọng tâm Địa lí 11
- Giải Tập bản đồ Địa Lí 11
- Giải sgk Giáo dục quốc phòng - an ninh 11
