Lý thuyết Ancol (mới 2024 + Bài Tập) - Hóa học 11
Tóm tắt lý thuyết Hóa 11 Bài 40 : Ancol ngắn gọn, chi tiết sẽ giúp học sinh nắm vững kiến thức trọng tâm Hóa 11 Bài 40.
Lý thuyết Hóa 11 Bài 40 : Ancol
Bài giảng Hóa 11 Bài 40 : Ancol
I. Định nghĩa – phân loại
1. Định nghĩa
- Ancol là những hợp chất hữu cơ, trong phân tử có nhóm hiđroxyl – OH liên kết trực tiếp với nguyên tử cacbon no.
- Nhóm OH này được gọi là nhóm – OH ancol.
- Ví dụ một số ancol:
CH3CH2OH; CH2 = CH – CH2 – OH; C6H5 – CH2 – OH.
- Công thức tổng quát của ancol: R(OH)n (n ≥ 1), với R là gốc hiđrocacbon.
- Công thức của ancol no, mạch thẳng, đơn chức: CnH2n+1OH hay CnH2n+2O (với n ≥ 1).
2. Phân loại
- Dựa vào đặc điểm gốc hiđrocacbon, các ancol được chia thành:
+ Ancol no. Ví dụ: CH3OH; CH2OH – CH2OH …
+ Ancol không no. Ví dụ: CH2 = CH – CH2 – OH …
+ Ancol thơm (phân tử có vòng benzen). Ví dụ: C6H5 – CH2 – OH…
- Dựa vào số nhóm OH trong phân tử, ancol được chia thành:
+ Ancol đơn chức: CH3OH; CH2 = CH – CH2 – OH …
+ Ancol đa chức: CH2OH – CH2OH; CH2OH – CH(OH) – CH2OH …
- Các ancol còn được phân loại theo bậc ancol. Bậc của ancol được xác định bằng bậc của nguyên tử C liên kết với nhóm -OH.
II. Đồng phân, danh pháp
1. Đồng phân
Các ancol no, mạch hở, đơn chức có đồng phân mạch cacbon và đồng phân vị trí nhóm chức – OH trong mạch cacbon.
Ví dụ: C4H10O có các đồng phân ancol như sau:
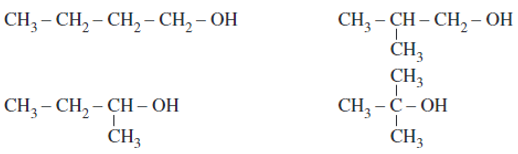
2. Danh pháp
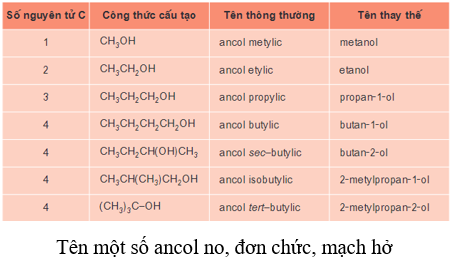
a) Tên thông thường
- Một số ít ancol có tên thông thường.
- Tên thông thường = Ancol + tên gốc ankyl+ ic.
Ví dụ:
CH3-CH2-OH: ancol etylic.
CH3-OH: ancol metylic.
b) Tên thay thế
Các bước gọi tên thay thế:
-Chọn mạch chính của phân tử ancol là mạch dài nhất có chứa nhóm -OH.
- Đánh số thứ tự nguyên tử cacbon trên mạch chính bắt đầu từ phía gần nhóm -OH hơn.
- Tên thay thế = tên hiđrocacbon tương ứng với mạch chính + số chỉ vị trí nhóm OH + ol.
- Ví dụ:
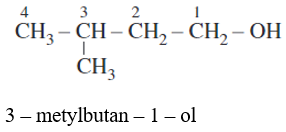
III – Tính chất vật lý
- Các ancol là chất lỏng hoặc chất rắn ở điều kiện thường.
- Nhiệt độ sôi, khối lượng riêng của các ancol tăng theo chiều tăng của phân tử khối, ngược lại độ tan trong nước của chúng lại giảm khi phân tử khối tăng.
- Các ancol có nhiệt độ sôi cao hơn các hiđcacbon có cùng phân tử khối hoặc đồng phân ete của nó là do giữa các phân tử ancol có liên kết hiđro ⇒ Ảnh hưởng đến độ tan.
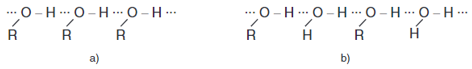
Liên kết hiđro giữa các phân tử ancol với nhau (a) và với nước (b)
IV. Tính chất hóa học
Trong phân tử ancol liên kết C – OH, đặc biệt liên kết O – H phân cực mạnh nên nhóm – OH nhất là nguyên tử H dễ bị thay thế hoặc tách ra trong các phản ứng hóa học.
1. Phản ứng thế H của nhóm OH ancol (phản ứng đặc trưng của ancol)
- Tính chất chung của ancol tác dụng với kim loại kiềm:
Ví dụ:
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2
Tổng quát:
+ Với ancol đơn chức:
2ROH + 2Na → 2RONa + H2↑
+ Với ancol đa chức:
2R(OH)x + 2xNa → 2R(ONa)x + xH2↑
- Tính chất đặc trưng của glixerol hòa tan Cu(OH)2
Ví dụ:
2C3H5(OH)3 + Cu(OH)2 → [C3H5(OH)2O]2Cu + 2H2O
Không chỉ glixerol, các ancol đa chức có các nhóm – OH liền kề cũng có tính chất này.
⇒ Phản ứng này dùng để phân biệt ancol đơn chức với ancol đa chức có các nhóm - OH cạnh nhau trong phân tử.
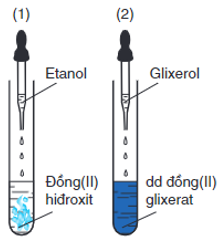
Thí nghiệm về phản ứng đặc trưng của glixerol
2. Phản ứng thế nhóm OH
a) Phản ứng với axit vô cơ:
Ví dụ:
C2H5OH + HBr C2H5Br + H2O
Các ancol khác cũng có phản ứng tương tự, phản ứng này chứng tỏ phân tử ancol có nhóm – OH.
b) Phản ứng với ancol
Ví dụ:
2C2H5OH C2H5OC2H5 + H2O
C2H5OC2H5: đietyl ete
⇒ Công thức tính số ete tạo thành từ n ancol khác nhau là
3. Phản ứng tách nước (phản ứng đehidrat hoá)
Ví dụ:
CH3CH2OH CH2 = CH2 + H2O
Trong điều kiện tương tự, các ancol no, đơn chức, mạch hở (trừ CH3OH) có thể bị tách nước tạo thành anken. Tổng quát:
CnH2n + 1OH CnH2n + H2O
4. Phản ứng oxi hoá
- Phản ứng oxi hoá hoàn toàn:
Khi bị đốt các ancol cháy, tỏa nhiều nhiệt. Tổng quát cho đốt cháy ancol no, đơn chức, mạch hở:
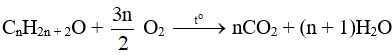
- Phản ứng oxi hoá không hoàn toàn bởi CuO, to
+ Các ancol bậc I bị oxi hóa không hoàn toàn tạo thành anđehit. Ví dụ:
CH3CH2OH + CuO CH3CHO (anđehit axetic) + Cu + H2O
+ Các ancol bậc II bị oxi hóa không hoàn toàn tạo thành xeton. Ví dụ:
CH3- CH(OH) – CH3 + CuO CH3 – CO – CH3 + Cu + H2O
+ Trong điều kiện trên, ancol bậc III không phản ứng.
V. Điều chế
a. Phương pháp tổng hợp
Anken + H2O ancol
Ví dụ:
CH2 = CH2 + H2O CH3 – CH2 – OH
b. Phương pháp sinh hoá: từ tinh bột, đường, ... lên men.
(C6H10O5)n C6H12O6 C2H5OH
VI. Ứng dụng
Etanol có nhiều ứng dụng trong nhiều lĩnh vực, thể hiện trong hình dưới đây:

Trắc nghiệm Hóa học lớp 11 Bài 40: Ancol
Câu 1: Công thức nào đúng với tên gọi tương ứng?
A. ancol sec-butylic: (CH3)2CH-CH2OH
B. ancol iso-amylic: (CH3)2CHCH2CH2CH2OH
C. ancol etylic: CH3OH
D. ancol anlylic: CH2=CHCH2OH
Đáp án: D
Câu 2: Rượu pha chế dùng cồn công nghiệp có chứa hàm lượng metanol cao, có thể gây ngộ độc nguy hiểm đến tính mạng. Công thức phân tử của metanol là
A. C2H5OH
B. C3H5OH
C. CH3OH
D. C3H7OH
Đáp án: C
Giải thích: Metanol: CH3OH.
Câu 3: Phản ứng nào sau đây không xảy ra:
A. C2H5OH + CH3COOH
B. C2H5OH + HBr
C. C2H5OH + O2
D. C2H5OH + NaOH
Đáp án: D
Giải thích:
C2H5OH không có tính bazơ, không phản ứng với NaOH.
Câu 4: Độ rượu là
A. Số ml rượu nguyên chất có trong 100 ml dung dịch rượu.
B. Số ml rượu nguyên chất có trong 100 gam dung dịch rượu.
C. Khối lượng rượu nguyên chất có trong 100 gam dung dịch rượu.
D. Khối lượng rượu nguyên chất có trong 100 ml dung dịch rượu.
Đáp án: A
Giải thích: Độ rượu là số ml rượu nguyên chất có trong 100 ml hỗn hợp rượu với nước (dung dịch rượu).
Câu 5: Điều kiện của phản ứng tách nước :
CH3-CH2-OH CH2 = CH2 + H2O là :
A. H2SO4 đặc, 120oC
B. H2SO4 loãng, 140oC
C. H2SO4 đặc, 170oC
D. H2SO4 đặc, 140oC
Đáp án: C
Giải thích: CH3-CH2-OH CH2 = CH2 + H2O
Câu 6: Cho Na tác dụng vừa đủ với 1,24 gam hỗn hợp 3 ancol đơn chức X, Y, Z thấy thoát ra 0,336 lít khí H2 (đkc). Khối lượng muối natri ancolat thu được là :
A. 2,4 gam.
B. 1,9 gam.
C. 2,85 gam.
D. 3,8 gam
Đáp án: B
Giải thích:
Số mol khí H2 =
Đặt công thức phân tử trung bình của ba ancol là .
Phương trình phản ứng :
2 + 2Na 2 + H2 (1)
mol: 0,03 0,015
Theo giả thiết, phương trình phản ứng (1), kết hợp với định luật bảo toàn khối lượng ta có:
= 1,24 + 0,03.23 – 0,015.2
= 1,9 gam.
Câu 7: Cho 0,1 lít cồn etylic 95o tác dụng với Na dư thu được V lít khí H2 (đktc). Biết rằng ancol etylic nguyên chất có khối lượng riêng là 0,8 g/ml, khối lượng riêng của nước là 1 g/ml. Giá trị của V là
A. 43,23 lít.
B. 37 lít.
C. 18,5 lít.
D. 21,615 lít
Đáp án: D
Giải thích:
Trong 0,1 lít cồn etylic 95o có:
Số ml C2H5OH nguyên chất = 0,1.1000.0,95 = 95 ml;
Khối lượng C2H5OH nguyên chất = 95.0,8 = 76 gam;
Số mol C2H5OH = mol.
Số ml nước = 5 ml; khối lượng nước = 5.1 = 5 gam; số mol nước = mol.
Phương trình phản ứng của Na với dung dịch ancol :
2H2O + 2Na 2NaOH + H2 (1)
2C2H5OH + 2Na 2C2H5ONa +H2 (2)
Theo phương trình (1), (2) và giả thiết ta có :
lít.
Câu 8: 13,8 gam ancol A tác dụng với Na dư giải phóng 5,04 lít H2 ở đktc, biết MA < 100. Vậy A có công thức cấu tạo thu gọn là
A. CH3OH.
B. C2H5OH.
C. C3H6(OH)2.
D. C3H5(OH)3
Đáp án: D
Giải thích:
Đặt công thức của ancol là R(OH)n.
Phương trình phản ứng:
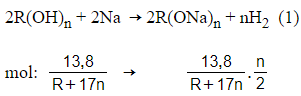
Theo (1) và giả thiết ta có :
Vậy A có công thức cấu tạo thu gọn là C3H5(OH)3.
Câu 9: Cho 15,6 gam hỗn hợp hai ancol (rượu) đơn chức, kế tiếp nhau trong dãy đồng đẳng tác dụng hết với 9,2 gam Na, thu được 24,5 gam chất rắn. Hai ancol đó là
A. C3H5OH và C4H7OH
B. C2H5OH và C3H7OH
C. C3H7OH và C4H9OH
D. CH3OH và C2H5OH
Đáp án: B
Giải thích:
Đặt công thức trung bình của hai ancol là
Phản ứng hóa học:
+ Na +
Áp dụng định luật bảo toàn khối lượng cho phản ứng, ta có:
gam,
mol
,
Ta thấy 29 < < 43
Hai ancol là: C2H5OH và C3H7OH
Câu 10: Có hai thí nghiệm sau :
Thí nghiệm 1: Cho 6 gam ancol, mạch hở, đơn chức A tác dụng với m gam Na, thu được 0,075 gam H2
Thí nghiệm 2: Cho 6 gam ancol, mạch hở, đơn chức A tác dụng với 2m gam Na, thu được không tới 0,1 gam H2.
A có công thức là
A. CH3OH.
B. C2H5OH.
C. C3H7OH.
D. C4H7OH
Đáp án: D
Giải thích:
Cùng lượng ancol phản ứng nhưng ở thí nghiệm 2 thu được nhiều khí H2 hơn, chứng tỏ ở thí nghiệm 1 ancol còn dư, Na phản ứng hết.
Ở thí nghiệm 2 lượng Na dùng gấp đôi ở thí nghiệm 1 nhưng lượng H2 thu được ở thí nghiệm 2 nhỏ hơn 2 lần lượng H2 ở thí nghiệm 1, chứng tỏ ở thí nghiệm 2 Na dư, ancol phản ứng hết.
Đặt công thức phân tử của ancol là ROH, phương trình phản ứng :
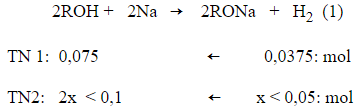
Vì ở thí nghiệm 1 ancol dư nên số mol ancol > 0,075, suy ra khối lượng mol của ancol < gam/mol. Ở thí nghiệm 2 số mol H2 thu được không đến 0,05 nên số mol ancol < 0,1, suy ra khối lượng mol của ancol > gam/mol. Vậy căn cứ vào các phương án ta suy ra công thức phân tử của ancol là C4H7OH (M = 72 gam/mol).
Xem thêm các bài tổng hợp lý thuyết Hóa học lớp 11 đầy đủ, chi tiết khác:
Lý thuyết Bài 42: Luyện tập: Dẫn xuất halogen, ancol và phenol
Lý thuyết Bài 44: Anđehit – Xeton
Lý thuyết Bài 45: Axit cacboxylic
Lý thuyết Bài 46: Luyện tập: Anđehit – Xeton – Axit cacboxylic
Xem thêm các chương trình khác:
- Tóm tắt tác phẩm Ngữ văn 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Soạn văn 11 (hay nhất) | Để học tốt Ngữ Văn 11 (sách mới)
- Soạn văn 11 (ngắn nhất) | Để học tốt Ngữ văn 11 (sách mới)
- Tác giả tác phẩm Ngữ văn 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Văn mẫu 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Toán 11 | Giải bài tập Toán 11 Học kì 1, Học kì 2 (sách mới)
- Các dạng bài tập Toán lớp 11
- Lý thuyết Toán lớp 11 (sách mới) | Kiến thức trọng tâm Toán 11
- Giáo án Toán lớp 11 mới nhất
- Bài tập Toán lớp 11 mới nhất
- Chuyên đề Toán lớp 11 mới nhất
- Giải sgk Tiếng Anh 11 (thí điểm)
- Giải sgk Tiếng Anh 11 | Giải bài tập Tiếng anh 11 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Tiếng Anh 11 (sách mới) | Sách bài tập Tiếng Anh 11
- Giải sbt Tiếng Anh 11 (thí điểm)
- Giải sgk Lịch sử 11 | Giải bài tập Lịch sử 11 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Lịch Sử 11(sách mới) | Kiến thức trọng tâm Lịch Sử 11
- Giải Tập bản đồ Lịch sử 11
- Giải sgk Vật Lí 11 | Giải bài tập Vật lí 11 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 11 (sách mới) | Sách bài tập Vật Lí 11
- Lý thuyết Vật Lí 11 (sách mới) | Kiến thức trọng tâm Vật Lí 11
- Các dạng bài tập Vật Lí lớp 11
- Giáo án Vật lí lớp 11 mới nhất
- Giải sgk Sinh học 11 | Giải bài tập Sinh học 11 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Sinh học 11 (sách mới) | Kiến thức trọng tâm Sinh 11
- Giải sgk Giáo dục công dân 11
- Lý thuyết Giáo dục công dân 11
- Lý thuyết Địa Lí 11 (sách mới) | Kiến thức trọng tâm Địa lí 11
- Giải Tập bản đồ Địa Lí 11
- Giải sgk Giáo dục quốc phòng - an ninh 11
