Lý thuyết Sự điện li của nước. pH. Chất chỉ thị axit – bazơ (mới 2023 + Bài Tập) - Hóa học 11
Tóm tắt lý thuyết Hóa 11 Bài 3: Sự điện li của nươc. pH. Chất chỉ thị axit - bazo ngắn gọn, chi tiết sẽ giúp học sinh nắm vững kiến thức trọng tâm Hóa 11 Bài 3.
Lý thuyết Hóa 11 Bài 3: Sự điện li của nước. pH. Chất chỉ thị axit – bazơ
Bài giảng Hóa 11 Bài 3: Sự điện li của nước. pH. Chất chỉ thị axit – bazơ
I. Nước là chất điện li rất yếu
1. Sự điện li của nước
- Nước là chất điện li rất yếu. Thực nghiệm đã xác định được ở nhiệt độ thường cứ 555 triệu phân tử nước chỉ có 1 phân tử phân li ra ion.
- Phương trình điện li:
2. Tích số ion của nước
- Ở 25oC, tích số = [H+].[OH-] được gọi là tích số ion của nước. Tích số này là hằng số ở nhiệt độ xác định. Tuy nhiên, giá trị tích số ion của nước thường được dùng trong các phép tính, khi nhiệt độ không khác nhiều so với 25oC.
= [H+].[OH-] = 10-14
⇒ [H+] = [OH-] = 10-7 M.
- Môi trường trung tính là môi trường trong đó:
[H+] = [OH-] = 10-7 M.
3. Ý nghĩa tích số ion của nước
a. Môi trường axit
- Là môi trường trong đó
[H+] > [OH-] hay [H+] > 10-7 M.
b. Môi trường kiềm
- Là môi trường trong đó
[H+] < [OH-] hay [H+] < 10-7 M.
Kết luận: Độ axit và độ kiềm của dung dịch có thể đánh giá bằng nồng độ H+.
+ Môi trường trung tính: [H+] = 10-7 M.
+ Môi trường axit: [H+] > 10-7 M.
+ Môi trường kiềm: [H+] < 10-7 M.
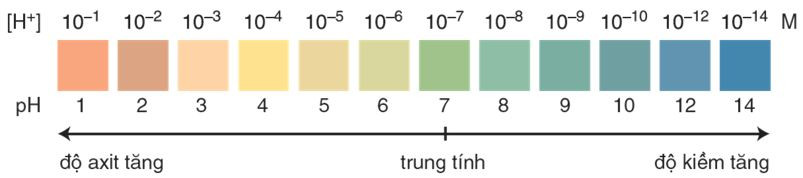
II. Khái niệm về pH. Chất chỉ thị axit – bazơ
1. Khái niệm về pH
- pH được dùng để đánh giá độ axit và độ kiềm của dung dịch.
- Quy ước:
Tức là: thì pH = a.
Về mặt toán học:
- Thang pH thường dùng có giá trị từ 1 đến 14, trong đó:
+ pH < 7: môi trường axit.
+ pH > 7: môi trường bazơ.
+ pH = 7: môi trường trung tính.
- Giá trị của pH có ý nghĩa to lớn trong thực tế. Chẳng hạn, pH của máu người và động vật có giá trị gần như không đổi hay tốc độ ăn mòn kim mòn kim loại trong nước tự nhiên phụ thuộc rất nhiều vào giá trị pH của nước.
2. Chất chỉ thị axit – bazơ
- Là chất có màu biến đổi phụ thuộc vào giá trị pH của dung dịch.
Ví dụ: Quỳ tím, phenolphatalenin.
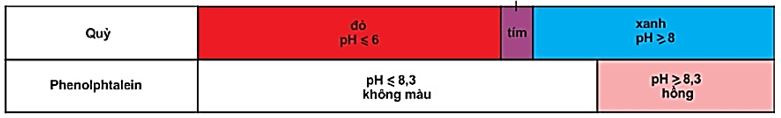
Hình 1: Màu của quỳ và phenolphtalein trong dung dịch ở các khoảng pH khác nhau
- Trộn lẫn một số chất chỉ thị có màu biến đổi kế tiếp nhau theo giá trị pH, ta được hỗn hợp chất chỉ thị vạn năng.
Hình 2: Màu của chất chỉ thị vạn năng (thuốc thử MERCK của Đức) ở các giá trị pH khác nhau
- Để xác định tương đối chính xác giá trị pH của dung dịch, người ta dùng máy đo pH.
3. Bảng công thức pH trong các môi trường

Trắc nghiệm Hóa 11 Bài 3: Sự điện li của nước. pH. Chất chỉ thị axit-bazơ
Câu 1: Dung dịch X chứa HCl với nồng độ mol là 0,01M. pH của dung dịch là:
A. 1.
B. 2.
C. 3.
D. 4.
Đáp án: B
Giải thích:
HCl là một axit mạnh, điện li hoàn toàn nên ta có:
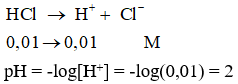
Câu 2: Dung dịch nào sau đây có pH bằng 7?
A.
B.
C. NaOH 1M
D. KCL 1M
Đáp án: D
Giải thích:
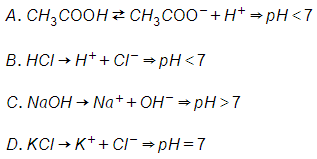
Câu 3: Cho các dung dịch có cùng nồng độ: Na2CO3 (1), H2SO4 (2), HCl (3), KNO3 (4). Giá trị pH của các dung dịch được sắp xếp theo chiều tăng từ trái sang phải là:
A. (3), (2), (4), (1).
B. (4), (1), (2), (3).
C. (1), (2), (3), (4).
D. (2), (3), (4), (1).
Đáp án: D
Giải thích:
H2SO4, HCl là axit
→ pH < 7, trong đó pH của axit H2SO4 < pH của axit HCl vì nồng độ H lớn hơn khi hai axit cùng nồng độ.
KNO3 là muối trung hòa tạo bởi kim loại mạnh và gốc axit mạnh
→ pH = 7
Dung dịch Na2CO3 có môi trường bazơ do tạo bởi kim loại mạnh và gốc axit yếu
→ pH > 7
→ Giá trị pH tăng dần: (2), (3), (4), (1).
Câu 4: Chọn câu trả lời sai :
A. Dung dịch pH = 7 có môi trường trung tính.
B. Dung dịch pH < 7 làm quỳ tím hóa đỏ.
C. Giá trị pH tăng thì độ axit tăng.
D. Giá trị [H+] tăng thì độ axit tăng.
Đáp án: C
Giải thích:
pH tăng → nồng độ [H+] giảm
→ độ axit giảm.
Câu 5: Axit mạnh HNO3 và axit yếu HNO2 có cùng nồng độ mol 0,1M và ở cùng nhiệt độ. Sự so sánh nồng độ mol ion nào sau đây là đúng?
A. [] của HNO3 < [ ] của HNO2.
B. [] của HNO3 > [] của HNO2.
C. [] của HNO3 = [] của HNO2.
D. [] của HNO3 < [] của HNO2.
Đáp án: B
Giải thích:
HNO3 là axit mạnh → là chất điện li mạnh → phân li hoàn toàn ra ion.
HNO2 là axit yếu → là chất điện li yếu → phân li không hoàn toàn ra ion.
→ [ ] của HNO3 > [ ] của HNO2.
Câu 6: Một dung dịch có [ ] M, đánh giá nào dưới đây là đúng?
A. pH = 3.
B. pH = 4.
C. pH < 3.
D. pH > 4.
Đáp án: D
Giải thích:
[ ] =
→ pH = 14 + lg[ ] = 11,62
Câu 7: Cho a lít dung dịch KOH có pH = 12 vào 8 lít dung dịch HCl có pH = 3 thu được dung dịch Y có pH = 11. Giá trị của a là:
A. 0,12.
B. 1,6.
C. 1,78.
D. 0,8.
Đáp án: C
Giải thích:
a lít dung dịch KOH có pH = 12
→ [ ] = 0,01M
→
8 lít dung dịch HCl có pH = 3
→ [ ] = 0,001M
→
Sau khi trộn thu được dung dịch Y có pH =11
→ [ ] = 0,001M
→
→ 0,001(a + 8) = 0,01a – 0,008
→ a = 1,78
Câu 8: Dung dịch axit mạnh H2SO4 0,1M có:
A. pH = 1.
B. pH > 1.
C. pH < 1.
D. [H+] > 0,2M.
Đáp án: C
Giải thích:
H2SO4
→ [H+] = 0,2M
→ pH = lg[H+] = 0,7
Câu 9: Dung dịch X gồm NaOH 0,1M và Ba(OH)2 0,2M. Thể tích dung dịch H2SO4 0,5M cần dùng để trung hòa hết 100 ml dung dịch X là:
A. 50 ml.
B. 100 ml.
C. 150 ml.
D. 200 ml.
Đáp án: A
Giải thích:
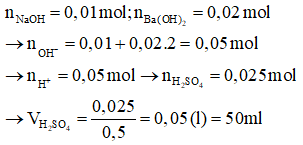
Câu 10: Một dung dịch có pH = 5, đánh giá nào dưới đây là đúng?
A. [] = 2.10-5M.
B. [] = 5.10-4M.
C. [] = 10-5M.
D. [] = 10-4M.
Đáp án: C
Giải thích: pH = 5 → [H+] = 10-5 M
Xem thêm các bài tổng hợp lý thuyết Hóa học lớp 11 đầy đủ, chi tiết khác:
Lý thuyết Bài 4: Phản ứng trao đổi ion trong dung dịch các chất điện li
Xem thêm các chương trình khác:
- Tóm tắt tác phẩm Ngữ văn 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Soạn văn 11 (hay nhất) | Để học tốt Ngữ Văn 11 (sách mới)
- Soạn văn 11 (ngắn nhất) | Để học tốt Ngữ văn 11 (sách mới)
- Tác giả tác phẩm Ngữ văn 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Văn mẫu 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Toán 11 | Giải bài tập Toán 11 Học kì 1, Học kì 2 (sách mới)
- Các dạng bài tập Toán lớp 11
- Lý thuyết Toán lớp 11 (sách mới) | Kiến thức trọng tâm Toán 11
- Giáo án Toán lớp 11 mới nhất
- Bài tập Toán lớp 11 mới nhất
- Chuyên đề Toán lớp 11 mới nhất
- Giải sgk Tiếng Anh 11 (thí điểm)
- Giải sgk Tiếng Anh 11 | Giải bài tập Tiếng anh 11 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Tiếng Anh 11 (sách mới) | Sách bài tập Tiếng Anh 11
- Giải sbt Tiếng Anh 11 (thí điểm)
- Giải sgk Lịch sử 11 | Giải bài tập Lịch sử 11 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Lịch Sử 11(sách mới) | Kiến thức trọng tâm Lịch Sử 11
- Giải Tập bản đồ Lịch sử 11
- Giải sgk Vật Lí 11 | Giải bài tập Vật lí 11 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 11 (sách mới) | Sách bài tập Vật Lí 11
- Lý thuyết Vật Lí 11 (sách mới) | Kiến thức trọng tâm Vật Lí 11
- Các dạng bài tập Vật Lí lớp 11
- Giáo án Vật lí lớp 11 mới nhất
- Giải sgk Sinh học 11 | Giải bài tập Sinh học 11 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Sinh học 11 (sách mới) | Kiến thức trọng tâm Sinh 11
- Giải sgk Giáo dục công dân 11
- Lý thuyết Giáo dục công dân 11
- Lý thuyết Địa Lí 11 (sách mới) | Kiến thức trọng tâm Địa lí 11
- Giải Tập bản đồ Địa Lí 11
- Giải sgk Giáo dục quốc phòng - an ninh 11