Lý thuyết Luyện tập: Anđehit – Xeton – Axit cacboxylic (mới 2023 + Bài Tập) - Hóa học 11
Tóm tắt lý thuyết Hóa 11 Bài 46: Luyện tập: Anđehit – Xeton – Axit cacboxylic ngắn gọn, chi tiết sẽ giúp học sinh nắm vững kiến thức trọng tâm Hóa 11 Bài 46.
Lý thuyết Hóa 11 Bài 46: Luyện tập: Anđehit – Xeton – Axit cacboxylic
Bài giảng Hóa 11 Bài 46: Luyện tập: Anđehit – Xeton – Axit cacboxylic
Kiến thức cần nắm vững
1. Các định nghĩa
- Anđehit là những hợp chất hữu cơ mà phân tử có nhóm – CH = O (hay – CHO) liên kết trực tiếp với nguyên tử cacbon hoặc nguyên tử hiđro. Anđehit no, mạch hở, đơn chức có công thức cấu tạo thu gọn CxH2x+1CHO (x ≥ 0) hay CTPT chung CnH2nO (n ≥ 1).
- Xeton là những hợp chất hữu cơ mà phân tử có nhóm ![]() liên kết trực tiếp với hai nguyên tử cacbon.
liên kết trực tiếp với hai nguyên tử cacbon.
- Axit cacboxylic là những hợp chất hữu cơ mà phân tử có nhóm cacboxyl (-COOH) liên kết trực tiếp với nguyên tử cacbon hoặc nguyên tử hiđro. Axit no, đơn chức mạch hở, tổng quát (thường gặp): CnH2n+1COOH (n ≥ 0) hay CmH2mO2 (m ≥ 1)
2. Tính chất
a) Anđehit có tính oxi hóa và tính khử
- Tính oxi hóa
RCHO + H2 RCH2OH
RCHO + 2AgNO3 + H2O + 3NH3 RCOONH4 + 2NH4NO3 + 2Ag↓
2RCHO + O2 2RCOOH
b) Xeton có tính oxi hóa
R – CO – R1 + H2 R – CH(OH) – R1
c) Axit cacboxylic có tính chất chung của axit
- Trong dung dịch, axit cacboxylic phân li thuận nghịch:
CH3COOH ⇄ H+ + CH3COO-
Dung dịch axit cacboxylic làm quỳ tím chuyển sang màu đỏ
- Tác dụng với bazơ, oxit bazơ tạo thành muối và nước. Ví dụ:
CH3COOH + NaOH → CH3COONa + H2O
2CH3COOH + ZnO → (CH3COO)2Zn + H2O
- Tác dụng với muối:
2CH3COOH + CaCO3 → (CH3COO)2Ca + H2O + CO2
- Tác dụng với kim loại trước hiđro:
2CH3COOH + Zn → (CH3COO)2Zn + H2
- Ngoài ra, axit cacboxylic tác dụng được với ancol để tạo thành este:
RCOOH + R’OHRCOOR’ + H2O
3. Điều chế
a) Điều chế anđehit
- Oxi hóa ancol bậc I, được anđehit tương ứng:
RCH2OH + CuO RCHO + Cu + H2O
- Oxi hóa metan có xúc tác thu được anđehit fomic
CH4 + O2 HCHO + H2O
- Oxi hóa không hoàn toàn etilen là phương pháp hiện đại để sản xuất anđehit axetic
2CH2= CH2 + O2 2CH3CHO
b) Điều chế xeton
- Oxi hóa không hoàn toàn ancol bậc II được xeton. Ví dụ:
CH3 – CH(OH) – CH3 + CuO CH3 – CO – CH3 + Cu + H2O
- Oxi hóa không hoàn toàn cumen được axeton và phenol theo sơ đồ:
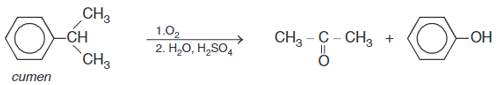
c) Điều chế axit cacboxylic
- Phương pháp lên men giấm (phương pháp cổ truyền sản xuất axit axetic)
C2H5OH + O2 CH3COOH + H2O
- Oxi hóa anđehit axetic:
2CH3CHO + O2 2CH3COOH
- Oxi hóa ankan:
2R-CH2-CH2-R’ + 5O2 2RCOOH + 2R’COOH + 2H2O
- Từ metanol:
CH3OH + CO CH3COOH
Đây là phương pháp hiện đại để sản xuất axit axetic.
Trắc nghiệm Hóa học lớp 11 Bài 46: Luyện tập: Anđehit, xeton và axit cacboxylic
Bài 1: Để trung hòa a mol axit cacboxylic A cần 2a mol NaOH. Đốt cháy hoàn toàn a mol A thu được 3a mol CO2. A có công thức phân tử là
A. C3H4O2.
B. C3H6O2.
C. C6H10O4.
D. C3H4O4.
Đáp án: D
Giải thích:
nNaOH : nA = 2 : 1 → A có 2 nhóm COOH
A có 3 C
→ A là HOOC - CH2 - COOH (Công thức phân tử: C3H4O4)
Bài 2: Cho 3,15 gam hỗn hợp X gồm axit axetic, axit acrylic, axit propionic vừa đủ để làm mất màu hoàn toàn dung dịch chứa 3,2 gam brom. Để trung hòa toàn 3,15 gam hỗn hợp X cần 90 ml dd NaOH 0,5M. Thành phần phần trăm khối lượng của axit axetic trong hỗn hợp X là
A. 35,24%.
B. 45,71%.
C. 19,05%.
D. 23,49%.
Đáp án: C
Giải thích:
Axit axetic: CH3COOH
Axit acrylic: CH2=CH-COOH
Axit propionic: C2H5COOH
- Khi cho hỗn hợp axit tác dụng với dung dịch Br2 thì chỉ có CH2=CH-COOH phản ứng
- Do các axit đều đơn chức nên ta có:
nhh = nNaOH = 0,09.0,5 = 0,045 mol
Đặt số mol của CH3COOH và C2H5COOH lần lượt là a và b (mol)
+ m hh = 60a + 74b + 0,02.72 = 3,15 (1)
+ n hh = a + b + 0,02 = 0,045 (2)
Giải hệ (1) và (2) được a = 0,01 và b = 0,015
Bài 3: Cho 13,4 gam hỗn hợp X gồm hai axit no, đơn chức, mạch hở, kế tiếp nhau trong cùng dãy đồng đẳng tác dụng với Na dư, thu được 17,8 gam muối. Khối lượng của axit có số nguyên tử cacbon ít hơn có trong X là
A. 3,0 gam.
B. 4,6 gam.
C. 7,4 gam.
D. 6,0 gam.
Đáp án: D
Giải thích:
Đặt công thức chung của hai axit là
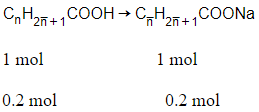
→ Mtb = 13,4 : 0,2 = 67
→
Do 2 axit là đồng đẳng nên 2 axit là CH3COOH (x mol) và C2H5COOH (y mol)
Giải hệ nhh = x + y = 0,2 và mhh = 60x + 74y = 13,4 được x = y = 0,1
Bài 4: Cho 150 gam axit axetic tác dụng với 161 gam ancol etylic có H2SO4 đặc làm xúc tác. Khi phản ứng xảy ra xong thì có 60% lượng axit chuyển thành este. Khối lượng este thu được sau khi phản ứng kết thúc là:
A. 132 gam
B. 230 gam
C. 235 gam
D. 240 gam
Đáp án: A
Giải thích:
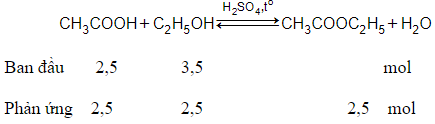
Do hiệu suất là 60% nên số mol este là 2,5.60% = 1,5 mol
Khối lượng của este là 1,5.88= 132 g
Bài 5: Đốt cháy 4,09g hỗn hợp A gồm hai axit cacboxylic là đồng đẳng kế tiếp nhau trong dãy đồng đẳng của axit axetic người ta thu được 3,472 lít khí CO2 (đktc). Công thức cấu tạo của các axit trong hỗn hợp là:
A. HCOOH và CH3COOH
B. CH3COOH và C2H5COOH
C. C2H5COOH và (CH3)2CHCOOH
D. C2H5COOH và CH3CH2CH2COOH.
Đáp án: B
Giải thích:
Hai axit cacboxylic kế tiếp cùng dãy đồng đẳng với axit axetic
→ axit no, đơn chức, mạch hở
Gọi công thức chung của hai axit là (n ≥ 1)
→ =
→ =
→ = 2,58
→ Hai axit là CH3COOH và C2H5COOH
Bài 6: Cho 3,6 gam axit cacboxylic no đơn chức X tác dụng hoàn toàn với 500ml dung dịch gồm KOH 0,12M và NaOH 0,12M. Cô cạn dung dịch sau phản ứng thu đc 8,28 gam hỗn hợp chất rắn khan. Công thức phân tử của X là
A. C2H4O2.
B. C2H2O4.
C. C3H4O2.
D. C4H6O4.
Đáp án: A
Giải thích:
nKOH = nNaOH = 0,5.0,12 = 0,06 mol
BTKL:
mH2O = m axit + mKOH + nNaOH - m chất rắn
= 3,6 + 0,06.56 + 0,06.40 - 8,28 = 1,08g
=> nH2O = 0,06 mol.
Ta thấy nH2O < n(KOH, NaOH)
=> Axit phản ứng hết
=> naxit = nH2O = 0,06 mol
=> MX = 3,6/0,06 = 60 (CH3COOH)
Bài 7: Cho 18,9 gam hỗn hợp X gồm 2 axit cacboxylic đơn chức là đồng đẳng kế tiếp phản ứng hoàn toàn với 200ml dung dịch NaOH 1M và KOH 1M thu được dung dịch Y. Cô cạn dung dịch Y, thu được 31,8 gam hỗn hợp chất rắn khan. Công thức của hai axit trong X là:
A. C2H4O2 và C3H6O2
B. CH2O2 và C2H4O2
C. C3H4O2 và C4H6O2
D. C3H6O2 và C4H8O2
Đáp án: B
Giải thích:
nNaOH = nKOH = 0,2 mol
Axit + NaOH, KOH → Chất rắn + H2O
BTKL:
m axit + mNaOH + mKOH = m chất rắn + mH2O
=> 18,9 + 0,2.40 + 0,2.56 = 31,8 + mH2O
=> mH2O = 6,3 gam
=> nH2O = 0,35 mol
Ta thấy: nH2O < nNaOH, KOH
=> Axit phản ứng hết
=> n axit = nH2O = 0,35 mol
Đặt công thức chung của 2 axit là RCOOH.
Mtb = R + 45 = 18,9 : 0,35 = 54 => R = 9
=> Hai axit là HCOOH và CH3COOH
Bài 8: Đốt cháy hoàn toàn 0,1 mol axit cacboxylic đơn chức cần vừa đủ V lít O2 (đktc), thu được 0,3 mol CO2 và 0,2 mol H2O. Giá trị của V là
A. 8,96.
B. 11,2.
C. 6,72.
D. 4,48.
Đáp án: C
Giải thích:
Axit cacboxylic đơn chức
→ nO (axit) = 2n axit = 2.0,1 = 0,2 (mol)
Bảo toàn nguyên tố O, ta có:
→ 0,2 + 2.= 2.0,3 + 0,2
→ = 0,3 mol
→ = 0,3.22,4 = 6,72 lít
Bài 9. Công thức chung của anđehit không no, có một liên kết đôi, đơn chức, mạch hở là
A. CnH2nO.
B. CnH2n-2O.
C. CnH2n+2O.
D. CnH2n-4O.
Đáp án: B
Giải thích: Anđehit không no, có một liên kết đôi, đơn chức, mạch hở là CnH2n-2O.
Bài 10. Khối lượng Ag thu được khi cho 0,1 mol CH3CHO phản ứng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3, đun nóng là
A. 43,2 gam.
B. 21,6 gam.
C. 16,2 gam.
D. 10,8 gam.
Đáp án: B
Giải thích:
nAg = 2nCH3CHO = 0,2 mol
→ mAg = 0,2.108 = 21,6g
Xem thêm các bài tổng hợp lý thuyết Hóa học lớp 11 đầy đủ, chi tiết khác:
Lý thuyết Bài 42: Luyện tập: Dẫn xuất halogen, ancol và phenol
Xem thêm các chương trình khác:
- Tóm tắt tác phẩm Ngữ văn 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Soạn văn 11 (hay nhất) | Để học tốt Ngữ Văn 11 (sách mới)
- Soạn văn 11 (ngắn nhất) | Để học tốt Ngữ văn 11 (sách mới)
- Tác giả tác phẩm Ngữ văn 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Văn mẫu 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Toán 11 | Giải bài tập Toán 11 Học kì 1, Học kì 2 (sách mới)
- Các dạng bài tập Toán lớp 11
- Lý thuyết Toán lớp 11 (sách mới) | Kiến thức trọng tâm Toán 11
- Giáo án Toán lớp 11 mới nhất
- Bài tập Toán lớp 11 mới nhất
- Chuyên đề Toán lớp 11 mới nhất
- Giải sgk Tiếng Anh 11 (thí điểm)
- Giải sgk Tiếng Anh 11 | Giải bài tập Tiếng anh 11 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Tiếng Anh 11 (sách mới) | Sách bài tập Tiếng Anh 11
- Giải sbt Tiếng Anh 11 (thí điểm)
- Giải sgk Lịch sử 11 | Giải bài tập Lịch sử 11 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Lịch Sử 11(sách mới) | Kiến thức trọng tâm Lịch Sử 11
- Giải Tập bản đồ Lịch sử 11
- Giải sgk Vật Lí 11 | Giải bài tập Vật lí 11 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 11 (sách mới) | Sách bài tập Vật Lí 11
- Lý thuyết Vật Lí 11 (sách mới) | Kiến thức trọng tâm Vật Lí 11
- Các dạng bài tập Vật Lí lớp 11
- Giáo án Vật lí lớp 11 mới nhất
- Giải sgk Sinh học 11 | Giải bài tập Sinh học 11 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Sinh học 11 (sách mới) | Kiến thức trọng tâm Sinh 11
- Giải sgk Giáo dục công dân 11
- Lý thuyết Giáo dục công dân 11
- Lý thuyết Địa Lí 11 (sách mới) | Kiến thức trọng tâm Địa lí 11
- Giải Tập bản đồ Địa Lí 11
- Giải sgk Giáo dục quốc phòng - an ninh 11
