Các dạng bài tập Hóa học lớp 11 Học kì 2
Tổng hợp các dạng bài tập Hóa học lớp 11 Học kì 1 gồm các dạng Hóa học từ cơ bản đến nâng cao với phương pháp giải chi tiết giúp học sinh nắm vững kiến thức từ đó biết cách giải bài tập Hóa học.
Các dạng bài tập Hóa học lớp 11 Học kì 2
Các dạng bài tập Hiđrocacbon no
Trắc nghiệm lý thuyết Hóa 11 Chương 5 Hiđrocacbon no
Bài tập tổng hợp về Xicloankan và cách giải
Phản ứng đốt cháy ankan và cách giải bài tập
Phản ứng tách ankan và cách giải bài tập
Phản ứng thế của ankan và cách giải bài tập
Các dạng bài tập Hiđrocacbon không no
Trắc nghiệm lý thuyết Hóa 11 Chương 6 Hiđrocacbon không no
Bài tập trọng tâm Ankin và cách giải
Dạng 1: Bài tập về phản ứng cộng Ankin và cách giải
Dạng 2: Bài tập về phản ứng thế bởi ion kim loại của các Ankin và cách giải
Dạng 3: Bài tập về phản ứng oxi hóa Ankin và cách giải
Bài tập trọng tâm về Anken và cách giải
Dạng 1: Bài tập về phản ứng cộng của Anken và cách giải
Dạng 2: Bài tập về phản ứng trùng hợp Anken và cách giải
Dạng 3: Bài tập về phản ứng oxi hóa Anken và cách giải
Bài tập trọng tâm về Ankanđien và cách giải
Các dạng bài tập Hiđrocacbon thơm. Nguồn hiđrocacbon thiên nhiên. Hệ thống hóa về hiđrocacbon
Trắc nghiệm lý thuyết Hóa 11 Chương 7 Hidrocacbon thơm
Bài tập trọng tâm Hidrocacbon thơm và cách giải
Dạng 1: Bài tập về phản ứng thế, phản ứng cộng của các hiđrocacbon thơm và cách giải
Dạng 2: Bài tập về phản ứng oxi hóa của các hiđrocacbon thơm và cách giải
Các dạng toán về Hidrocacbon thơm và cách giải
Phương pháp tăng giảm số mol trong giải toán hiđrocacbon và cách giải
Bảo toàn mol pi trong giải toán hiđrocacbon và cách giải
Bảo toàn khối lượng, bảo toàn nguyên tố trong giải toán hiđrocacbon và cách giải
Bài tập phân biệt các hidrocacbon và cách giải
Bài tập đốt cháy hỗn hợp các hidrocacbon và cách giải
Bài tập cộng H2, Br2 vào các hidrocacbon không no, mạch hở và cách giải
Các dạng bài tập Dẫn xuất halogen - Ancol - Phenol
Trắc nghiệm lý thuyết Hóa 11 Chương 8 Dẫn xuất halogen, Ancol, Phenol
Bài tập trọng tâm về Ancol và cách giải
Dạng 1: Bài tập xác định công thức phân tử và cách giải
Dạng 2: Bài tập về phản ứng thế ancol và cách giải
Dạng 3: Bài tập về phản ứng tách nước của ancol và cách giải
Dạng 4: Bài tập về phản ứng oxi hóa không hoàn toàn và cách giải
Dạng 5: Bài tập phản ứng cháy của ancol và cách giải
Bài tập trọng tâm về Phenol và cách giải
Các dạng bài tập Anđehit - Xeton - Axit cacboxylic
Trắc nghiệm lý thuyết Hóa 11 Chương 9 Anđehit Xeton Axit cacboxylic
Bài tập trọng tâm về Andehit và cách giải
Dạng 2: Bài tập về phản ứng cộng của anđehit và cách giải
Dạng 3: Bài tập về phản ứng tráng gương của anđehit và cách giải
Dạng 4: Bài tập về phản ứng oxi hóa của anđehit và cách giải
Bài tập trọng tâm về Axit cacboxylic và cách giải
Bài tập về phản ứng este hóa và cách giải
Bài tập về tính axit của axit cacboxylic và cách giải
Bài tập xác định công thức phân tử, công thức cấu tạo, gọi tên axit cacboxylic và cách giải
Bài tập hỗn hợp Ancol, Anđehit, Axit cacboxylic và cách giải
Điều chế các dẫn xuất hiđrocacbon và cách giải
Bài tập tổng hợp về Xicloankan và cách giải – Hóa học lớp 11
Câu 1: C4H8 có bao nhiêu đồng phân cấu tạo xicloankan?
A. 1.
B. 2.
C. 3.
D. 4.
Hướng dẫn giải:
C4H8 có 2 đồng phân cấu tạo xicloankan là

Đáp án B
Câu 2: Dẫn hỗn hợp khí A gồm propan và xiclopropan đi vào dung dịch brom sẽ quan sát được hiện tượng nào sau đây?
A. Màu của dung dịch nhạt dần và không có khí thoát ra.
B. Màu của dung dịch nhạt dần và có khí thoát ra.
C. Màu của dung dịch mất hẳn, không có khí thoát ra.
D. Màu dung dịch không đổi.
Hướng dẫn giải:
C3H6 + Br2 C3H6Br2 (nhạt màu dung dịch brom), khí thoát ra là C3H8.
Đáp án B
Câu 3: (A) là chất nào trong phản ứng sau đây?
A + Br2 Br-CH2-CH2-CH2-Br
A. propan.
B. 1-brompropan.
C. xiclopropan.
D. A và B đều đúng.
Hướng dẫn giải:
Xicloankan có phản ứng cộng mở vòng còn ankan không có phản ứng cộng. Nên A là xiclopropan.
Đáp án C
Câu 4: Nhận định nào sau đây là đúng?
A. Xicloankan chỉ có khả năng tham gia phản ứng cộng mở vòng.
B. Xicloankan chỉ có khả năng tham gia phản ứng thế.
C. Mọi xicloankan đều có khả năng tham gia phản ứng thế và phản ứng cộng.
D. Một số xicloankan có khả năng tham gia phản ứng cộng mở vòng.
Hướng dẫn giải:
Một số xicloankan vòng nhỏ có khả năng tham gia phản ứng cộng mở vòng.
Đáp án D
Câu 5: Xicloankan đơn vòng X có tỉ khối so với nitơ bằng 2,0. Công thức của xicloankan X là
A. C3H6.
B. C4H8.
C. C5H10.
D. C6H12.
Hướng dẫn giải:
MX = 2.28 = 56
Gọi công thức tổng quát của xicloankan là CnH2n (n>3)
Suy ra: 12n + 2n = 56n = 4
Vậy X là C4H8.
Đáp án B
Câu 6: C5H10 có bao nhiêu đồng phân xicloankan?
A. 2.
B. 3.
C. 4.
D. 5.
Hướng dẫn giải:
Có 5 đồng phân
Đáp án D
Câu 7: Oxi hóa hoàn toàn 2,24 lít khí xicloankan X ở đktc thu được 17,6 gam khí CO2. Biết X làm mất màu dung dịch brom. Vậy X là
A. xiclopropan.
B. xiclobutan.
C. metylxiclobutan.
D. metylxiclopropan.
Hướng dẫn giải:
Gọi công thức tổng quát của xicloankan là CnH2n (n > 3)
Ta có: n = 0,4 : 0,1 = 4
X có khả năng làm mất màu dung dịch brom. Suy ra X là metylxiclopropan.
Đáp án D
Câu 8: Cho những chất sau: propan, xiclopropan, butan,metylxiclopropan và xiclopentan. Những chất nào có khả năng làm mất màu nước brom ở điều kiện thường?
A. propan, xiclopropan và butan.
B. xiclopropan và butan.
C. butan, xiclopentan và metylxiclopropan.
D. xiclopropan và metylxiclopropan.
Hướng dẫn giải:
Ankan không làm mất màu brom ở đk thường nên loại propan, butan.
Xicloankan vòng lớn không làm mất màu brom nên loại xiclopentan
Vậy metylxiclopropan và xiclopropan làm mất màu brom
Đáp án D
Câu 9: Hỗn hợp X gồm một ankan và 1 xicloankan. Dẫn m gam X qua bình đựng nước brom dư thấy khối lượng bình tăng 4,2 gam. Đốt cháy hoàn toàn m gam B thu được 11,2 lít CO2 (đktc) và 10,8 gam H2O. Thành phần % khối lượng ankan trong B là
A. 29,28%.
B. 34,36%.
C. 41,67%.
D. 52,81%.
Hướng dẫn giải:
Khối lượng bình brom tăng là khối lượng của xicloankan: mxicloankan = 4,2 gam
= 10,8 : 18 = 0,6 mol; = 11,2 : 22,4 = 0,5 mol
mB = mC + mH = 0,5.12 + 0,6.2 = 7,2 gam
⇒ mankan = 7,2 – 4,2 = 3 gam
⇒ %(m)ankan = = 41,67%
Đáp án C
Câu 10: Chất khí A là một xicloankan. Khi đốt cháy 672 ml A (ở đktc) ta thấy khối lượng CO2 tạo thành nhiều hơn khối lượng nước sinh ra là 3,12 gam. Công thức của chất khí A là
A. C3H6.
B. C4H8.
C. C5H10.
D. C6H12.
Hướng dẫn giải:
nA = 0,03 mol
Công thức tổng quát của xicloankan là CnH2n (n > 3)
Khi đốt cháy xicloankan cho số mol CO2 và số mol H2O bằng nhau
Gọi số mol CO2 và số mol H2O là x mol
Ta có: 44x-18x = 3,12 a=0,12 mol
Phương trình phản ứng:
0,03 0,12
Suy ra n= 0,12 : 0,03 = 4
Vậy công thức của A là C4H8.
Đáp án B
Câu 11: Hai xicloankan A và B đều có tỉ khối hơi so với metan bằng 5,25. Khi tham gia phản ứng thế clo (as, tỉ lệ mol 1:1), A cho 4 sản phẩm thế còn N cho 1 sản phẩm thế. Tên gọi của các xicloankan B và A là
A. metyl xiclopentan và đimetyl xiclobutan.
B. xiclohexan và metyl xiclopentan.
C. xiclohexan và n- propyl xiclopropan.
D. cả A, B và C đều đúng.
Hướng dẫn giải:
MA = MB = 5,25.16 = 84
Gọi công thức tổng quát của xicloankan là CnH2n (n>3)
Suy ra: 12n + 2n = 84 n = 6
Suy ra cả A,B đều có công thức là C6H12.
Do B cho duy nhất 1 sản phẩm thế nên B là xiclohexan
A cho 4 sản phẩm thế nên A là metyl xiclopentan.
Đáp án B
Câu 12: Đốt cháy hoàn toàn 7g hợp chất A thu được 11,2 lít khí CO2 (đktc) và 9 gam H2O. Khi cho A tham gia phản ứng clo hóa thì chỉ thu được 1 dẫn xuất monoclo duy nhất. Công thức của A là gì? Biết A có tỉ khối so với nitơ là 2,5.
A. C3H6.
B. C4H8.
C. C5H10.
D. C6H12.
Hướng dẫn giải:
Gọi CT của A là CxHy
Ta có: x = 0,5 : 0,1 = 5 và y = 1: 0,1 = 10
Suy ra A là C5H10.
Đáp án C
Câu 13: Xicloankan A phản ứng với Cl2 ánh sáng thu được dẫn xuất monoclo B (trong đó clo chiếm 34% về khối lượng). Biết B có 4 đồng phân. Tên gọi của hợp chất A là:
A. Metylxiclopropan.
B. 1,2-đimetylxiclopropan.
C. Metylxiclobutan.
D. Xiclobutan.
Hướng dẫn giải:
Gọi công thức của A là CnH2n
Phương trình phản ứng:
A là C5H10. Do B có 4 đồng phân nên A là Metylxiclobutan
Đáp án C
Câu 14: Khi cho metylxiclopentan tác dụng với clo (có chiếu sáng hoặc đun nóng) có thể thu được mấy dẫn xuất monoclo
A. 3.
B. 4.
C. 5.
D. 6
Hướng dẫn giải:
Các vị trí có thể tham gia thế clo được biểu diễn như sau:
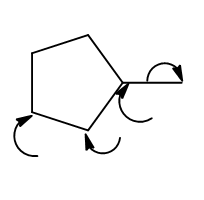
Đáp án B
Câu 15: Hỗn hợp khí A chứa một ankan và một monoxicloankan. Tỉ khối của A đối với hiđro là 25,8. Đốt cháy hoàn toàn 2,58 gam A rồi hấp thụ hết sản phẩm cháy vào dung dịch Ca(OH)2 dư, thu được 18 gam kết tủa. Công thức của monoxicloankan trong hỗn hợp A là
A. C3H6.
B. C4H8.
C. C5H10.
D. C6H12.
Hướng dẫn giải:
mH = 2,58 – 0,18.12 = 0,42 gam
Ta có: nankan = 0,21 – 0,18 = 0,03 mol và nxicloankan = 0,02 mol
Gọi công thức của ankan và xicloankan là CnH2n+2 và CmH2m
Ta có: 0,02n + 0,03m = 0,18.
Biện luận suy ra được n = 3 và m = 4
Vậy xicloankan là C4H8
Đáp án B
Câu 16: Xicloankan X trong điều kiện thích hợp có thể tác dụng với dung dịch brom để tạo dẫn xuất Y. Biết Y chứa 74,07 %Br và X không chứa quá 8 nguyên tử cacbon. Vậy X là
A. C3H6.
B. C4H8.
C. C5H10.
D. C6H12.
Hướng dẫn giải:
- Nếu X tham gia phản ứng thế thì ta có sơ đồ:
Suy ra:
Không phù hợp với điều kiện X không chứa quá 8 nguyên tử cacbon
- Nếu X tham gia phản ứng cộng ta có sơ đồ:
Suy ra:
X là C4H8.
Đáp án B
Câu 17: Khi cho m gam hiđrocacbon no, mạch vòng A tác dụng với clo (chiếu sáng) thu được 9,48 gam một dẫn xuất clo duy nhất B. Để trung hòa khí HCl sinh ra cần vừa đủ 80 ml dung dịch NaOH 1M. Biết hiệu suất clo hóa là 80%. Giá trị của m là
A. 6,72.
B. 7,14.
C. 8,4.
D. 10.
Hướng dẫn giải:
0,08 0,08 mol
Ta có:
Do hiệu suất phản ứng là 80% nên m =
Đáp án C
Câu 18: Hiđrocacbon X có công thức là C6H12 không làm mất màu dung dịch brom, khi tác dụng với brom tạo được một dẫn xuất monobrom duy nhất. Vậy X là
A. 1,2,3- trimetylclopropan.
B. 1,2- đimetylbutan.
C. metylpentan.
D. xiclohexan.
Hướng dẫn giải:
Xiclohexan khi tác dụng với brom cho 1 dẫn xuất duy nhất.
Đáp án D
Dạng 1: Bài tập về phản ứng cộng Ankin và cách giải – Hóa học lớp 11
A. Phương pháp giải
- Công thức tổng quát của ankin là CnH2n-2 .
- Cộng H2
+ Khi có mặt Ni hoặc Pt làm xúc tác, ankin + H2 tạo ra anken, sau đó tạo ankan.
Ví dụ:
+ Với xúc tác Pd/PbCO3 hoặc Pd/ BaSO4 phản ứng dừng lại tạo anken.
- Cộng Halogen
Phương trình tổng quát:
- Cộng HX: tuân theo qui tắc Mac-cốp-nhi-cốp.
+ Qui tắc Mac-cốp-nhi-cốp: Trong phản ứng cộng HX vào liên kết đổi, nguyên tử H (hay phần mang điện dương) chủ yếu cộng vào nguyên tử cacbon bậc thấp hơn (có nhiều H hơn), còn nguyên tử hay nhóm nguyên tử X (phần mang điện âm) cộng vào nguyên tử cacbon bậc cao hơn (có ít H hơn).
+ Ví dụ:
- Phương pháp giải:
+ Tính theo phương trình hoặc áp dụng định luật bảo toàn nguyên tố và bảo toàn khối lượng.
+ Khi cộng H2 thì khối lượng hỗn hợp khí trước và sau phản ứng không đổi:
mtrước = msau
+ Khi cộng H2 thì độ giảm số mol khí là số mol H2 phản ứng:
nkhí giảm = ntrước – nsau = nhidro phản ứng
+ Với bài toán ankin cộng H2, sau đó lại cộng brom, sử dụng bảo toàn số mol liên kết pi:
B. Ví dụ minh họa
Ví dụ 1: Cho 3,12 gam ankin X phản ứng với 0,1 mol H2 (xúc tác Pd/PbCO3, ), thu được hỗn hợp Y chỉ có hai hiđrocacbon. Công thức phân tử của X là
A. C2H2
B. C5H8
C. C4H6
D. C3H4
Hướng dẫn giải
Gọi công thức phân tử ankin X:
Sau phản ứng thu được 2 hidrocacbon ankin X dư
ankin X là C2H2
Đáp án A
Ví dụ 2: Một hỗn hợp khí M gồm ankin X và H2 có tỉ khối hơi so với CH4 là 0,6. Nung nóng hỗn hợp M với bột Ni để phản ứng xảy ra hoàn toàn thu được hỗn hợp khí N có tỉ khối hơi so với CH4 là 1,0. Ankin X là
A. axetilen.
B. metylaxetilen.
C. etylaxetilen.
D. propylaxetilen.
Hướng dẫn giải
Ta có H2 dư.
Gọi
Vì phản ứng xảy ra hoàn toàn hỗn hợp N gồm CnH2n + 2: x mol và H2 dư (y - 2x) mol.
Từ (1) và (2) y = 4x n = 3
CH≡C-CH3 metylaxetilen
Đáp án B
Ví dụ 3: Cho hỗn hợp X gồm 0,1 mol C2H4, 0,2 mol C2H2 và 0,7 mol H2. Nung X trong bình kín có xúc tác là Ni, sau một thời gian thu được 0,8 mol hỗn hợp Y. Biết Y phản ứng vừa đủ với 100ml dung dịch Br2 có nồng độ a mol/lít. Giá trị của a là
A. 3
B. 2,5
C. 2
D. 5
Hướng dẫn giải
nhhX = 0,1 + 0,2 + 0,7 = 1 (mol)
1 mol hỗn hợp X (C2H4; C2H2; H2) 0,8 mol hỗn hợpY (C2H6; H2 dư, C2H2 dư, C2H4 dư)
ngiảm =
Khi cho Y phản ứng với dung dịch Br2 chỉ có C2H2 dư, C2H4 dư phản ứng
(M)
Đáp án A
C. Bài tập tự luyện
Câu 1: Hỗn hợp khí X gồm 0,3 mol H2 và 0,1 mol vinylaxetilen. Nung X một thời gian với xúc tác Ni thu được hỗn hợp khí Y có tỉ khối so với không khí là 1. Tính số mol H2 phản ứng?
A. 2,24 lít
B. 4,48 lít
C. 10,08 lít
D. 5,04 lít
Hướng dẫn giải:
Theo bài:
Bảo toàn khối lượng: mY = mX = 0,3.2 + 0,1.52 = 5,8g
Đáp án B
Câu 2: Cho 2,24 lít (đktc) hỗn hợp X gồm C2H4 và C2H2 lội chậm qua bình đựng dung dịch Br2 dư thấy khối lượng bình tăng thêm 2,7 gam. Thành phần phần trăm thể tích của C2H2 có trong hỗn hợp X là
A. 40%
B. 50%
C. 60%
D. 75%
Hướng dẫn giải
Gọi số mol của C2H4 và C2H2 lần lượt là x và y mol
x + y = 0,1 (1)
Ta có khối lượng bình tăng bằng khối lượng hỗn hợp khí X 28x + 26y = 2,7 (2)
Từ (1) và (2) x = y = 0,05
Phần trăm thể tích bằng phần trăm số mol khí.
Đáp án B
Câu 3: Cho m gam propin tác dụng với H2 dư (Ni, ) thu được (m + 8) gam sản phẩm hữu cơ Y. Giá trị của m là:
A. 80 gam
B. 40 gam
C. 160 gam
D. 120 gam
Hướng dẫn giải
Đáp án A
Câu 4: Đun nóng hỗn hợp khí gồm 0,06 mol C2H2 và 0,04 mol H2 với xúc tác Ni, sau một thời gian thu được hỗn hợp khí Y. Dẫn toàn bộ hỗn hợp Y lội từ từ qua bình đựng dung dịch brom (dư) thì còn lại 0,448 lít hỗn hợp khí Z (ở đktc) có tỉ khối so với O2 là 0,5. Khối lượng bình dung dịch brom tăng là
A. 1,20 gam
B. 1,04 gam
C. 1,64 gam
D. 1,32 gam
Hướng dẫn giải
Gọi m gam là khối lượng bình dung dịch brom tăng.
Bảo toàn khối lượng ta có:
0,06.26 + 0,04.2 = 0,02.0,5.32 + m
m = 1,32 gam
Đáp án D
Câu 5: Khi cho brom phản ứng hoàn toàn 0,3 mol hỗn hợp gồm một ankin và một anken cần vừa đủ 0,4 mol Br2. Thành phần phần trăm về số mol của ankin trong hỗn hợp là:
A. 75%
B. 25%
C. 33,33%
D. 66,67%
Hướng dẫn giải
Gọi
Ta có:
a + 2b = 0,4 (2)
Từ (1) và (2) a = 0,2 mol; b = 0,1 mol
% n ankin = 0,1.100/0.3 = 33,33%
Đáp án C
Câu 6: Hỗn hợp X gồm một hiđrocacbon (khí) và H2, với . Cho hỗn hợp đi qua Ni nung nóng, sau khi phản ứng xảy ra hoàn toàn thu được hỗn hợp Y có . Công thức phân tử của hiđrocacbon trong X là
A. C3H4.
B. C3H6.
C. C4H8.
D. C4H6.
Hướng dẫn giải
Bảo toàn khối lượng: mX = mY
Giả sử nhhX = 5 mol; nhhY = 2 mol.
Ta có
hiđrocacbon là CnH2n – 2 có số mol bằng
ban đầu có CnH2n - 2 1,5 mol và H2 3,5 mol.
n = 3 C3H4
Đáp án A
Câu 7: Một hỗn hợp X gồm một anken và một ankin. Cho 0,1 mol hỗn hợp X vào nước brom dư thấy có 0,16 mol Br2 đã tham gia phản ứng. Mặt khác, đốt cháy hoàn toàn 0,1 mol hỗn hợp X thu được 0,28 mol CO2. Vậy 2 chất trong hỗn hợp X là
A. C2H4 và C3H4
B. C4H8 và C2H2
C. C3H6 và C2H2
D. C3H6 và C3H4
Hướng dẫn giải
0,1 mol X + O2 0,28 mol CO2
Bảo toàn C ta có: 0,04n + 0,06m = 0,28 2n + 3m = 14.
Ta thấy n = 4; m = 2 là giá trị thỏa mãn X là C4H8 và C2H2
Đáp án B
Câu 8: Dẫn 2,24 lít hỗn hợp gồm etilen, propilen, propen, các buten và axetilen (ở đktc) qua dung dịch brom dư thì thấy khối lượng brom trong bình giảm 19,2 gam. Lượng CaC2 cần dùng để điều chế được lượng axetilen có trong hỗn hợp trên là
A. 6,4 gam
B. 3,2 gam
C. 2,56 gam
D. 1,28 gam
Hướng dẫn giải
Anken + Br2 Sp
Ankin + 2Br2 Sp
naxetilen = = 0,12 - 0,1 = 0,02 mol
Đáp án D
Câu 9: Hỗn hợp X gồm C2H2 và H2 (có tỉ lệ mol tương ứng là 1 : 2). Đun nóng 10,08 lít (đktc) hỗn hợp X với xúc tác Ni, sau một thời gian thu được hỗn hợp khí Y. Dẫn hỗn hợp Y qua dung dịch nước brom dư, thấy bình brom tăng 3 gam và còn lại V lít (đktc) hỗn hợp khí Z không bị hấp thụ. Tỉ khối của Z so với heli bằng 5/3. Giá trị của V là
A. 13,44 lít
B. 4,48 lít
C. 10,08 lít
D. 5,04 lít
Hướng dẫn giải
Ta có mX = mY = mbình tăng + mZ
0,15. 26 + 0,3. 2 = 3 + mZ mZ = 1,5 gam
V= 5,04 lít.
Đáp án D
Câu 10: Cho 28,2 gam hỗn hợp X gồm 3 ankin đồng đẳng kế tiếp qua một lượng dư H2 (, Ni) để phản ứng xảy ra hoàn toàn. Sau phản ứng thể tích thể tích khí H2 giảm 26,88 lít (đktc). Công thức phân tử của 3 ankin là
A. C2H2, C3H4, C4H6.
B. C4H6, C5H8, C6H10.
C. C3H4, C4H6, C5H8.
D. Cả A và C đều đúng
Hướng dẫn giải
Ta có: số mol khí giảm = số mol H2 tham gia phản ứng = 1,2 mol
tổng số mol hỗn hợp = = 0,6
Hỗn hợp có thể là C2H2, C3H4, C4H6 hoặc C3H4, C4H6, C5H8
Đáp án D
Dạng 1: Bài tập xác định công thức phân tử và cách giải – Hóa học lớp 11
A. Phương pháp giải
- Từ công thức đơn giản hoặc công thức thực nghiệm, ta suy luận dựa vào công thức tổng quát của ancol (no đơn chức, không no đơn chức, đa chức…)
- Công thức tổng quát: CnH2n+2-2k-z(OH)z
Trong đó: k = số liên kết + số vòng
n, z là các số tự nhiên; z ≤ n)
- Phương pháp: Tính theo phương trình hoặc áp dụng định luật bảo toàn khối lượng.
- Một số cách gọi tên ancol:
+ Tên gốc – chức: “Ancol” + tên gốc hiđrocacbon + “ic”
Ví dụ: CH3CH2OH là ancol etylic
+ Tên thay thế: Tên hiđrocacbon mạch chính + số chỉ vị trí nhóm OH + “ol”
Ví dụ: CH3CH2OH là etanol
B. Ví dụ minh họa
Ví dụ 1: Công thức nào đúng với tên gọi tương ứng?
A. ancol sec-butylic: (CH3)2CH-CH2OH
B. ancol iso-amylic: (CH3)2CHCH2CH2CH2OH
C. ancol etylic: CH3OH
D. ancol anlylic: CH2=CHCH2OH
Đáp án D
Ví dụ 2: Cho Na phản ứng hoàn toàn với 18,8 gam hỗn hợp 2 ancol no, đơn chức, kế tiếp nhau trong dãy đồng đẳng sinh ra 5,6 lít khí H2 (đktc). Công thức phân tử của 2 ancol đó là:
A. CH3OH, C2H5OH
B. C2H5OH, C3H7OH
C. C4H9OH, C6H11OH
D. C3H7OH, C4H9OH
Hướng dẫn giải
Hai ancol là CH3OH, C2H5OH
Đáp án A
Ví dụ 3: Cho 6 gam một ancol đơn chức, mạch hở tác dụng Na vừa đủ thu được 1,12 lít khí H2 (đktc). Số công thức cấu tạo có thể có của X là
A. 4.
B. 3.
C. 1.
D. 2.
Hướng dẫn giải
Các công thức cấu tạo thỏa mãn là:
CH3-CH2-CH2-OH
CH3-CH(OH)-CH3
Đáp án D
C. Bài tập tự luyện
Câu 1: Xác định tên theo IUPAC của rượu sau: (CH3)2CH – CH2 – CH(OH) – CH3
A. 4 – metylpentan-2-ol
B. 4,4 – dimetylbutan-2-ol
C. 1,3 – dimetylbutan-1-ol
D. 2,4 – dimetylbutan-4-ol
Đáp án A
Câu 2: Công thức cấu tạo đúng của 2,2- đimetylbutan-1-ol là:
A. (CH3)3C-CH2-CH2-OH
B. CH3-CH2-C(CH3)2-CH2-OH
C. CH3-CH(CH3)-CH(CH3)-CH2-OH
D. CH3-CH(CH3)-CH(CH3)-CH2-OH
Đáp án B
Câu 3: Cho 15,6 gam hỗn hợp hai ancol (rượu) đơn chức, kế tiếp nhau trong dãy đồng đẳng tác dụng hết với 9,2 gam Na, thu được 24,5 gam chất rắn. Hai ancol đó là (cho H = 1, C = 12, O = 16, Na = 23)
A. C3H5OH và C4H7OH.
B. C2H5OH và C3H7OH.
C. C3H7OH và C4H9OH.
D. CH3OH và C2H5OH
Hướng dẫn giải
Gọi công thức chung của hai ancol là ROH
Theo bảo toàn khối lượng ta có:
Ta có:
→ Công thức của hai ancol là C2H5OH và C3H7OH
Đáp án B
Câu 4: Cho 13,8 gam ancol A tác dụng với Na dư giải phóng 5,04 lít H2 ở đktc, biết MA < 100. Vậy A có công thức cấu tạo thu gọn là:
A. CH3OH.
B. C2H5OH.
C. C3H6(OH)2.
D. C3H5(OH)3.
Hướng dẫn giải
Giả sử A có công thức R(OH)n
+ n = 1 M ancol = 92/3 (loại)
+ n = 2 M ancol = 184/3 (loại)
+ n = 3 M ancol = 92 Ancol là C3H5(OH)3
Đáp án D
Câu 5: X là một ancol no, mạch hở. Đốt cháy hoàn toàn 0,05 mol X cần 5,6 gam oxi, thu được hơi nước và 6,6 gam CO2. Công thức của X là:
A. C2H4(OH)2
B. C3H7OH
C. C3H5(OH)3
D. C3H6(OH)2
Hướng dẫn giải
Gọi công thức phân tử của ancol no, mạch hở là CnH2n+2Ox (x ≤ n)
Từ phương trình ta có:
Vậy công thức phân tử của ancol no, mạch hở X là C3H8O3, có công thức cấu tạo là C3H5(OH)3.
Đáp án C
Câu 6: Ancol X mạch hở có số nguyên tử cacbon bằng số nhóm chức. Cho 9,3 gam ancol X tác dụng với Na dư thu được 3,36 lít khí. Công thức cấu tạo thu gọn của X là
A. HOCH2CH(OH)CH2OH.
B. C2H5OH.
C. CH3OH.
D. HOCH2CH2OH.
Hướng dẫn giải
( vì số C bằng số nhóm chức)
⇒ mH = mX – mO – mC = 9,3 – 0,3 .16 - 0,3.12 = 0,9
⇒ C : H : O = = 1 : 3 : 1
⇒ X là C2H6O2
Đáp án D
Câu 7: Đốt cháy hoàn toàn 1,52 gam một ancol X thu được 1,344 lít CO2 (đktc) và 1,44 gam nước. X có công thức phân tử là
A. C3H7OH
B. C3H6(OH)2
C. C2H4(OH)2
D. C3H5(OH)3
Hướng dẫn giải
→ Công thức phân tử của X là C3H8O2
Đáp án B
Câu 8: Đun nóng một rượu (ancol) đơn chức X với dung dịch H2SO4 đặc trong điều kiện nhiệt độ thích hợp sinh ra chất hữu cơ Y, tỉ khối hơi của X so với Y là 1,6428. Công thức phân tử của X là:
A. C4H8O.
B. CH4O.
C. C2H6O.
D. C3H8O
Hướng dẫn giải
Ta có dX/Y= 1,6428 → MX = 1,6428.MY
→ X là ancol no, đơn chức còn Y là anken.
Gọi công thức của ancol đơn chức X là
→ Công thức của X là C2H6O
Đáp án C
Câu 9: Thực hiện phản ứng tách nước một ancol no đơn chức X với H2SO4 đặc ở nhiệt độ thích hợp, thu được chất hữu cơ Y. Tỉ khối hơi của Y so với X là 1,4375. Công thức của X là
A. C3H7OH.
B. C2H5OH.
C. C4H9OH.
D. CH3OH.
Hướng dẫn giải
Đun m1 gam X với H2SO4 đặc → m2 gam chất hữu cơ Y; dY/X = 1,4375
X là CH3OH
Đáp án D
Câu 10: Cho bột CuO đốt nóng dư vào bình đựng 81,282g ancol A no, mạch thẳng. Lượng chất rắn sau phản ứng tác dung dịch HNO3 loãng dư thu được 39,1552 lít khí NO duy nhất (đktc). Công thức cấu tạo của A là
A. C3H6(OH)2
B. CH3(CH2)2OH
C. C2H5OH
D. C2H4(OH)2
Hướng dẫn giải
Bảo toàn electron, ta có: → 2. nCu = 3.nNO
→ nCu = 2,622 mol
Gọi ancol: CnH2n+2Ox
→ x = 2 → M = 62 → C2H4(OH)2
Đáp án D
Bài tập về phản ứng este hóa và cách giải – Hóa học lớp 11
A. Lý thuyết và phương pháp giải:
- Phản ứng giữa ancol và axit tạo thành este và nước được gọi là phản ứng este hóa. Đặc điểm của phản ứng este hóa là thuận nghịch và cần có H2SO4 đặc làm chất xúc tác.
- Thường gặp là phản ứng giữa axit đơn chức và ancol đơn chức, phương trình tổng quát:
Ví dụ:
+ Nếu nRCOOH > nR’OH thì ancol là chất hết; axit là chất dư.
+ Nếu nRCOOH < nR’OH thì axit là chất hết; ancol là chất dư.
- Bài toán thường gặp là tính hiệu suất của phản ứng este hóa:
Áp dụng công thức:
Trong đó:
+ meste TT: khối lượng este thu được theo thực tế.
+ meste LT: khối lượng este thu được theo lý thuyết.
B. Ví dụ minh họa:
Ví dụ 1: Cho 12 gam axit axetic tác dụng với 9,2 gam rượu etylic đun nóng và có mặt H2SO4 đặc làm xúc tác (hiệu suất 100%) khối lượng etyl axetat là
A. 8,8g
B. 88 g
C. 17,6 g
D. 176 g
Hướng dẫn giải:
Ban đầu 0,2 0,2 mol
→ meste = 0,2.88 = 17,6 g
Đáp án C
Ví dụ 2: Hỗn hợp X gồm axit HCOOH và axit CH3COOH (tỉ lệ mol 1:1). Lấy 5,3 gam hỗn hợp X tác dụng với 5,75 gam C2H5OH (có xúc tác H2SO4 đặc) thu được m gam hỗn hợp este (hiệu suất của các phản ứng este hoá đều bằng 80%). Giá trị của m là:
A. 10,12
B. 6,48
C. 8,10
D. 16,20
Hướng dẫn giải
nHCOOH = = 0,05 mol
= 0,125 mol ⇒ Ancol dư
Vậy hỗn hợp este gồm:
⇒ m = 6,48 gam
Đáp án B
Ví dụ 3: Cho 150 gam axit axetic tác dụng với 161 gam ancol etylic có H2SO4 đặc làm xúc tác. Khi phản ứng xảy ra xong thì có 60% lượng axit chuyển thành este. Khối lượng este thu được sau khi phản ứng kết thúc là:
A. 132 gam
B. 230 gam
C. 235 gam
D. 240 gam
Hướng dẫn giải:
Ban đầu 2,5 3,5 mol
Phản ứng 2,5 2,5 2,5 mol
Do hiệu suất là 60% nên số mol este là 2,5.60% = 1,5 mol
Khối lượng của este là 1,5.88= 132 g
Đáp án A
C. Luyện tập
Câu 1: Đun 12 gam axit axetic với 13,8 gam etanol (có H2SO4 đặc làm xúc tác), thu được 11gam este. Hiệu suất của phản ứng este hóa là
A. 44%.
B. 55%.
C. 62,5%.
D. 75 %.
Hướng dẫn giải:
Ban đầu 0,2 0,3 mol
Phản ứng 0,2 0,2 0,2 mol
Khối lượng của este theo lý thuyết là 0,2.88= 17,6 g
Hiệu suất của phản ứng este hóa là:
Đáp án C
Câu 2: Đun nóng 30 gam axit axetic với lượng dư ancol etylic (xúc tác H2SO4 đặc), thu được 26,4 gam este. Hiệu suất của phản ứng este hóa là
A. 40%.
B. 50%.
C. 60%.
D. 70%.
Hướng dẫn giải:
0,5 0,5 mol
Khối lượng của este theo lý thuyết là 0,5.88 = 44 g
Hiệu suất của phản ứng este hóa là:
Đáp án C
Câu 3: Trộn 300ml dung dịch axit axetic 1M và 50 ml ancol etylic 46º (d = 0,8g/ml) có thêm một ít H2SO4 đặc vào một bình cầu và đun nóng bình cầu một thời gian, sau đó chưng cất thu được 18,48 gam este. Hiệu suất của phản ứng este hoá là:
A. 65%
B. 70%
C. 85%
D. 90%
Hướng dẫn giải:
naxit = 0,3 mol; nancol =
Ban đầu: 0,3 0,4 mol
Phản ứng: 0,3 0,3 0,3 mol
Khối lượng este theo lý thuyết là 0,3.88 = 26,4 gam
Hiệu suất phản ứng là:
Đáp án B
Câu 4: Khi thực hiện phản ứng este hóa 1 mol CH3COOH và 1 mol C2H5OH, lượng este lớn nhất thu được là mol. Để đạt hiệu suất cực đại 90% (tính theo axit khi tiến hành este hóa 1 mol CH3COOH cần số mol C2H5OH là bao nhiêu? Biết các phản ứng este hóa thực hiện ở cùng nhiệt độ).
A. 0,342.
B. 0,456.
C. 2,412.
D. 2,925.
Hướng dẫn giải:
Ban đầu: 1 mol 1 mol
Phản ứng:
Sau phản ứng:
=>
Hiệu suất đạt cực đại H = 90% => phản ứng = 1.90% = 0,9 mol
Gọi số mol C2H5OH cần dùng = x mol
Ban đầu: 1 mol x mol
Phản ứng: 0,9 → 0,9 → 0,9 → 0,9
Sau phản ứng: 0,1 x – 0,9 0,9 0,9
Vì 2 phản ứng thực hiện ở cùng nhiệt độ => KC không đổi
=> => x = 2,925 mol
Đáp án D
Câu 5: Đốt cháy hoàn toàn m gam hỗn hợp ancol đơn chức X và Y thuộc cùng 1 dãy đồng đẳng, người ta thu được 35,84 lít CO2 (ở đktc) và 37,8 gam H2O. Nếu cho m gam hỗn hợp trên tác dụng với 24,0 gam axit axetic (hiệu suất là 50%). Khối lượng este thu được là
A. 20 gam.
B. 20,96 gam.
C. 26 gam.
D. 26,4 gam.
Hướng dẫn giải:
Gọi CTTQ của 2 ancol là ROH.
nancol = 2,1 – 1,6 = 0,5 mol
Suy ra mancol = mC + mH + mO = 12.1,6 + 2,1.2 + 0,5.16 = 31,4 gam
Mancol = 31,4 : 0,5 = 62,8
Phương trình phản ứng:
Ban đầu: 0,4 0,5 mol
Phản ứng: 0,4 0,4 0,4 mol
Do hiệu suất phản ứng là 50% nên neste = 0,4.0,5 = 0,2 mol
meste = 0,2. (15 + 44 + 45,8) = 20,96 gam
Đáp án B
Câu 6: Đun nóng 6 gam axit axetic với 6 gam ancol etylic (xúc tác H2SO4 đặc, đun nóng), hiệu suất của phản ứng este hóa là 60%. Khối lượng este là
A. 4,4 g
B. 4,6 g
C. 5,2 g
D. 5,28 g
Hướng dẫn giải:
Ban đầu: 0,1 0,13 mol
Phản ứng: 0,1 0,1 0,1 mol
meste lý thuyết = 0,1.88 = 8,8 gam
Do hiệu suất của phản ứng là 60% nên meste thực tế = 5,28g
Đáp án D
Câu 7: Cho hỗn hợp X gồm ancol metylic và hai axit cacboxylic (no, đơn chức, kế tiếp nhau trong dãy đồng đẳng) tác dụng hết với Na, giải phóng 6,72 lít khí H2 (đktc). Nếu đun nóng hỗn hợp X (có xúc tác H2SO4 đặc) thì các chất trong hỗn hợp phản ứng vừa đủ với nhau tạo thành 25 gam hỗn hợp este (hiệu suất của phản ứng este hóa đều bằng 100%). Hai axit trong hỗn hợp X là
A. HCOOH và CH3COOH.
B. CH3COOH và C2H5COOH.
C. C2H5COOH và C3H7COOH.
D. C3H7COOH và C4H9COOH.
Hướng dẫn giải:
Gọi 2 axit có công thức chung là RCOOH.
Khi tham gia phản ứng với Na ta có:
nancol + naxit = 2nhiđro = 2.0,3 = 0,6 mol
Vì các chất trong hỗn hợp phản ứng vừa đủ với nhau và hiệu suất của phản ứng 100% nên naxit = nancol = neste = 0,3 mol
Suy ra Meste = (R + 12 + 32 + 15). 0,3 = 25 R = 24,333
Hai 2 axit là CH3COOH và C2H5COOH.
Đáp án B
Câu 8: Chia a gam axit axetic thành 2 phần bằng nhau:
-Phần 1: Trung hòa vừa đủ bởi 0,5 lít dung dịch NaOH 0,4 M
-Phần 2: Thực hiện phản ứng este hóa với ancol etylic dư thu được m gam este (giả sử hiệu suất phản ứng là 100%)
Vậy m có giá trị là:
A. 16,7 gam
B. 17,6 gam
C. 16,8 gam
D. 18,6 gam
Hướng dẫn giải:
Mà hiệu suất là 100% nên neste =
meste = 0,02.88=17,6 g
Đáp án B
Câu 9: Khi đun nóng 25,8 gam hỗn hợp ancol etylic và axit axetic có H2SO4 đặc làm xúc tác thu được 14,08 gam este. Nếu đốt cháy hoàn toàn lượng hỗn hợp đó thu được 23,4g H2O. Tìm thành phần trăm mỗi chất trong hỗn hợp đầu và hiệu suất của phản ứng este hoá.
A. 53,5% C2H5OH; 46,5% CH3COOH và H = 80%
B. 55,3% C2H5OH; 44,7% CH3COOH và H = 80%
C. 60,0% C2H5OH; 40,0% CH3COOH và H = 75%
D. 45,0% C2H5OH; 55,0% CH3COOH và H = 60%
Hướng dẫn giải:
= 1,3 mol
Đặt a, b là số mol C2H5OH và CH3COOH
⇒ 46a + 60b = 25,8 (1)
và = 3a + 2b = 1,3 (2)
Từ (1) và (2) ⇒ a = 0,3mol và b = 0,2 mol
= 0,16 mol
⇒ H = = 80%
Đáp án A
Câu 10: Cho 20,5 gam hỗn hợp ancol etylic và axit axetic tác dụng với kali dư thu được 4,48 lít H2 (đktc). Nếu cho hỗn hợp đó thực hiện phản ứng este hóa thì khối lượng este thu được là bao nhiêu? Biết H = 100%.
A. 10 gam
B. 12 gam
C. 13,2 gam
D. 14,2 gam
Hướng dẫn giải:
Gọi số mol của ancol và axit lần lượt là x, y mol
x 0,5x mol
y 0,5y mol
Ta có hệ phương trình:
Phản ứng este hóa:
Ban đầu 0,15 0,25 mol
Phản ứng 0,15 0,15 0,15 mol
Khối lượng este là 0,15.88= 13,2g.
Đáp án C
