Hệ thống kiến thức Hóa học lớp 11 Giữa học kì 1
Hệ thống kiến thức Hóa học lớp 11 Giữa học kì 1 chi tiết giúp học sinh ôn luyện để đạt điểm cao trong bài thi Hóa học 11 Giữa học kì 1. Mời các bạn cùng đón xem:
Hệ thống kiến thức Hóa học lớp 11 Giữa học kì 1
CHƯƠNG I : SỰ ĐIỆN LI
|
SỰ ĐIỆN LI |
|
|
Khái niệm |
- Là quá trình các chất khi hòa tan trong nước (hoặc ở trạng thái nóng chảy), phân li thành các ion (ion dương hoặc âm). Các ion này có khả năng dẫn điện. - Quá trình điện li không phải là quá trình oxi hóa - khử vì không có sự cho - nhận e, mà chỉ là quá trình tách các ion từ mạng tinh thể ion thành các ion dương (cation) hoặc ion âm (anion), dưới tác dụng của các phần tử dung môi phân cực (H2O). |
|
Phân loại |
- Chất điện li : là những chất khi tan trong nước phân li thành các ion. a/ Chất điện li mạnh : là các chất khi tan trong nước, các phân tử hòa tan đều phân li ra ion. Bao gồm : các axit mạnh như HCl, H2SO4, HNO3, HClO3, HClO4, HI, HBr,… Các bazơ mạnh như KOH, NaOH, Ba(OH)2,… và hầu hết các muối. b/ Chất điện li yếu : là các chất khi tan trong nước chỉ có một phần số phân tử hòa tan phân li ra ion, phần còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch. Bao gồm : các axit yếu như HF, H2SO3, H2S, HClO, HNO2, H3PO4, CH3COOH, HCOOH,… Các bazơ yếu như Bi(OH)3, Mg(OH)2, NH3, các amin,… Một số muối của thủy ngân HgCl2, Hg(CN)2,… c/ Chất không điện li : là những chất khi tan vào nước hoàn toàn không phân li thành ion. Ví dụ : saccarozơ C12H22O11 , ancol etylic C2H5OH , glixerol C3H5(OH)3 ,… |
|
Cách biểu diễn |
- Trong phương trình của chất điện li mạnh, dùng mũi tên 1 chiều : KOH → K+ + OH- ; Na2SO4 → 2Na+ + SO42- … - Trong phương trình của điện li yếu, dùng mũi tên 2 chiều : CH3COOH CH3COO- + H+ ; H2S HS- + H+ … |
|
Axit |
1. Định nghĩa : Theo thuyết Arenius, axit là chất khi tan trong nước, phân li ra cation H+ . Thí dụ : HCl → H+ + Cl- ; HCOOH HCOO- + H+ Các dung dịch axit đều có một số tính chất chung, đó là tính chất của các cation H+ trong dung dịch. Từ hai thí dụ ta thấy, phân tử HCl cũng như phân tử HCOOH trong dung dịch nước chỉ phân li một nấc ra ion H+. Đó là axit một nấc. 2. Axit nhiều nấc : Những axit khi tan trong nước mà phân tử phân li nhiều nấc ra ion H+ là các axit nhiều nấc (đa axit) H3PO4 H+ + H2PO4- H2PO4- H+ + HPO42- HPO42- H+ + PO43- Phân tử H3PO4 phân li ba nấc ra ion H+ , H3PO4 là axit ba nấc. |
|
Bazơ |
Theo thuyết Arenius, bazơ là chất khi tan trong nước phân li ra ion OH- . Ví dụ : NaOH → Na+ + OH- ; Ba(OH)2 → Ba2+ + 2OH- * Hiđroxit lưỡng tính : là các hiđroxit khi tan trong nước vừa có thể phân li như axit, vừa có thể phân li như bazơ. Các hiđroxit lưỡng tính thường gặp là : Be(OH)2, Zn(OH)2, Pb(OH)2, Sn(OH)2, Al(OH)3, Cr(OH)3. Chúng đều ít tan trong nước, lực axit (khả năng phân li ra ion) và lực bazơ đều yếu. Ví dụ 1: phương trình điện li của Zn(OH)2 ↔ H2ZnO2 + Phân li kiểu bazơ : Zn(OH)2 Zn2+ + 2OH- + Phân li kiểu axit : H2ZnO2 ZnO22- + 2H+ Ví dụ 2 : phương trình điện li của Al(OH)3 ↔ HAlO2.H2O + Phân li kiểu bazơ : Al(OH)3 Al3+ + 3OH- + Phân li kiểu axit : HAlO2.H2O H+ + AlO2- + H2O |
|
Muối |
Là hợp chất khi tan trong nước, phân li ra cation kim loại (hoặc cation NH4+) và anion gốc axit. a/ Muối trung hòa : là những muối mà anion gốc axit không còn hiđro có khả năng phân li ra ion H+ : NaCl, NH4NO3, K2CO3,… hoặc anion gốc axit còn hiđro nhưng không có khả năng phân li ra ion H+ : Na2HPO3 , NaH2PO3. b/ Muối axit : là những muối mà anion gốc axit vẫn còn hiđro có khả năng phân li ra ion H+ : NaHCO3 , KHSO4, Na2HPO4,… c/ Muối hỗn tạp : là những muối trong thành phần phân tử gồm cation kim loại với nhiều anion khác nhau. Ví dụ : clorua vôi CaOCl2 có 2 gốc axit Cl – Ca – OCl. d/ Muối kép : là muối trong thành phần phân tử gồm nhiều cation kim loại, một loại ion âm. Ví dụ : kali nhôm sunfat KAl(SO4)2 (phèn chua) … |
|
Tích số ion của nước |
(ở 250C). Một cách gần đúng, có thể coi giá trị của tích số này là hằng số cả trong dd loãng của các chất khác nhau. |
|
Các giá trị [H+] và pH đặc trưng |
- Môi trường trung tính : [H+] = [OH-] = 10-7M hoặc pH = 7 - Môi trường axit : [H+] > [OH-] hay [H+] > 10-7M hoặc pH < 7 - Môi trường bazơ : [H+] < [OH-] hay [H+] < 10-7M hoặc pH > 7 |
|
Khái niệm pH và ý nghĩa thực tiễn |
- Có thể đánh giá độ axit và độ kiềm của dung dịch bằng nồng độ H+ . Nhưng dd thường có nồng độ H+ nhỏ. Để tránh ghi nồng độ H+ với số mũ âm, người ta dùng giá trị pH với quy ước sau : pH = -log[H+] . Nếu [H+] = 1,0.10-a thì pH = a. - Giá trị pH có ý nghĩa thực tế to lớn. Chẳng hạn, pH của máu người và động vật có giá trị gần như không đổi. Thực vật chỉ có thể sinh trưởng bình thường khi giá trị pH của dd trong đất ở trong khoảng xác định đặc trưng cho mỗi loại cây. Tốc độ ăn mòn kim loại trong nước tự nhiên phụ thuộc rất nhiều vào giá trị pH của nước mà kim loại tiếp xúc. |
|
Chất chỉ thị axit – bazơ |
Là chất có màu biến đổi phụ thuộc vào giá trị pH của dung dịch. + Quỳ tím : đỏ (pH ≤ 6) , tím (pH = 7) , xanh (pH ≥ 8) + Phenolphtalein : không màu (pH < 8,3), hồng (pH ≥ 8,3) (trong xút đặc, màu hồng bị mất) |
|
PHẢN ỨNG TRAO ĐỔI ION TRONG DUNG DỊCH |
|
|
- Phản ứng xảy ra trong dung dịch các chất điện li là phản ứng giữa các ion. - Điều kiện : + Các chất tham gia phản ứng trao đổi ion phải là chất tan (dung dịch) , trừ 1 số trường hợp muối không tan tác dụng với axit mạnh (FeS + HCl ; CaCO3 + HNO3 ,…) + Phản ứng chỉ xảy ra khi các ion kết hợp được với nhau tạo thành ít nhất một trong các chất sau : chất kết tủa, chất khí, chất điện li yếu. - Phương trình ion thu gọn cho biết bản chất của phản ứng trong dịch các chất điện li. - Trong phương trình ion thu gọn, người ta loại bỏ những ion không tham gia phản ứng, còn những chất kết tủa, điện li yếu, chất khí được giữ nguyên dưới dạng phân tử. |
|
|
1. Phản ứng tạo thành chất kết tủa |
Ví dụ 1 : Na2SO4 + BaCl2 → BaSO4 ↓ + 2NaCl - Bước 1 : viết phương trình ion đầy đủ: ta chuyển tất cả các chất vừa dễ tan, vừa điện li mạnh thành ion, các chất khí, kết tủa, điện li yếu để nguyên dạng phân tử. 2Na+ + SO42- + Ba2+ + 2Cl- → BaSO4 ↓ + 2Na+ + 2Cl- - Bước 2 : lược bỏ những ion không tham gia phản ứng:
- Bước 3 : ta được phương trình ion thu gọn : Ba2+ + SO42- → BaSO4 ↓ Ví dụ 2 : AgNO3 + HCl → AgCl ↓ + HNO3 - Bước 1 : Ag+ + NO3- + H+ + Cl- → AgCl ↓ + H+ + NO3-
- Bước 3 : Ag+ + Cl- → AgCl ↓ |
|
2. Phản ứng tạo thành chất khí |
Ví dụ 1 : 2HCl + K2CO3 → 2KCl + CO2 ↑ + H2O - Bước 1 : 2H+ + 2Cl- + 2K+ + CO32- → 2K+ + 2Cl- + CO2 ↑ + H2O
- Bước 3 : 2H+ + CO32- → CO2 ↑ + H2O Ví dụ 2 : FeS (r) + H2SO4 → FeSO4 + H2S ↑
- Bước 2 : FeS + 2H+ + SO42- → Fe2+ + SO42- + H2S ↑ - Bước 3 : FeS + 2H+ → Fe2+ + H2S ↑ |
|
3. Tạo thành chất điện li yếu |
Ví dụ 1 : HNO3 + KOH → KNO3 + H2O - Bước 1 : H+ + NO3- + K+ + OH- → K+ + NO3- + H2O
- Bước 3 : H+ + OH- → H2O Ví dụ 2 : CH3COONa + HCl → CH3COOH + NaCl - Bước 1 : CH3COO- + Na+ + H+ + Cl- → CH3COOH + Na+ + Cl-
- Bước 3 : CH3COO- + H+ → CH3COOH |
CHƯƠNG II : NITƠ - PHOTPHO
|
NITƠ (N) |
|
|
I. Vị trí, cấu hình e nguyên tử |
- Nitơ ở ô số 7, nhóm VA, chu kì 2 - Cấu hình e : 1s22s22p3. - Ba e ở phân lớp 2p có thể tạo được ba liên kết cộng hóa trị với các nguyên tử khác. - Phân tử nitơ gồm hai nguyên tử, giữa chúng hình thành một liên kết ba. - CTCT phân tử N2 là : N≡N |
|
II. Tính chất vật lí và trạng thái tự nhiên |
- Điều kiện thường, là chất khí không màu, không vị, không mùi, hơi nhẹ hơn không khí, hóa lỏng ở -1960C, rất ít tan trong nước (ở điều kiện thường, 1 lít nước hòa tan được 0,015 lít khí nitơ). Nitơ không duy trì sự cháy và sự hô hấp. - Trong tự nhiên, nitơ tồn tại ở dạng tự do và dạng hợp chất. + Ở dạng tự do, khí nitơ chiếm 78,16% thể tích không khí (≈ 4/5 thể tích không khí). Nitơ thiên nhiên là hỗn hợp của 2 đồng vị : (99,63%) và (0,37%). + Ở dạng hợp chất, nitơ có nhiều trong khoáng chất natri nitrat NaNO3 (diêm tiêu natri) |
|
III. Tính chất hóa học |
- Ở nhiệt độ thường, nitơ khá trơ về mặt hóa học (do liên kết ba trong phân tử nitơ rất bền, ở 30000C nó vẫn chưa bị phân hủy rõ rệt thành các nguyên tử). Ở nhiệt độ cao, nitơ trở nên hoạt động hơn và tác dụng được với nhiều chất. - N có các số oxi hóa : -3 , từ +1 đến +5. Khi tham gia phản ứng oxi hóa – khử, số oxi hóa của N có thể tăng hoặc giảm, do đó nó thể hiện tính khử hoặc là tính oxi hóa. Tuy nhiên, tính oxi hóa vẫn là tính chất chủ yếu. 1. Tính oxi hóa : Trong các hợp chất cộng hóa trị của nitơ với những nguyên tố có độ âm điện nhỏ hơn (như hiđro, kim loại,…), nguyên tố nitơ có số oxi hóa -3. a/ Tác dụng với kim loại : - Ở nhiệt độ thường, nitơ chỉ tác dụng với kim loại liti, tạo thành liti nitrua: 6Li + N2 → 2Li3N - Ở nhiệt độ cao, nitơ tác dụng được với một số kim loại hoạt động như Mg, Ca, Al,… tạo thành nitrua kim loại. 2Ca + N2 Ca3N2 (canxi nitrua) 2Al + N2 2AlN (nhôm nitrua) b/ Tác dụng với hiđro : N2 + 3H2 2NH3 2. Tính khử : Trong các hợp chất cộng hóa trị của nitơ với những nguyên tố có độ âm điện lớn hơn (như oxi,flo), nguyên tố nitơ có số oxi hóa dương, có thể từ +1 đến +5. N2 + O2 2NO Trong thiên nhiên, khí NO được tạo thành khi có sấm sét. Ở điều kiện thường, khí NO không màu kết hợp ngay với khí oxi của không khí tạo ra khi nitơ đioxit NO2 màu nâu đỏ : 2NO + O2 → 2NO2 Ngoài các oxit trên, các oxit khác của nitơ như N2O, N2O3, N2O5, chúng không điều chế trực tiếp bằng phản ứng giữa nitơ và oxi. |
|
IV. Ứng dụng |
- Nguyên tố nitơ là một trong những thành phần dinh dưỡng chính của thực vật. - Trong công nghiệp, phần lớn lượng khí nitơ sản xuất ra được dùng để tổng hợp khí amoniac, từ đó sản xuất ra axit nitric, phân đạm,… - Nhiều ngành công nghiệp như luyện kim, thực phẩm, điện tử,… sử dụng nitơ làm môi trường trơ. Nitơ lỏng được dùng để bảo quản máu và các mẫu vật khác. |
|
V. Điều chế |
1. Trong công nghiệp : phương pháp chưng cất phân đoạn không khí lỏng. 2. Trong phòng thí nghiệm : - Một lượng nhỏ nitơ tinh khiết được điều chế bằng cách đun nóng nhẹ dung dịch bão hào muối amoni nitrit : NH4NO2 N2 + 2H2O - Muối này kém bền, có thể thay thế bằng dung dịch bão hòa của amoni clorua và natri nitrit : NH4Cl + NaNO2 N2 + NaCl + 2H2O |
|
AMONIAC (NH3) |
|
|
I. Cấu tạo phân tử |
|
|
II. Tính chất vật lí |
Là chất khí không màu, mùi khai và xốc, nhẹ hơn không khí, tan rất nhiều trong nước (ở điều kiện thường, 1 lít nước hòa tan được khoảng 800 lít khí amoniac) |
|
III. Tính chất hóa học |
1. Tính bazơ yếu : a. Tác dụng với nước : Khi tan trong nước, NH3 kết hợp với ion H+ của nước, tạo thành ion NH4+ và OH- , làm cho dd có tính bazơ và dẫn điện : NH3 + H2O NH4+ + OH- Trong dd, amoniac là 1 bazơ yếu, hóa xanh quỳ tím, hóa hồng phenolphtalein. b. Tác dụng với dd muối : - Dung dịch amoniac có thể tác dụng với dd muối của nhiều kim loại, tạo thành kết tủa hiđroxit của kim loại đó. FeSO4 + 2NH3 + 2H2O → (NH4)2SO4 + Fe(OH)2 ↓ - Với các dd muối Cu2+ , Zn2+ , Ag+ có thể tạo phức chất tan [Cu(NH3)4]2+ , [Zn(NH3)4]2+ , [Ag(NH3)2]+ CuCl2 + 2NH3 + 2H2O → 2NH4Cl + Cu(OH)2 ↓ 4NH3 + Cu(OH)2 → [Cu(NH3)4](OH)2 (phức xanh thẫm) c. Tác dụng với axit : Khí amoniac, cũng như dd amoniac, tác dụng với dd axit tạo ra muối amoni NH3 + HCl → NH4Cl ; 2NH3 + H2SO4 → (NH4)2SO4 2. Tính khử mạnh : Trong phân tử amoniac, N có số oxi hóa -3 (số oxi hóa thấp nhất), vì vậy amoniac có tính khử. Tính chất này được thể hiện khi amoniac tác dụng với các chất oxi hóa. a. Với oxi : 4NH3 + 3O2 2N2 + 6H2O (phản ứng cháy với ngọn lửa màu vàng) 4NH3 + 5O2 4NO + 6H2O b. Với clo : clo oxi hóa mạnh amoniac tạo nitơ và hiđro clorua 2NH3 + 3Cl2 → N2 + 6HCl Đồng thời NH3 kết hợp ngay với HCl tạo thành “khói” trắng NH4Cl NH3 + HCl → NH4Cl Tổng hợp : 8NH3 + 3Cl2 → N2 + 6NH4Cl c. Với CuO : 2NH3 + 3CuO 3Cu + N2 + 3H2O |
|
IV. Điều chế và ứng dụng |
1. Điều chế : a. Trong phòng thí nghiệm : đun nóng muối amoni với dd kiềm. 2NH4Cl + Ca(OH)2 CaCl2 + 2NH3 ↑ + 2H2O Để làm khô khí, người ta cho khí amoniac vừa tạo thành có lẫn hơi nước đi qua bình đựng vôi sống (CaO). Khi muốn điều chế nhanh một lượng nhỏ khí amoniac, người ta thường đun nóng dd amoniac đậm đặc. b. Trong công nghiệp : tổng hợp tử nitơ và hiđro
Đây là phản ứng thuận nghịch và tỏa nhiệt. Các điều kiện áp dụng trong công nghiệp sản xuất amoniac là : - Nhiệt độ : 450 - 5000C. Ở nhiệt độ thấp hơn, cân bằng hóa học trên chuyển dịch sang phải làm tăng hiệu suất phản ứng, nhưng lại làm giảm tốc độ phản ứng. - Áp suất cao, từ 200 – 300 atm. - Chất xúc tác là sắt kim loại được trộn thêm Al2O3, K2O,… Trong khí amoniac tạo thành còn lẫn nitơ và hiđro. Hỗn hợp được làm lạnh, chỉ có amoniac hóa lỏng và tách ra. Còn nitơ và hiđro chưa tham gia phản ứng lại được bổ sung vào hỗn hợp nguyên liệu ban đầu. 2. Ứng dụng : Amoniac được sử dụng chủ yếu để sản xuất axit nitric, phân đạm như urê, amoni nitrat, amoni sunfat,… ; điều chế hiđrazin N2H4 làm nhiên liệu tên lửa. Amoniac lỏng được dùng làm chất gây lạnh trong thiết bị lạnh. |
|
PHOTPHO (P) |
||
|
I. Vị trí và cấu hình e nguyên tử |
- Photpho ở ô số 15, nhóm VA, chu kì 3 - Cấu hình e : 1s22s22p63s23p3 Do lớp ngoài cùng có 5 e , nên trong các hợp chất, hóa trị của p có thể là 5. Ngoài ra, trong 1 số hợp chất, P còn có hóa trị 3. |
|
|
II. Tính chất vật lí |
Photpho có thể tồn tại ở 1 số dạng thù hình khác nhau, nhưng quan trọng hơn cả là Photpho trắng và Photpho đỏ. |
|
|
1. Photpho trắng |
2. Photpho đỏ |
|
|
- Chất rắn trong suốt, màu trắng hoặc hơi vàng, trông giống như sáp, có cấu trúc mạng tinh thể nguyên tử. Trong tinh thể, những phân tử P4 nằm ở nút mạng và liên kết với nhau bằng liên kết yếu. Do đó P trắng mềm, dễ nóng chảy (tnc = 44,10C). - P trắng không tan trong nước, tan trong các dung môi hữu cơ : C6H6, CS2,… rất độc, gây bỏng. - P trắng bốc cháy trong không khí ở t0 > 400C, nên được bảo quản bằng cách ngâm trong nước. - Phát quang màu lục nhạt trong bóng tối ở nhiệt độ thường. P trắng P đỏ |
- Chất bột màu đỏ, dễ hút ẩm và chảy rữa, bền trong không khí ở nhiệt độ thường, không phát quang màu lục trong bóng tối, không tan trong các dung môi thông thường. - P đỏ có cấu trúc polime, nên khó nóng chảy, chỉ bốc cháy ở nhiệt độ trên 2500C, khó bay hơi hơn P trắng. - Khi đun nóng không có không khí, P đỏ chuyển thành hơi, khi làm lạnh thì hơi đó ngưng tụ lạnh thành P trắng. |
|
|
III. Tính chất hóa học |
P là phi kim tương đối hoạt động. P trắng hoạt động hóa học mạnh hơn P đỏ. Trong các hợp chất, P có số oxi hóa -3, +3, +5. Do đó, khi tham gia phản ứng hóa học P thể hiện tính oxi hóa hoặc tính khử. 1. Tính oxi hóa : P thể hiện tính oxi hóa khi tác dụng với một số kim loại hoạt động tạo ra photphua kim loại. 2P + 3Mg Mg3P2 (magie photphua) 2P + 3Zn Zn3P2 (kẽm photphua – thuốc chuột) 2. Tính khử : P thể hiện tính khử khi tác dụng với các phi kim hoạt động như oxi, halogen, lưu huỳnh,… và các hợp chất có tính oxi hóa mạnh khác. 4P + O2 (thiếu) 2P2O3 (điphotpho trioxit) 4P + O2 (dư) 2P2O5 (điphotpho pentaoxit) 2P + 3Cl2 (thiếu) 2PCl3 (photpho triclorua) 2P + 5Cl2 (dư) 2PCl5 (photpho pentaclorua) 3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO 6P + 5K2Cr2O7 → 5K2O + 5Cr2O3 + 3P2O3 6P (đỏ) + 5KClO3 3P2O5 + 5KCl (phản ứng xảy ra trong quá trình đốt diêm) |
|
|
IV. Trạng thái tự nhiên - ứng dụng – sản xuất |
1. Trạng thái tự nhiên : Trong tự nhiên không gặp P ở trạng thái tự do vì nó khá hoạt động về mặt hóa học. Hai khoáng vật chính của P là photphorit Ca3(PO4)2 và apatit 3Ca3(PO4)2.CaF2 . 2. Ứng dụng : - Phần lớn Photpho sản xuất ra được sử dụng dùng để sản xuất axit photphoric, phần còn lại chủ yếu dùng trong sản xuất diêm. - Ngoài ra, Photpho còn được dùng trong vào mục đích quân sự : sản xuất bom, đạn cháy, đạn khói,… 3. Sản xuất : Ca3(PO4)2 + 3SiO2 + 5C 3CaSiO3 + 5CO + 2P (hơi P thoát ra được ngưng tụ khi làm lạnh, sẽ thu được P trắng ở dạng rắn). |
|
|
Muối amoni |
Muối amoni là chất tinh thể ion, gồm cation amoni NH4+ và anion gốc axit. I. Tính chất vật lí : Tất cả các muối amoni đều tan nhiều trong nước, khi tan điện li hoàn toàn thành các ion. Ion NH4+ không màu. II. Tính chất hóa học : 1. Tác dụng với dd kiềm : Dung dịch đậm đặc của muối amoni phản ứng với dd kiềm khi đun nóng sẽ cho khí amoniac bay ra (NH4)2CO3 + KOH K2CO3 + 2NH3 ↑ + 2H2O Phương trình ion thu gọn : NH4+ + OH- → NH3 ↑ + H2O (Phản ứng dùng để nhận biết ion amoni và điều chế amoniac trong phòng thí nghiệm). 2. Phản ứng nhiệt phân : các muối amoni dễ bị phân hủy bởi nhiệt. a/ Muối amoni chứa gốc của axit không có tính oxi hóa (Cl- , HSO4- , SO42- , HCO3-, CO32-,…) khi đun nóng bị phân hủy thành amoniac. NH4Cl NH3 + HCl (NH4)2CO3 NH3 + NH4HCO3 (NH4)2SO4 NH3 + NH4HSO4 NH4HSO4 NH3 + N2 + 3SO2 + 6H2O NH4HCO3 NH3 + CO2 + H2O (NH4HCO3 được dùng làm bột nở) b/ Muối amoni chứa gốc axit có tính oxi hóa như axit nitrơ, axit nitric khi bị nhiệt phân cho N2 , N2O (đinitơ oxit). NH4NO2 N2 + 2H2O ; NH4NO3 N2O + 2H2O (các phản ứng này dùng để điều chế N2 và N2O trong phòng thí nghiệm) |
|
Muối nitrat |
Muối của axit nitric được gọi là muối nitrat. I. Tính chất vật lí : Tất cả các muối nitrat đều dễ tan trong nước và là chất điện li mạnh. Trong dd loãng, chúng phân li hoàn toàn thành các ion. Ion NO3- không màu. II. Tính chất hóa học : 1. Phản ứng nhiệt phân : - Các muối nitrat của kim loại hoạt động mạnh (Na, K,…) bị phân hủy tạo ra muối nitrit và O2. NaNO3 NaNO2 + O2 - Muối nitrat của Mg, Zn, Fe, Pb, Cu,… bị phân hủy tạo ra oxit của kim loại tương ứng, NO2 và O2. 2Cu(NO3)2 2CuO + 4NO2 + O2 4Al(NO3)3 2Al2O3 + 12NO2 + 3O2 4Fe(NO3)2 2Fe2O3 + 8NO2 + O2 4Fe(NO3)3 2Fe2O3 + 12NO2 + 3O2 - Muối nitrat của Ag, Au, Hg,… bị phân hủy tạo thành kim loại tương ứng, NO2 và O2 2AgNO3 2Ag + 2NO2 + O2 Hg(NO3)2 Hg + 2NO2 + O2 2. Phản ứng oxi hóa – khử : 3Cu + 8H+ + 2NO3- 3Cu2+ + 2NO ↑ + 4H2O 2NO + O2 (không khí) → 2NO2 (màu nâu đỏ) (phản ứng để nhận biết ion NO3- trong dung dịch) III. Ứng dụng : - Các muối nitrat chủ yếu được sử dụng làm phân bón (phân đạm). Ví dụ : NH4NO3 (đạm 2 lá), NaNO3, KNO3,… - Kali nitrat còn được dùng chế tạo thuốc nổ đen (thuốc nổ có khói). Thuốc nổ đen chứa 75% KNO3 , 10% S và 15% C. |
|
Muối photphat |
Muối photphat là muối của axit photphoric. Gồm 3 loại muối : - Muối photphat trung hòa : Na3PO4, (NH4)3PO4 , Ca3(PO4)2 ,… - Muối đihiđrophotphat : KH2PO4, NH4H2PO4 , Ca(H2PO4)2 ,… - Muối hiđrophotphat : Na2HPO4 , (NH4)2HPO4 , CaHPO4 ,… 1. Tính tan : tất cả muối đihiđrophotphat đều tan. Trong các muối hiđrophotphat và photphat trung hòa chỉ có muối của kim loại Na, K và amoni là dễ tan còn muối các kim loại khác đều không tan hoặc ít tan. 2. Nhận biết ion photphat : 3Ag+ + PO43- → Ag3PO4 ↓ (màu vàng) (kết tủa này không tan trong nước, nhưng tan trong dd axit nitric loãng) |
|
|
AXIT NITRIC (HNO3) |
AXIT PHOTPHORIC (H3PO4) |
|
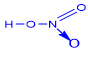
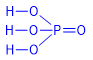
I. Cấu tạo phân tử |
Trong hợp chất HNO3, N có số oxi hóa cao nhất là +5 và hóa trị IV. |
Trong hợp chất H3PO4 , P có số oxi hóa cao nhất là +5 và hóa trị V.
|
|
II. Tính chất vật lí |
- Là chất lỏng không màu, bốc khói mạnh trong không khí ẩm. - Kém bền, phân hủy ngay ở nhiệt độ thường khi có ánh sáng 4HNO3 Khí NO2 (nitơ đioxit) tan trong dd axit, làm cho dd có màu vàng. - Tan trong nước theo bất kì tỉ lệ nào. |
Là chất tinh thể trong suốt, nóng chảy ở 42,50C, rất háo nước nên dễ chảy rữa, tan trong nước theo bất kì tỉ lệ nào. Axit photphoric thường dùng là dd đặc, sánh, không màu, nồng độ 85%. |
|
III. Tính chất hóa học |
1. Tính axit : Là một trong các axit mạnh nhất, trong dd loãng phân li hoàn toàn thành ion H+ và NO3-. Làm quỳ tím hóa đỏ, tác dụng bazơ, oxit bazơ và muối của axit yếu hơn tạo thành muối nitrat. MgO + 2HNO3 → Mg(NO3)2 + H2O Ca(OH)2 + 2HNO3 → Ca(NO3)2 + 2H2O BaCO3 + 2HNO3 → Ba(NO3)2 + CO2 + H2O 2. Tính oxi hóa mạnh : Axit nitric là một trong những axit có tính oxi hóa mạnh. Tùy thuộc vào nồng độ của axit và độ mạnh yếu của chất khử, mà HNO3 có thể bị khử đến các sản phẩm khác nhau của nitơ. a. Tác dụng với kim loại : + HNO3 phản ứng với hầu hết các kim loại trừ Au và Pt → muối nitrat + H2O và sản phẩm khử của N+5 (NO2, NO, N2O, N2 và NH4NO3). + Với các kim loại có tính khử mạnh : Mg, Al, Zn,… HNO3 loãng có thể bị khử đến N2O, N2, NH4NO3. Cu + 4HNO3 (đặc)→ Cu(NO3)2 + 2NO2 + 2H2O Fe + 4HNO3 loãng → Fe(NO3)3 + NO + 2H2O 4Zn + 10HNO3 → 4Zn(NO3)2 + NH4NO3 + 3H2O * Chú ý : Fe, Al, Cr bị thụ động trong dd HNO3 đặc, nguội do tạo màng oxit bền, bảo vệ kim loại khỏi tác dụng của axit → dùng bình Al hoặc Fe để đựng HNO3 đặc nguội. * Au, Pt tan được trong nước cường toan (cường thủy 3HCl : 1HNO3), không hòa tan được Ag vì tạo kết tủa AgCl. Au + 3HCl + HNO3 → AuCl3 + NO + 2H2O b. Tác dụng với phi kim : S + 6HNO3 H2SO4 + 6NO2 + 2H2O C + 4HNO3 CO2 + 4NO2 + 2H2O 5HNO3 + P H3PO4 + 5NO2 + H2O 5HNO3 + 3P + 2H2O → 3H3PO4 + 5NO c. Tác dụng với hợp chất : HNO3 đặc còn oxi hóa được hợp chất vô cơ và hữu cơ. Vải, giấy, mùn cưa, dầu thông,… bị phá hủy hoặc bốc cháy khi tiếp xúc với HNO3 đặc. 4HNO3 + FeCO3 → Fe(NO3)3 + NO2 + 2H2O + CO2 Fe3O4 + 10HNO3 → 3Fe(NO3)3 + NO2 + 5H2O |
- Có tính chất của axit (làm quỳ tím hóa đỏ, kim loại trước H trong dãy hoạt động hóa học, tác dụng bazơ, oxit bazơ và 1 số muối) 2H3PO4 + 3Na2O → 2Na3PO4 + 3H2O 2H3PO4 + 3Mg → Mg3(PO4)2 + 3H2 H3PO4 + 3AgNO3 → 3HNO3 + Ag3PO4 - Có độ mạnh trung bình, là axit 3 nấc. Trong dd nước, nó phân li theo từng nấc : Nấc 1 : H3PO4 H+ + H2PO4- (chủ yếu) Nấc 2 : H2PO4- H+ + HPO42- (kém hơn) Nấc 3 : HPO42- H+ + PO43- (rất yếu) → trong dd axit photphoric chứa các ion H+ , H2PO4- , HPO42- , PO43- và các phân tử H3PO4 không phân li (không kể các ion H+ và OH- do nước phân li) - Khi tác dụng với dd kiềm, tùy theo lượng chất tác dụng mà axit photphoric tạo ra muối axit, muối trung hòa hoặc hỗn hợp muối đó. KOH + H3PO4 → KH2PO4 + H2O 2KOH + H3PO4 → K2HPO4 + 2H2O 3KOH + H3PO4 → K3PO4 + 3H2O - Khác với axit nitric, axit photphoric không có tính oxi hóa. |
|
IV. Ứng dụng |
Phần lớn axit nitric sản xuất ra được dùng để điều chế phân đạm NH4NO3, Ca(NO3)2,… Ngoài ra, axit nitric còn được dùng để điều chế thuốc nổ (TNT,…), thuốc nhuộm, dược phẩm,… |
Một lượng lớn axit H3PO4 loại kĩ thuật được dùng để điều chế muối photphat và để sản xuất phân lân, hợp chất cơ photpho (làm thuốc trừ sâu),… H3PO4 tinh khiết được dùng trong công nghiệp dược phẩm. |
|
V. Điều chế |
1. Trong phòng thí nghiệm : Đun nóng hỗn hợp natri nitrat rắn hoặc kali nitrat rắn với axit sunfuric đặc NaNO3 + H2SO4 HNO3 + NaHSO4 Hơi HNO3 thoát ra được dẫn vào bình làm lạnh và ngưng tụ ở đó. 2. Trong công nghiệp : Đi từ amoniac qua 3 giai đoạn : 4NH3 + 5O2 4NO + 6H2O (∆H < 0) 2NO + O2 → NO2 4NO2 + O2 + 2H2O → 4HNO3 dd HNO3 thu được thường có nồng độ 52 – 68%. Để có axit nitric với nồng độ cao hơn 68%, người ta chưng cất axit này với H2SO4 đậm đặc. |
1. Trong phòng thí nghiệm : P + 5HNO3 (đặc) H3PO4 + 5NO2 + H2O 2. Trong công nghiệp : Ca3(PO4)2 + 3H2SO4 đặc 3CaSO4 + 2H3PO4 Để điều chế H3PO4 với độ tinh khiết cao ta dùng sơ đồ: P → P2O5 → H3PO4 4P + 5O2 → 2P2O5 P2O5 + 3H2O → 2H3PO4 |