Hệ thống kiến thức Hóa học lớp 11 Học kì 2
Hệ thống kiến thức Hóa học lớp 11 Học kì 2 chi tiết giúp học sinh ôn luyện để đạt điểm cao trong bài thi Hóa học 11 Học kì 2. Mời các bạn cùng đón xem:
Hệ thống kiến thức Hóa học lớp 11 Học kì 2
ANKAN (PARAFIN)
I. ĐỊNH NGHĨA, ĐỒNG ĐẲNG, ĐỒNG PHÂN, DANH PHÁP :
1. Định nghĩa :
- Hiđrocacbon no là hiđrocabon mà trong phân tử chỉ có liên kết đơn.
- Ankan (hay parafin) là những hi đrocacbon no không có mạch vòng.
2. Dãy đồng đẳng ankan : Công thức chung CnH2n+2 (n ≥ 1, nguyên)
3. Đồng phân và danh pháp : Từ C4H10 trở đi, ứng với mỗi CTPT có CTCT mạch cacbon không phân nhánh và mạch cacbon phân nhánh của các đồng phân mạch cacbon.
Bảng : tên 1 số ankan mạch không nhánh và tên gốc ankyl tương ứng
|
CTPT |
CTCT thu gọn |
Tên gọi |
Gốc ankyl |
Tên gốc |
|
CH4 |
CH4 |
Metan |
CH3– |
Metyl |
|
C2H6 |
CH3 – CH3 |
Etan |
CH3 – CH2– |
Etyl |
|
C3H8 |
CH3 – CH2 – CH3 |
Propan |
CH3 – CH2 – CH2– |
Propyl |
|
C4H10 |
CH3 – [CH2]2 – CH3 |
Butan |
CH3 – [CH2]2 – CH2– |
Butyl |
|
C5H12 |
CH3 – [CH2]3 – CH3 |
Pentan |
CH3 – [CH2]3 – CH2– |
Pentyl |
|
C6H14 |
CH3 – [CH2]4 – CH3 |
Hexan |
CH3 – [CH2]4 – CH2– |
Hexyl |
|
C7H16 |
CH3 – [CH2]5 – CH3 |
Heptan |
CH3 – [CH2]5 – CH2– |
Heptyl |
|
C8H18 |
CH3 – [CH2]6 – CH3 |
Octan |
CH3 – [CH2]6 – CH2– |
Octyl |
|
C9H20 |
CH3 – [CH2]7 – CH3 |
Nonan |
CH3 – [CH2]7 – CH2– |
Nonyl |
|
C10H22 |
CH3 – [CH2]8 – CH3 |
Đecan |
CH3 – [CH2]8 – CH2– |
Đecyl |
v Đối với đồng phân mạch không phân nhánh gọi : từ gốc + an.
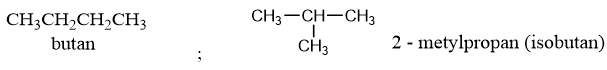
Ví dụ : CH3CH2CH2CH3 : butan ; CH3CH2CH2CH2CH3 : pentan …
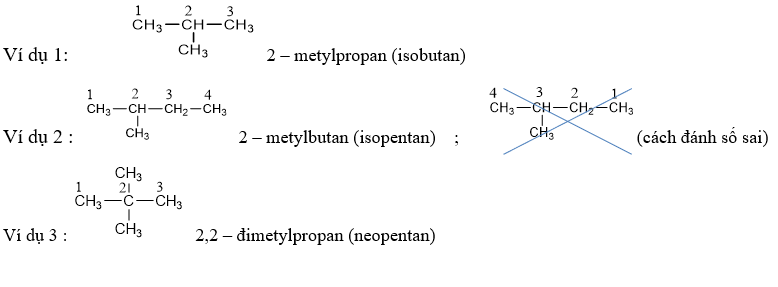
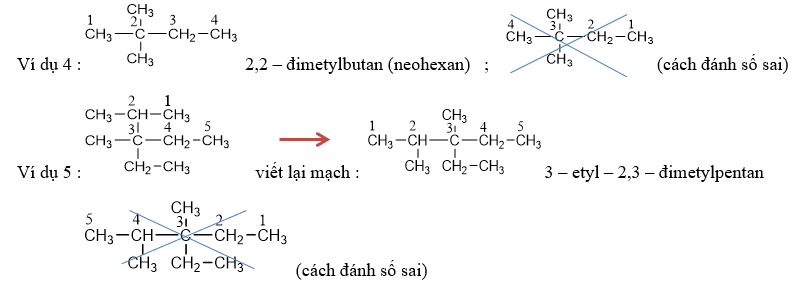
v Đối với đồng phân mạch phân nhánh :
- Chọn mạch cacbon dài nhất, có nhiều nhánh nhất làm mạch chính.
- Đánh số thứ tự các nguyên tử cacbon mạch chính từ phía gần nhánh hơn (quy tắc : tổng số vị trí nhánh là nhỏ nhất).
- Tên các nhánh (nhóm ankyl) gọi theo thứ tự a, b, c,…
· Cách gọi : số chỉ vị trí nhánh + số lượng nhánh (2 : đi , 3 : tri , 4 : tetra, 5 : penta,…) + tên nhánh + tên mạch chính + an.
v Một số chất có tên thông thường, thí dụ : isopentan, neopentan,…
- Khi có 1 nhóm metyl (CH3–) gắn vào cacbon vị trí số 2, ta thêm chữ iso + toàn bộ số cacbon.
- Khi có 2 nhóm metyl (CH3–) gắn vào cacbon vị trí số 2, ta thêm chữ neo + toàn bộ số cacbon.
v Bậc của nguyên tử Cacbon trong hiđrocacbon no : được tính bằng số liên kết của nó với nguyên tử Cacbon khác.
|
Cacbon mang số |
1 |
2 |
3 |
4 |
5 |
|
Bậc của cacbon |
I |
III |
IV |
II |
I |
a. Đồng phân của C4H10 :
b. Đồng phân của C5H12 :

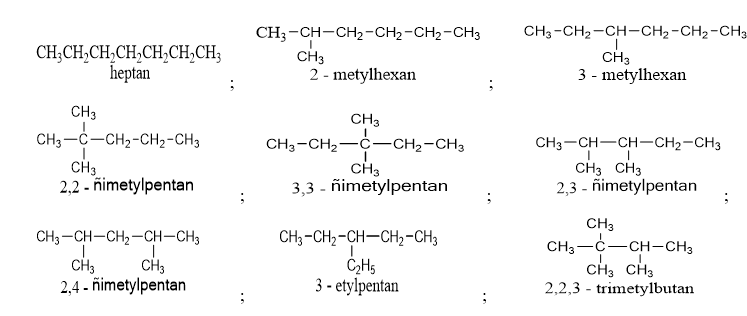
c. Đồng phân của C6H14 :
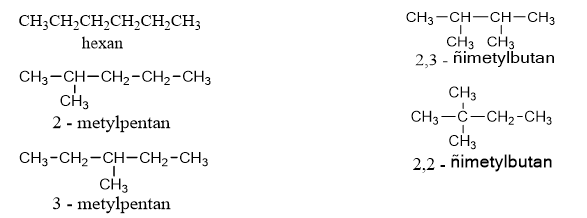
d. Đồng phân của C7H14 :
II. TÍNH CHẤT VẬT LÍ :
- Ở điều kiện thường, từ C1 → C4 là chất khí, từ C5 → C17 là chất lỏng, từ C18 trở đi là chất rắn.
- Tất cả các ankan đều nhẹ hơn nước và hầu như không tan trong nước, nhưng tan nhiều trong các dung môi hữu cơ.
- Khi phân tử khối ankan tăng, t0nc , t0s , khối lượng riêng tăng, độ tan trong nước giảm.
III. TÍNH CHẤT HÓA HỌC :
|
- Ở điều kiện thường, các ankan không tác dụng với dd axit, dd kiềm và các chất oxi hóa như dd KMnO4 (thuốc tím),… - Khi chiếu sáng hoặc đun nóng, các ankan dễ dàng tham gia các phản ứng thế, phản ứng tách và phản ứng cháy. |
|
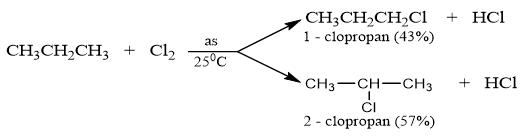
1. Phản ứng thế bởi halogen (phản ứng đặc trưng) : Tỉ lệ 1:1 , phương trình tổng quát : CnH2n+2 + X2 CnH2n+1X + HX (X là Cl hoặc Br) Ví dụ : C2H6 + Cl2 C2H5Cl + HCl Clo có thể thay thế lần lượt từng nguyên tử H trong phân tử metan 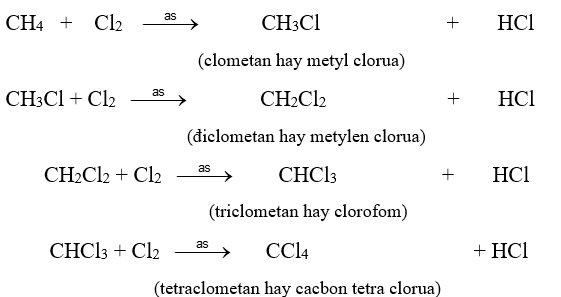
Các đồng đẳng của metan cũng tham gia phản ứng thế tương tự metan. - Với ankan nhiều C : ưu tiên thế vào H của C bậc cao. Ví dụ : - Trường hợp phản ứng theo tỉ lệ 1:1 thì có bao nhiêu vị trí C khác nhau (có H) thì có bấy nhiêu sản phẩm dẫn xuất mono clo. Nhận xét : Nguyên tử H liên kết với nguyên tử cacbon bậc cao dễ bị thế hơn nguyên tử H liên kết với nguyên tử cacbon bậc thấp hơn. Các phản ứng trên gọi là phản ứng Halogen hóa. Các sản phẩm thế được gọi là dẫn xuất halogen của hiđrocacbon. - Brom hầu như chỉ thế H ở Cacbon bậc cao. Flo phản ứng mãnh liệt nên phân hủy ankan thành C và HF. Iot quá yếu nên không phản ứng với ankan. |
|
2. Phản ứng tách : - Dưới tác dụng của nhiệt và chất xúc tác thích hợp, các ankan có phân tử khối nhỏ bị tách hiđro thành hiđrocacbon không no tương ứng. Thí dụ : CH3 – CH3 CH2 = CH2 + H2 Đặc biệt : 2CH4 CH≡CH + 3H2 - Ở nhiệt độ cao và có chất xúc tác thích hợp, ngoài việc tách hiđro, các ankan còn có thể bị phân cắt mạch cacbon tạo thành các phân tử nhỏ hơn. Thí dụ : CH3CH2CH2CH3 CH2=CH2 + CH3CH3 CH3CH2CH2CH3 CH2=CH – CH3 + CH4 Tổng quát : CnH2n+2 CxH2x + CmH2m+2 (n = x + m) |
|
3. Phản ứng oxi hóa : a. Cháy hoàn toàn : Khi bị đốt, các ankan đều cháy, tỏa nhiều nhiệt CnH2n+2 + O2 nCO2 + (n + 1)H2O Nếu thiếu oxi, phản ứng cháy của ankan xảy ra không hoàn toàn : sản phẩm cháy ngoài CO2, H2O còn C, CO,… v Ta có : ; ; Tỉ lệ b. Oxi hóa không hóa không hoàn toàn : CH4 + O2 HCHO + H2O |
IV. ĐIỀU CHẾ :
1. Trong phòng thí nghiệm :
Metan được điều chế bằng cách đun nóng natri axetat khan với hỗn hợp vôi tôi xút.
CH3COONa + NaOH CH4 ↑ + Na2CO3
Tổng quát : RCOONa + NaOH RH + Na2CO3
Cách khác điều chế metan : Al4C3 + 12H2O → 4Al(OH)3 + 3CH4
Al4C3 + 12HCl → 4AlCl3 + 3CH4
C + 2H2 CH4
2. Trong công nghiệp :
- Các ankan là thành phần chính của dầu mỏ, khí thiên nhiên và khí mỏ dầu.
- Từ dầu mỏ. bằng phương pháp chưng cất phân đoạn, ta thu được các ankan ở các phân đoạn khác nhau.
- Từ khí thiên nhiên và khí mỏ dầu cũng thu được các ankan CH4 , C2H6, C3H8 , C4H10 ,…
ANKEN (OLEFIN)
I. ĐỊNH NGHĨA, ĐỒNG ĐẲNG, ĐỒNG PHÂN, DANH PHÁP :
1. Định nghĩa : Anken (olefin) là những hiđrocacbon không no(*), mạch hở trong phân tử có một liên kết đôi C=C (có 1 liên kết π).
(*) Hiđrocacbon không no là những hiđrocacbon trong phân tử có liên kết đôi C=C hoặc liên kết ba C≡C hoặc cả hai loại liên kết đó.
2. Dãy đồng đẳng của anken : Công thức chung CnH2n (n ≥ 2, nguyên)
3. Đồng phân :
a. Đồng phân cấu tạo (đồng phân phẳng) :
- Nguyên nhân : Do cấu tạo mạch Cacbon (có nhánh, không nhánh) và do vị trí liên kết đôi khác xác nhau → xuất hiện đồng phân mạch cacbon và đồng phân vị trí liên kết đôi.
- Etilen và propilen không có đồng phân anken. Từ C4H8 trở đi xuất hiện đồng phân.
b. Đồng phân hình học :
- Nguyên nhân : Trong phân tử anken, mạch chính là mạch cacbon dài nhất có chứa liên kết đôi C=C. Những anken mà mỗi nguyên tử cacbon ở vị trí liên kết đôi, liên kết với hai nhóm nguyên tử khác nhau, sẽ có sự phân bố không gian khác nhau của mạch chính xung quanh liên kết đôi. Sự phân bố khác nhau đó tạo ra đồng phân về vị trí không gian của các nhóm nguyên tử gọi là đồng phân hình học.
- Điều kiện để có đồng phân hình học : Hai nguyên C có nối đôi phải được liên kết với các nguyên hoặc nhóm nguyên tử khác nhau.
+ Đồng phân có mạch chính ở cùng phía của liên kết đôi được gọi là đồng phân cis- .
+ Đồng phân có mạch chính ở về hai phía khác nhau của liên kết đôi được gọi là đồng phân trans- .
(*) Ví dụ : CH3 – CH = CH – C2H5 (pent – 2 – en) có đồng phân cis – trans :
4. Danh pháp :
a. Tên thông thường :
- Một số anken có tên thông thường, thí dụ : C2H4 etilen ; C3H6 propilen ; C4H8 butilen.
- Tên thông thường của các anken này được xuất phát từ tên ankan tương ứng có cùng số nguyên tử cacbon bằng cách đổi đuôi – an thành –ilen.
b. Tên thay thế (tên hệ thống) :
- Chọn mạch dài nhất chứa liên kết đôi làm mạch chính.
- Đánh số thứ tự C mạch chính bắt đầu từ phía gần liên kết đôi.
v Đối với anken mạch không phân nhánh : tên mạch chính – vị trí nguyên tử C đầu tiên mang liên kết đôi – “en”.
v Đối với anken mạch có nhánh :
· Cách gọi : số chỉ vị trí nhánh - số lượng nhánh (2 : đi ; 3 : tri ; 4 : tetra ; 5 : penta,…) + tên mạch chính – vị trí nguyên tử C đầu tiên mang liên kết đôi – “en”.
- Riêng C2H4 : eten ; C3H6 : propen.
Ví dụ :
v Đồng phân của C4H8 :
; (cách đánh số sai)
(#) ;
v Đồng phân của C5H10 :
; (#)
;
v Đồng phân của C6H12:
(#) (#)
(#)
(#)
Những chất có dấu (#) là các chất có đồng phân hình học.
II. TÍNH CHẤT VẬT LÍ :
- Ở điều kiện thường, các anken C2H4 , C3H6 và C4H8 là chất khí, từ C5 → C18 : chất lỏng, từ C19 trở đi : chất rắn.
- t0nc , t0s, khối lượng riêng của các anken tăng dần theo chiều tăng của phân tử khối.
- Các anken đều nhẹ hơn nước (d < 1g/cm3) và không tan trong nước.
III. TÍNH CHẤT HÓA HỌC :
Liên kết đôi C=C gồm 1 liên kết σ và 1 liên kết π. Liên kết π kém bền hơn liên kết σ nên dễ bị cắt hơn, gây nên tính chất hóa học đặc trưng của anken : dễ dàng tham gia phản ứng cộng tạo thành hợp chất no tương ứng.
1. Phản ứng cộng :
a. Cộng hiđro : CnH2n + H2 CnH2n+2 (ankan)
Ví dụ : CH3 – CH = CH2 + H2 CH3 – CH2 – CH3
- Đặc điểm của phản ứng cộng H2 vào anken:
+ Tỉ khối của hỗn hợp khí sau phản ứng bao giờ cũng tăng (do số mol khí giảm còn khối lượng thì không đổi)
+ . Chú ý áp dụng bảo toàn khối lượng, bảo toàn H, bảo toàn C.
b. Cộng brom : CnH2n + Br2 (dd) → CnH2nBr2
Ví dụ : CH3 – CH = CH2 + Br2 → CH3 – CHBr – CH2Br
Hiện tượng : màu nâu đỏ của dd Brom nhạt dần phản ứng dùng để phân biệt anken và ankan.
- Cho anken qua dung dịch brom thì khối lượng bình đựng nước brom tăng là khối lượng của các anken đã bị giữ lại trong bình, thể tích khí giảm là thể tích anken đã phản ứng với dung dịch brom. Nếu dung dịch brom mất màu thì brom hết, nếu dung dịch brom nhạt màu thì anken hết.
c. Cộng HX (X là OH, Cl, Br, HSO4, …) : CnH2n + HX → CnH2n+1X
+ Đối với anken mạch đối xứng :
Ví dụ : CH2 = CH2 + H – OH CH3 – CH2 – OH
CH2 = CH2 + H – Br → CH3 – CH2 – Br
+ Đối với anken mạch bất đối xứng :
- Phản ứng cộng HX vào anken bất đối tạo ra hỗn hợp 2 sản phẩm. (“giàu giàu thêm”)
- Sản phẩm chính của phản ứng cộng được xác định theo quy tắc cộng Maccopnhicop: H cộng vào C ở liên kết đôi có nhiều H hơn còn X vào C có ít H hơn.
v Quy tắc cộng Maccopnhicop (1838 – 1904) : Trong phản ứng cộng HX vài liên kết đôi, nguyên tử H (hay phần mang điện dương) chủ yếu cộng vào nguyên tử cacbon bậc thấp hơn (có nhiều H hơn), còn nguyên tử hay nhóm nguyên tử X (phần mang điện âm) cộng vào nguyên tử cacbon bậc cao hơn (có ít H hơn).
Ví dụ :
2. Phản ứng trùng hợp :
Ở nhiệt độ cao, áo suất cao và có chất xúc tác thích hợp, các phân tử anken có thể kết hợp với nhau tạo thành những phân tử có mạch rất dài và phân tử khối lớn.
Phản ứng trùng hợp (thuộc loại phản ứng polime hóa) là quá trình kết hợp liên tiếp nhiều phân tử nhỏ giống nhau hoặc tương tự nhau tạo thành những phân tử rất lớn (gọi là polime).
Ví dụ :
Chất đầu (C2H4) tham gia phản ứng trùng hợp được gọi là monome. Sản phẩm là polime. Phần trong dấu ngoặc được gọi là mắt xích polime ; n là hệ số trùng hợp, thường lấy giá trị trung bình.
3. Phản ứng oxi hóa :
a. Phản ứng oxi hóa hoàn toàn : CnH2n + O2 nCO2 + nH2O ( ; )
b. Phản ứng oxi hóa không hoàn toàn :
3CnH2n + 2KMnO4 + 4H2O → 3CnH2n(OH)2 + 2KOH + 2MnO2 ↓
Ví dụ : 3C2H4 + 2KMnO4 + 4H2O → 3C2H4(OH)2 + 2KOH + 2MnO2 ↓
→ anken làm mất màu dd thuốc tím nên có thể dùng dd thuốc tím để nhận biết anken.
- Riêng CH2=CH2 còn có phản ứng oxi hóa không hoàn toàn tạo CH3CHO.
CH2=CH2 + ½ O2 CH3CHO
IV. ĐIỀU CHẾ :
1. Trong phòng thí nghiệm :
- Tách nước từ ancol no, đơn chức mạch hở: CnH2n+1OH CnH2n + H2O
Ví dụ : C2H5OH CH2 = CH2 + H2O
2. Trong công nghiệp :
Tách H2 từ ankan: CnH2n+2 CnH2n + H2
ANKAĐIEN (ĐIOLEFIN)
I. ĐỊNH NGHĨA VÀ PHÂN LOẠI :
1. Định nghĩa : Ankađien là hiđrocacbon không no mạch hở có 2 liên kết đôi C=C trong phân tử (có 2 liên kết π).
Thí dụ : CH2=C=CH2 : propanđien (anlen) ; CH2=C=CH–CH3 : buta – 1,2 – đien
CH2=CH–CH=CH2 : buta – 1,3 – đien ;
Công thức phân tử chung của các ankađien là CnH2n-2 (n ≥ 3)
2. Phân loại :
Dựa vào vị trí tương đối giữa 2 liên kết đôi, có thể chia ankađien thành 3 loại :
· Ankađien có hai liên kết đôi cạnh nhau (kém bền)
Thí dụ : CH2=C=CH2 : anlen ; CH2=C=CH–CH3 : buta – 1,2 – đien
· Ankađien có hai liên kết đôi cách nhau 1 liên kết đơn được gọi là ankađien liên hợp.
Thí dụ : CH2=CH–CH=CH2 : buta – 1,3 – đien (đivinyl)
· Ankađien có hai liên kết đôi cách nhau từ hai liên kết đơn trở lên.
Thí dụ : CH2=CH-CH2-CH=CH2 : penta – 1,4 – đien.
Các ankađien liên hợp như buta – 1,3 – đien CH2=CH–CH=CH2 và isopen có nhiều ứng dụng thực tế.
II. TÍNH CHẤT VẬT LÍ : C3 và C4 là chất khí, từ C5 → C16 là chất lỏng, từ C17 trở lên là chất rắn ; các ankađien không tan trong nước, tan nhiều trong dung môi hữu cơ.
III. TÍNH CHẤT HÓA HỌC :
- Tương tự anken, buta – 1,3 – đien và isopen có thể tham gia phản ứng cộng với hiđro (xúc tác Ni), halogen và hiđro halogenua.
- Tùy theo điều kiện (tỉ lệ số mol giữa các chất và nhiệt độ), phản ứng cộng với halogen và hiđro halogenua có thể xảy ra tại một trong hai liên kết đôi (cộng 1,2) hoặc cộng vào hai đầu ngoài của hai liên kết đôi (cộng 1,4) hoặc cộng đồng thời vào hai liên kết đôi.
1. Cộng H2 :
a. Cộng tỉ lệ 1 : 1
- Cộng vị trí 1,2 : thường xảy ra ở nhiệt độ thấp khoảng -800C , phản ứng này chỉ tác động đến 1 liên kết đôi C=C, liên kết còn lại giữ nguyên.
CH2=CH–CH=CH2 + H2 CH3–CH2–CH=CH2
- Cộng ví trí 1,4 : thường xảy ra ở nhiệt độ cao hơn khoảng 400C , phản ứng này tác động đến cả 2 liên kết đôi và tạo ra 1 liên kết đôi C=C mới nằm giữa 2 liên kết đôi ban đầu.
CH2=CH–CH=CH2 + H2 CH3–CH=CH–CH3
· Isopren cho 3 sản phẩm :
b. Cộng tỉ lệ 1 : 2
CH2=CH-CH=CH2 + 2H2 CH3-CH2-CH2-CH3
2. Cộng brom :
a. Cộng tỉ lệ 1 : 1
- Cộng vị trí 1,2 :
CH2 = CH – CH – CH2 + Br2 (dd) (sản phẩm chính)
- Cộng vị trí 1,4 :
CH2 = CH – CH – CH2 + Br2 (dd) (sản phẩm chính)
· Isopren cho 3 sản phẩm :
b. Cộng tỉ lệ 1 : 2
CH2 = CH – CH – CH2 + 2Br2 → CH2Br – CHBr – CHBr – CH2Br
CH2 = C(CH3) – CH = CH2 + 2Br2 → CH2Br – CBr(CH3) – CHBr – CH2Br
3. Cộng hiđro halogenua :
Cộng tỉ lệ 1:1
- Cộng vị trí 1,2 : CH2 = CH – CH = CH2 + HBr (sản phẩm chính)
- Cộng vị trí 1,4 : CH2 = CH – CH = CH2 + HBr CH3 – CH = CH – CH2Br (sản phẩm chính)
· Isopren cho 2 sản phẩm chính (theo Maccopnhicop)
4. Phản ứng trùng hợp :
Các phản ứng trùng hợp chủ yếu xảy ra theo kiểu 1,4.
nCH2=CH-CH=CH2 (-CH2-CH=CH-CH2-)n
(Cao su buna, polibutađien)
nCH2=C(CH3)-CH=CH2 (-CH2-C(CH3)=CH-CH2-)n
(Cao su isopren)
5. Phản ứng oxi hóa :
a. Oxi hóa hoàn toàn : CnH2n-2 + O2 nCO2 + (n - 1)H2O
Đặc điểm phản ứng cháy : ;
b. Oxi hóa không hoàn toàn :
Ankađien cũng làm mất màu dung dịch thuốc tím ở ngay nhiệt độ thường.
· Nhận biết ankađien : Thuốc thử là dung dịch Brom hoặc dung dịch KMnO4. Hiện tượng là dung dịch bị mất màu (hoặc nhạt màu) .
IV. ĐIỀU CHẾ :
· Tách H2 từ ankan tương ứng
CH3-CH2-CH2-CH3 CH2=CH-CH=CH2 + 2H2
CH3-CH(CH3)-CH2-CH3 CH2=C(CH3)-CH=CH2 + 2H2
V. ỨNG DỤNG :
Nhờ phản ứng trùng hợp, từ buta – 1,3 – đien hoặc từ isopren có thể điều chế được polibutađien hoặc poliisopren là những chất có tính đàn hồi cao được dùng để sản xuất cao su (cao su buna, cao su isopren,…). Cao su buna được dùng làm lốp xe, nhựa trám thuyền,…
BÀI 32 : ANKIN
I. ĐỊNH NGHĨA, ĐỒNG ĐẲNG, ĐỒNG PHÂN, DANH PHÁP :
1. Định nghĩa : Ankin là hiđrocacbon không no, mạch hở trong phân tử có một liên kết ba C≡C (hay có hai liên kết π).
2. Công thức chung : CnH2n-2 (n ≥ 2) .
3. Đồng phân và danh pháp :
- Hai chất đầu dãy C2H2 , C3H4 không có đồng phân ankin. Các ankin từ C4H6 trở lên có đồng phân vị trí của liên kết ba, từ C5H8 còn có đồng phân mạch cacbon (tương tự anken).
- Tên thông thường : “Tên gốc ankyl liên kết với nguyên tử C mang nối ba + axetilen”. Các gốc ankyl được gọi theo thứ tự chữ cái đầu tiên tên gọi của chúng.
- Tên thay thế :
+ Được xuất phát từ ankan có cùng mạch cacbon bằng cách đổi đuôi –an thành –in.
+ Từ C4H6 trở đi cần thêm số chỉ vị trí nguyên tử cacbon bắt đầu liên kết ba. Mạch cacbon được đánh số gần liên kết ba hơn.
“Số chỉ vị trí nhánh + số lượng nhánh (2: đi, 3: tri, 4: tetra, 5: penta,…) + tên mạch chính – số chỉ vị trí liên kết ba + in”.
|
CTPT |
CTCT |
Tên thông thường |
Tên thay thế |
|
C2H2 |
CH≡CH |
axetilen |
etin |
|
C3H4 |
CH≡C – CH3 |
metyl axetilen |
propin |
|
C4H6 |
CH≡C – CH2 – CH3 |
etyl axetilen |
but – 1 – in |
|
CH3 – CH≡CH – CH3 |
đimetyl axetilen |
but – 2 – in |
|
|
C5H8 |
CH≡C – CH2 – CH2 – CH3 |
propyl axetilen |
pent – 1- in |
|
CH3 – C≡C – CH2 – CH3 |
etyl metyl axetilen |
pent – 2 – in |
|
|
|
isopropyl axetilen |
3 – metylbut – 1 – in |
|
|
C6H10 |
CH≡C – CH2 – CH2 – CH2 – CH3 |
n-butyl axetilen |
hex – 1 – in |
|
|
sec – butyl axetilen |
3 – metylpent – 1 – in |
|
|
|
isobutyl axetilen |
4 – metylpent – 1 – in |
|
|
|
tert – butyl axetilen |
3,3 – đimetylbut – 1 – in |
|
|
CH3 - C≡C – CH2 – CH2 – CH3 |
metyl propyl axetlien |
hex – 2 – in |
|
|
|
isopropyl metyl axetilen |
4 – metylpent – 2 – in |
|
|
CH3 – CH2 - C≡C – CH2 – CH3 |
đietyl axetilen |
hex – 3 – in |
II. TÍNH CHẤT VẬT LÍ :
- Ở điều kiện thường, từ C2 → C4 là chất khí, từ C5 → C16 là chất lỏng, từ C17 trở lên : chất rắn.
- Nhẹ hơn nước, rất ít tan trong nước, tan được trong một số dung môi hữu cơ.
- Nhiệt độ sôi tăng dần theo chiều tăng của phân tử khối. Các ankin có nhiệt độ sôi cao hơn và khối lượng riêng lớn hơn các anken tương ứng.
III. TÍNH CHẤT HÓA HỌC :
Liên kết ba trong phân tử ankin gồm 1 liên kết σ và 2 liên kết π kém bền hơn, do đó, các ankin dễ dàng tham gia phản ứng cộng. Ngoài ra, các ankin có liên kết ở đầu mạch (dạng R - C≡CH gọi là ank – 1 – in) còn có phản ứng thế nguyên tử H (gắn với C mang liên kết ba) bằng nguyên tử kim loại.
1. Phản ứng cộng :
a. Cộng hiđro :
- Khi có mặt Ni làm xúc tác, ankin cộng hiđro tạo thành anken, sau đó tạo thành ankan.
Thí dụ : CH≡CH + H2 CH2 = CH2
CH2 = CH2 + H2 CH3 – CH3
- Khi dùng xúc tác là hỗn hợp Pd/PbCO3 hoặc Pd/BaSO4, ankin chỉ cộng 1 phân tử hiđro tạo thành anken.
Ví dụ : CH≡CH + H2 CH2 = CH2
Đặc tính này được dùng để điều chế anken từ ankin.
Chú ý : CH2 = CH - C≡CH + H2 CH2 = CH – CH = CH2
Vinylaxetilen đivinyl
b. Cộng halogen (Br2/CCl4, Cl2) :
Brom và clo cũng tác dụng với ankin theo hai giai đoạn liên tiếp.
Ví dụ : CH≡CH + Br2 (dd) → CHBr = CHBr
CHBr = CHBr + Br2 (dd) → CHBr2 – CHBr2
c. Cộng HX (X là OH, Cl, Br, CH3COO … ) :
Ankin tác dụng với HX theo hai giai đoạn liên tiếp.
Thí dụ : CH≡CH + HCl CH2 = CHCl
CH2 = CHCl + HCl CH3 – CHCl2
Khi có mặt xúc tác thích hợp, ankin tác dụng với HCl sinh ra dẫn xuất monoclo của anken.
Thí dụ : CH≡CH + HCl CH2 = CHCl (vinyl clorua)
Phản ứng cộng HX của các ankin cũng tuân theo quy tắc Maccopnhicop.
Thí dụ :
Phản ứng cộng H2O của các ankin chỉ xảy ra theo tỉ lệ số mol 1 : 1
+ C2H2 → anđehit.
CH≡CH + H2O [CH2 = CH – OH] → CH3 – CHO
(không bền) anđehit axetic
+ Ankin khác → xeton.
CH≡C - CH3 + H2O CH3 – CO - CH3
d. Phản ứng trùng hợp :
- Đime hóa : 2CH≡CH CH≡C-CH=CH2 (vinyl axetilen)
- Trime hóa : 3CH≡CH C6H6 (benzen)
Về hình thức, đây cũng là phản ứng cộng HX vào liên kết ba, với HX là H – C≡CH.
2. Phản ứng thế bằng ion kim loại : hiện tượng tạo kết tủa màu vàng nhạt.
CH≡CH + 2AgNO3 + 2NH3 → Ag - C≡C – Ag ↓ + 2NH4NO3
CnH2n-2 + AgNO3 + NH3 → CnH2n-3Ag ↓ + NH4NO3 (n ≥ 3)
Ví dụ : C3H4 + AgNO3 + NH3 → C3H3Ag ↓ + NH4NO3
Nhận xét : Nguyên tử H liên kết trực tiếp với nguyên tử C liên kết ba đầu mạch có tính linh hoạt cao hơn các nguyên tử H khác nên có thể bị thay thế bằng ion kim loại.
phản ứng dùng để phân biệt ank – 1 – in với anken và các ankin khác.
3. Phản ứng oxi hóa :
a. Phản ứng oxi hóa hoàn toàn (cháy) :
CnH2n-2 + O2 nCO2 + (n - 1)H2O
→ Đặc điểm phản ứng cháy : ;
b. Phản ứng oxi hóa không hoàn toàn : Tương tự anken và ankađien, ankin cũng có khả năng làm mất màu dd thuốc tím ở điều kiện thường.
IV. ĐIỀU CHẾ :
Trong phòng thí nghiệm và trước đây cả trong công nghiêp, axetilen được điều chế bằng cách cho canxi cacbua CaC2 (đất đèn) tác dụng với nước :
CaC2 + 2H2O → Ca(OH)2 + C2H2
Ngày nay trong công nghiệp, axetilen được sản xuất chủ yếu từ metan :
2CH4 C2H2 + 3H2
BENZEN VÀ ĐỒNG ĐẲNG.
STIREN
Hiđrocacbon thơm là những hiđrocacbon trong phân tử có 1 hay nhiều vòng benzen. Các hiđrocacbon thơm được chia thành :
- Hiđrocacbon thơm có 1 vòng benzen trong phân tử, thí dụ :
- Hiđrocacbon có nhiều vòng benzen trong phân tử, thí dụ :
A. BENZEN VÀ ĐỒNG ĐẲNG :
I. ĐỊNH NGHĨA, ĐỒNG ĐẲNG, ĐỒNG PHÂN, DANH PHÁP, CẤU TẠO :
1. Định nghĩa : Ankyl benzen hay Aren là những hiđrocacbon thơm, trong phân tử chứa 1 nhân thơm benzen.
2. Dãy đồng đẳng : Công thức chung CnH2n-6 (n ≥ 6)
3. Đồng phân, danh pháp :
- Hai chất đầu dãy C6H6 (benzen) và C7H8 (toluen) không có đồng phân hiđrocacbon thơm. Từ C8H10 trở đi có các loại đồng phân : Đồng phân vị trí nhóm ankyl trong vòng benzen và đồng mạch cacbon của nhánh.
- Danh pháp thay thế (tên hệ thống) :
+ Đánh số thứ tự C theo vòng bắt đầu từ phía có nhóm thế, sao cho tổng các số chỉ vị trí các nhóm thế là nhỏ nhất.
+ Nếu chỉ có 2 nhóm thế thì có thể dùng các tiền tố ortho- , meta- và para- (viết tắt o- , m- và p-) thay cho 1,2- ; 1,3- và 1,4- .
+ Tên các nhánh được đọc theo thứ tự a,b,c (chữ cái La Tinh).
“Vị trí nhánh + số lượng nhánh + tên nhánh + benzen”
- Tên thông thường : không có quy luật gọi.
Tên của một số hiđrocacbon thơm đầu dãy
|
CTPT |
CTCT |
Tên thông thường |
Tên thay thế |
|
C6H6 |
|
Benzen |
Benzen |
|
C7H8 |
|
Toluen |
Metyl benzen |
|
C8H10 |
|
|
Etylbenzen |
|
|
o – xilen |
1,2 – đimetylbenzen (o – đimetylbenzen) |
|
|
|
m – xilen |
1,3 – đimetylbenzen (m – đimetylbenzen) |
|
|
|
p – xilen |
1,4 – đimetylbenzen (p – đimetylbenzen) |
|
|
C9H12 |
|
|
propylbenzen |
|
|
cumen |
isopropylbenzen |
|
|
|
|
1 – etyl – 2 – metylbenzen (o – etylmetylbenzen) |
|
|
|
|
1 – etyl – 3 – metylbenzen (m – etylmetylbenzen) |
|
|
|
|
1 – etyl – 4 – metylbenzen (p – etylmetylbenzen) |
|
|
|
|
1,2,3 – trimetylbenzen |
|
|
|
|
1,2,4 – trimetylbenzen |
|
|
|
|
1,3,5 – trimetylbenzen |
4. Cấu tạo :
Phân tử benzen có cấu trúc phẳng và có hình lục giác đều. Cả 6 nguyên tử cacbon và 6 nguyên tử hiđro cùng nằm trên một mặt phẳng.
Để thể hiện cấu tạo của benzen, ta dùng 1 trong 2 CTCT sau :
hoặc
II. TÍNH CHẤT VẬT LÍ :
- Benzen là chất lỏng không màu, linh động, có mùi đặc trưng, t0s = 800C, nhẹ hơn nước, không tan trong nước, tan nhiều trong một số dung môi hữu cơ. Nó là dung môi tốt cho nhiều chất I2, S, P, chất béo,…
- Các hiđrocacbon thơm đều là chất lỏng hoặc rắn ở điều kiện thường, chúng có nhiệt độ sôi tăng theo chiều tăng của phân tử khối.
- Các hiđrocacbon thơm ở thể lỏng không màu, linh động, có mùi đặc trưng, không tan trong nước và nhẹ hơn nước, có khả năng hòa tan nhiều chất hữu cơ.
III. TÍNH CHẤT HÓA HỌC :
- Tính chất của nhân benzen (tính thơm) : dễ thế, khó cộng, bền vững với các tác nhân oxi hóa.
- Tính chất của mạch nhánh (tính no) : phản ứng thế vào nhánh, oxi hóa nhánh,…
1. Phản ứng thế :
Ø Quy tắc thế vào vòng benzen :
o Nếu trên nhân benzen có sẵn nhóm thế đẩy điện tử (nhóm thế loại I) như : -R (gốc ankyl), -NH2, -OH, -OCH3,… thì phản ứng ưu tiên xảy ra ở vị trí ortho và para, và xảy ra dễ dàng hơn benzen.
o Nếu trên nhân benzen có sẵn nhóm thế hút điện tử (nhóm thế loại II) như : -NO2, -SO3H, -COOH, -CHO,… thì phản ứng thế xảy ra ưu tiên ở vị trí meta, và xảy ra khó hơn benzen.
a. Thế nguyên tử H của vòng benzen :
· Phản ứng halogen hóa :
Benzen không phản ứng với brom (dd) ở điều kiện thường.
Ø Phản ứng nitro hóa :
Phản ứng tiếp diễn tạo ra trinitro toluen (thuốc nổ TNT)
b. Thế nguyên tử H của mạch nhánh :
Nếu đun toluen hoặc các ankylbenzen với brom, sẽ xảy ra phản ứng thế nguyên tử H của mạch nhánh tương tự ankan.
2. Phản ứng cộng :
a. Cộng hiđro :
R là các gốc ankyl (CH3- ,…). Nếu R là các nhóm chức –NH2, -OH, -O- , -COOH, -COOR,… thì không tham gia phản ứng cộng hiđro nhưng R là –CHO thì vẫn tham gia phản ứng.
b. Cộng clo :
Trước đây, phản ứng này được dùng để sản xuất thuốc trừ sâu 666 , nhưng do chất này có độc tính cao và phân hủy chậm nên ngày nay ngày nay không được sử dụng.
3. Phản ứng oxi hóa :
a. Phản ứng oxi hóa không hoàn toàn :
- Benzen không làm mất màu dung dịch thuốc tím ở bất kì điều kiện nào.
- Toluen cũng như các ankylbenzen khác, làm mất màu dung dịch thuốc tím khi đun nóng (phản ứng xảy ra ở gốc ankyl), tạo kết tủa mangan đioxit.
C6H5CH3 + 2KMnO4 C6H5COOK + 2MnO2 + KOH + H2O
b. Phản ứng oxi hóa hoàn toàn :
CnH2n-6 + O2 nCO2 + (n – 3)H2O
* Đặc điểm của phản ứng đốt cháy benzen và đồng đẳng: ;
B. STIREN
- Công thức phân tử C8H8.
- Công thức cấu tạo: C6H5-CH=CH2.
- Stiren (còn gọi là vinylbenzen) là chất lỏng không màu, sôi ở 1460C, không tan trong nước nhưng tan nhiều trong dung môi hữu cơ.
Ø Tính chất hóa học :
Phân tử stiren được cấu tạo từ 2 phần: vòng benzen và nhánh vinyl (nhóm thế loại II) → tính chất hóa học của stiren được biểu hiện cả ở vòng benzen (phản ứng thế H vào vòng benzen) và nhánh (phản ứng cộng : H2, HBr, HI, Br2,... và làm mất màu dd KMnO4 ở điều kiện thường).
a. Phản ứng thế vào vòng benzen : Ưu tiên thế vào vị trí meta.
b. Phản ứng cộng :
c. Phản ứng trùng hợp :
d. Phản ứng oxi hóa không hoàn toàn :
- Stiren làm mất màu dung dịch thuốc tím ở nhiệt độ thường:
3C6H5CH=CH2 + 2KMnO4 + 4H2O → 3C6H5-CHOH-CH2OH + 2KOH + 2MnO2
- Stiren làm mất màu dung dịch thuốc tím ở nhiệt độ cao:
3C6H5-CH=CH2 + 10KMnO4 → 3C6H5COOK + 3K2CO3 + KOH + 10MnO2 + 4H2O
ANCOL
I. ĐỊNH NGHĨA, PHÂN LOẠI :
1. Định nghĩa : Ancol (hay rượu) là những HCHC có nhóm hiđroxyl –OH liên kết trực tiếp với nguyên tử cacbon no(*).
(*) Nguyên tử cacbon no là nguyên tử cacbon chỉ tạo liên kết đơn với các nguyên tử cacbon khác.
2. Phân loại :
- Dựa vào đặc điểm gốc hiđrocacbon : Ancol no, Ancol không no (mạch hở, mạch vòng) và ancol thơm (phân tử có vòng benzen) .
- Dựa vào số nhóm –OH trong phân tử : Ancol đơn chức và Ancol đa chức.
- Dựa vào bậc ancol : ancol bậc I, ancol bậc II, ancol bậc III (bậc ancol được tính bằng bậc của nguyên tử cacbon no liên kết với nhóm –OH).
a. Công thức chung của ancol bất kì :
R(OH)n hay CnH2n+2-2a-x(OH)x (x ≤ n) , a : số liên kết π và số vòng.
b. Ancol no, đơn chức, mạch hở (ankanol) :
Phân tử có 1 nhóm –OH liên kết với gốc ankyl : CnH2n+1OH (n ≥ 1)
Ví dụ : CH3OH , C2H5OH ,…
c. Ancol không no (1 nối đôi C=C), đơn chức, mạch hở (ankenol) :
Phân tử có 1 nhóm –OH liên kết với nguyên tử cacbon no của gốc hiđrocacbon không no : CnH2n-1OH (n ≥ 3)
Ví dụ : CH2 = CH – CH2 – OH , CH3 – CH = CH – CH2 – OH , …
d. Ancol thơm, đơn chức (có 1 nhân benzen) :
Phân tử có nhóm –OH liên kết với nguyên tử cacbon no thuộc mạch nhánh của vòng benzen : CnH2n-7OH (n ≥ 7)
Ví dụ : (ancol benzylic)
e. Ancol no, đa chức, mạch hở :
Phân tử có 2 hay nhiều nhóm –OH ancol : CnH2n+2-m(OH)m (n, m ≥ 2, nguyên)
Ví dụ : ;
Sau đây chỉ xét ancol no, đơn chức, mạch hở.
II. ĐỒNG PHÂN, DANH PHÁP :
1. Đồng phân :
- Đồng phân mạch cacbon (mạch có nhánh, mạch không nhánh)
- Đồng phân vị trí nhóm chức –OH.
- Từ C3H8O trở đi, bắt đầu xuất hiện đồng phân ancol.
2. Danh pháp :
a. Tên thông thường :
Một số ít ancol có tên thông thường. Tên thông thường của ancol được cấu tạo như sau :
“Ancol + tên gốc ankyl + ic”
b. Tên thay thế (tên hệ thống) :
- Chọn mạch chính là mạch C chứa nhóm –OH, dài nhất và có nhiều nhánh nhất.
- Đánh số thứ tự C mạch chính bắt đầu từ phía gần nhóm –OH.
“số chỉ vị trí nhánh + số lượng nhánh (2: đi, 3 : tri, 4 : tetra, 5 : penta,…) + tên mạch chính + số chỉ vị trí nhóm –OH + ol”
- Ưu tiên nhóm –OH trước nối đôi, nối ba, mạch nhánh.
Ví dụ :
BẢNG : ĐỒNG PHÂN VÀ TÊN GỌI MỘT SỐ ANCOL THƯỜNG GẶP
|
CTPT |
CTCT |
Tên thông thường |
Tên thay thế |
|
CH4O |
CH3OH |
ancol metylic |
metanol |
|
C2H6O |
CH3CH2OH |
ancol etylic |
etanol |
|
C3H8O |
CH3CH2CH2OH |
ancol propylic |
propan – 1 – ol |
|
|
ancol isopropylic |
propan – 2 – ol |
|
|
C4H10O |
CH3CH2CH2CH2OH |
ancol butylic |
butan – 1 – ol |
|
|
ancol isobutylic |
2 – metylpropan – 1 – ol |
|
|
|
ancol sec – butylic |
butan – 2 – ol |
|
|
|
ancol tert – butylic |
2 – metylpropan – 2 – ol |
|
|
C5H12O |
CH3CH2CH2CH2CH2OH |
|
pentan – 1 – ol |
|
|
|
pentan – 2 – ol |
|
|
|
|
pentan – 3 – ol |
|
|
|
ancol isoamylic |
3 – metylbutan – 1 – ol |
|
|
|
|
2 – metylbutan – 1 – ol |
|
|
|
|
3 – metylbutan – 2 – ol |
|
|
|
|
2 – metylbutan – 2 – ol |
|
|
|
|
2,2 – đimetylpropan – 1 – ol
|
Ø Các ancol xuất hiện thêm đồng phân ete :
|
CTPT |
CTCT |
|
C2H6O |
CH3OCH3 |
|
C3H8O |
CH3OCH2CH3 |
|
C4H10O |
CH3CH2OCH2CH3 |
|
CH3OCH2CH2CH3 |
|
|
|
|
CTPT |
CTCT |
|
C5H12O |
CH3OCH2CH2CH2CH3 |
|
CH3CH2OCH2CH2CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
- Từ C1 đến C12 là chất lỏng, từ C13 trở lên là chất rắn. C1 , C2 , C3 tan vô hạn trong nước.
- Khi phân tử khối tăng : Nhiệt độ sôi, khối lượng riêng của các ancol tăng ; độ tan trong nước giảm.
- Các ancol có nhiệt độ sôi cao hơn các hiđrocacbon có cùng phân tử khối hoặc đồng phân ete của nó là do giữa các phân tử ancol có liên kết hiđro(*)
Sở dĩ các ancol tan nhiều trong nước là do các phân tử ancol và các phân tử nước tạo được liên kết hiđro, trong khi đó các hiđrocacbon hoặc ete không có khả năng này.
(*) Liên kết hiđro là một loại liên kết yếu có bản chất tĩnh điện. Liên kết hiđro giữa các phân tử ancol được tạo ra giữa nguyên tử H của nhóm OH này và nguyên tử O của nhóm OH khác.
IV. TÍNH CHẤT HÓA HỌC :
Trong phân tử, liêm kết C OH, đặc biệt là liên kết O H phân cực mạnh, nên nhóm –OH, nhất là nguyên tử H dễ bị thay thế hoặc tách ra trong các phản ứng hóa học.
1. Phản ứng thế H của nhóm OH :
a. Tính chất chung của ancol :
Ø Phản ứng với kim loại kiềm :
R(OH)z + zNa → R(ONa)z + z/2H2
Ví dụ : CH3OH + Na → CH3ONa + ½ H2
C3H5(OH)3 + 3Na → C3H5(ONa)3 + 3/2 H2
R(ONa)z: Natri ancolat rất dễ bị thủy phân trong nước :
R(ONa)z + zH2O → R(OH)z + zNaOH
Ví dụ : CH3ONa + H2O → CH3OH + NaOH
Chú ý:
- Trong phản ứng của ancol với Na:
mbình Na tăng = mAncol - = nAncol.(MR + 16z).
mbình Ancol tăng = mNa - = nAncol.22z.
- Nếu cho dd ancol phản ứng với Na thì ngoài phản ứng của ancol còn có phản ứng của H2O với Na.
- Số nhóm chức Ancol =
b. Tính chất đặc trưng của glixerol :
Glixerol hòa tan được Cu(OH)2 ở nhiệt độ thường tạo dd đồng (II) glixerat màu xanh lam.
2C3H5(OH)3 + Cu(OH)2 → [C3H5(OH)2O]2Cu + 2H2O
Etylen glicol cũng hòa tan được Cu(OH)2 ở nhiệt độ thường tạo dd màu xanh lam tương tự glixerol :
2C2H4(OH)2 + Cu(OH)2 → [C2H4(OH)O]2Cu + 2H2O
Phản ứng này được dùng để phân biệt ancol đơn chức với ancol đa chức có các nhóm –OH cạnh nhau trong phân tử.
2. Phản ứng thế nhóm OH :
a. Với axit vô cơ HX :
ROH + HX RX + H2O
Ví dụ : C2H5OH + HBr C2H5Br + H2O
Phản ứng này chứng tỏ phân tử ancol có nhóm –OH.
b. Với axit hữu cơ (phản ứng este hóa) :
ROH + R’COOH R’COOR + H2O
Ví dụ : C2H5OH + CH3COOH CH3COOC2H5 + H2O
Chú ý: + Phản ứng được thực hiện trong môi trường axit và đun nóng.
+ Phản ứng có tính thuận nghịch nên chú ý đến chuyển dịch cân bằng.
c. Phản ứng với ancol (phản ứng ete hóa) :
C2H5 – OH + H – OC2H5 C2H5 – O – C2H5 + H2O
- Nếu có n ancol khác nhau sẽ tạo tối đa ete trong đó có n ete đối xứng.
- Nếu tách nước thu được các ete có số mol bằng nhau thì các ancol tham gia phản ứng cũng có số mol bằng nhau và nAncol = 2.nete = 2.nH2O và mAncol = mete + + mAncol dư.
3. Phản ứng tách nước (đề hiđrat hóa) :
Ø Tách nước từ 1 phân tử ancol tạo anken của ancol no, đơn chức, mạch hở.
CnH2n+1OH CnH2n + H2O
Điều kiện của ancol tham gia phản ứng: ancol có –OH đính với C còn H có khả năng tách nước.
Ví dụ : C2H5OH CH2 = CH2 + H2O
Tính chất này dùng để điều chế etilen trong phòng thí nghiệm.
Ø Quy tắc Zaixep : Nhóm –OH bị tách cùng H ở nguyên tử C có bậc cao hơn (nghèo nghèo thêm).
Ví dụ :
Chú ý:
- Nếu ancol no, đơn chức mạch hở không tách nước tạo anken thì Ancol đó là CH3OH hoặc ancol mà nguyên tử C liên kết với OH chỉ liên kết với C bậc 3 khác.
- Nếu một ancol tách nước tạo ra hỗn hợp nhiều anken thì đó là ancol bậc cao (bậc II, bậc III) và mạch C không đối xứng qua C liên kết với OH.
- Nhiều ancol tách nước tạo ra một anken thì xảy ra các khả năng sau:
+ Có ancol không tách nước.
+ Các ancol là đồng phân của nhau.
- Sản phẩm chính trong quá trình tách nước theo quy tắc Zaixep.
- Khi giải bài tập có liên quan đến phản ứng tách nước cần nhớ:
mAncol = manken + + mAncol dư
nancol phản ứng = nanken = nnước
- Các phản ứng tách nước đặc biệt :
CH2OH-CH2OH → CH3CHO + H2O
CH2OH-CHOH-CH2OH → CH2=CH-CHO + 2H2O
4. Phản ứng oxi hóa :
a. Oxi hóa hoàn toàn :
CnH2n+2O + O2 nCO2 + (n + 1)H2O
Chú ý:
- Phản ứng đốt cháy của ancol có đặc điểm tương tự phản ứng đốt cháy hiđrocacbon tương ứng.
+ Nếu đốt cháy ancol cho > → ancol đem đốt cháy là ancol no và nAncol = -
+ Nếu đốt cháy ancol cho > 1,5. → ancol là CH3OH. Chỉ có CH4 và CH3OH có tính chất này (không kể amin).
- Khi đốt cháy 1 hợp chất hữu cơ X thấy > → chất đó là ankan, ancol no mạch hở hoặc ete no mạch hở (cùng có công thức CnH2n+2Ox).
b. Oxi hóa không hoàn toàn (phản ứng với CuO hoặc O2 có xúc tác là Cu):
Hiện tượng : CuO đun nóng từ màu đen chuyển thành Cu màu đỏ.
- Ancol bậc I + CuO tạo anđehit :
RCH2OH + CuO RCHO + Cu + H2O
Ví dụ : CH3CH2OH + CuO CH3CHO + Cu + H2O
- Ancol bậc II + CuO tạo xeton :
R-CH(OH)-R’ + CuO RCOR’ + Cu + H2O
Ví dụ : CH3 – CH(OH) – CH3 + CuO CH3 – CO – CH3 + Cu + H2O
- Ancol bậc III không bị oxi hóa bằng CuO.
Chú ý: mchất rắn giảm = mCuO phản ứng - mCu tạo thành = 16.nAncol đơn chức.
5. Phản ứng riêng của một số loại ancol :
- Ancol etylic CH3CH2OH :
C2H5OH + O2 CH3COOH + H2O
2C2H5OH CH2=CH-CH=CH2 + 2H2O + H2
- Ancol không no có phản ứng như hiđrocacbon tương ứng ví dụ: alylic CH2 = CH - CH2OH
CH2=CH-CH2OH + H2 CH3-CH2-CH2OH
CH2=CH-CH2OH + Br2 → CH2Br-CHBr-CH2OH
3CH2=CH-CH2OH + 2KMnO4 + 4H2O → 3C3H5(OH)3 + 2KOH + 2MnO2
V. ĐIỀU CHẾ :
1. Cộng nước vào anken tạo ancol no, đơn chức, mạch hở :
CnH2n + H2O CnH2n+1OH
Phản ứng tuân theo quy tắc cộng Maccopnhicop nên nếu anken đối xứng thì phản ứng chỉ tạo thành 1 ancol.
2. Thủy phân este trong môi trường kiềm :
RCOOR’ + NaOH RCOONa + R’OH
3. Cộng H2 vào anđehit hoặc xeton :
RCHO + H2 RCH2OH
RCOR’ + H2 RCHOHR’
4. Phương pháp riêng điều chế CH3OH
CO + 2H2 CH3OH
2CH4 + O2 2CH3OH
5. Phương pháp điều chế C2H5OH
- Lên men tinh bột: (C6H10O5)n → C6H12O6 → C2H5OH
Các phản ứng cụ thể:
(C6H10O5)n + nH2O → nC6H12O6
C6H12O6 2C2H5OH + 2CO2
- Hiđrat hóa etilen, xúc tác axit H2SO4 đặc hoặc H3PO4, ở nhiệt độ cao :
C2H4 + H2O C2H5OH
Đây là các phương pháp điều chế ancol etylic trong công nghiệp.
PHENOL
I. ĐỊNH NGHĨA, PHÂN LOẠI :
1. Định nghĩa : Phenol là những hợp chất hữu cơ trong phân tử có nhóm –OH liên kết trực tiếp với nguyên tử cacbon của vòng benzen.
Nhóm –OH liên kết trực tiếp với nguyên tử cacbon của vòng benzen được gọi là –OH phenol.
Phenol đơn giản nhất là C6H5 – OH, phân tử gồm một nhóm –OH liên kết với gốc phenyl.
2. Phân biệt phenol và ancol thơm :
· Phenol : có nhóm –OH liên kết trực tiếp vào nhân benzen.
Ví dụ :
· Ancol thơm : có nhóm –OH liên kết với mạch nhánh của hiđrocacbon thơm.
Ví dụ :
II. PHENOL :
1. Cấu tạo : Phenol có công thức phân tử C6H6O và có công thức cấu tạo C6H5OH hoặc
2. Tính chất vật lí :
- Ở điều kiện thường, phenol C6H5OH là chất rắn, không màu, nóng chảy ở 430C. Để lâu, phenol chuyển thành màu hồng do bị oxi hóa chậm trong không khí.
- Tan ít trong nước lạnh, tan vô hạn trong nước nóng, tạo liên kết hiđro liên phân tử với nước và với nhau, tan tốt trong etanol, ete và axeton,…
- Phenol rất độc, khi tiếp xúc với da sẽ gây bỏng.
3. Tính chất hóa học : Phenol có phản ứng thế nguyên tử H của nhóm –OH và có tính chất của vòng benzen.
a. Phản ứng thế nguyên tử H của nhóm –OH :
· Tác dụng với kim loại kiềm :
2C6H5OH + 2K 2C6H5OK + H2 ↑
(Kali phenolat)
· Tác dụng với dung dịch bazơ :
Phenol hầu như không tan trong nước lạnh nhưng tan trong dd KOH theo phản ứng sau :
C6H5OH + KOH → C6H5OK + H2O
· Điều đó chứng tỏ phenol có tính axit. Tính axit của phenol rất yếu : dung dịch phenol (axit phenic) không làm đổi màu quỳ tím.
Chú ý : Phenol có tính axit yếu hơn axit cacbonic
C6H5OK + H2O + CO2 → C6H5OH ↓ + KHCO3
Phenol có phản ứng với K2CO3 nhưng không phản ứng với KHCO3
C6H5OH + K2CO3 → C6H5OK + KHCO3
Nhận xét : Vòng benzen đã làm tăng khả năng phản ứng của nguyên tử H thuộc nhóm –OH trong phân tử phenol so với trong phân tử ancol.
Ảnh hưởng của vòng benzen lên nhóm –OH.
b. Phản ứng thế nguyên tử H của vòng benzen :
- Phenol tác dụng với dung dịch brom cho kết tủa trắng :
- Phenol tác dụng với axit nitric trong axit sunfuric (phản ứng nitro hóa) cho kết tủa màu vàng.
Nhận xét :
Nguyên tử H của vòng benzen trong phân tử phenol dễ bị thay thế hơn nguyên tử H của vòng benzen trong phân tử các hiđrocacbon thơm. Đó là ảnh hưởng của nhóm –OH tới vòng benzen.
Ảnh hưởng của vòng benzen đến nhóm –OH và ảnh hưởng của nhóm –OH đến vòng benzen được gọi là ảnh hưởng qua lại giữa các nguyên tử trong phân tử.
4. Điều chế :
· Từ benzen :
C6H6 C6H5Cl C6H5ONa C6H5OH
Các phản ứng hóa học :
C6H6 + Cl2 C6H5Cl + HCl
C6H5Cl + NaOH đặc C6H5ONa + NaCl
C6H5ONa + HCl C6H5OH ↓ + NaHCO3
5. Ứng dụng :
Phenol là nguyên liệu sản xuất nhựa phenolfomanđehit (hay poliphenolfomanđehit) dùng để chế tạo các đồ dân dụng ; nhựa urefomanđehit dùng làm chất kết dính (như keo dán gỗ, dán kim loại, sành, sứ…).
Phenol còn dùng để sản xuất phẩm nhuộm, thuốc nổ (2,4,6-trinitrophenol), chất diệt cỏ 2,4-D, chất diệt nấm mốc.
ANĐEHIT
I. ĐỊNH NGHĨA, PHÂN LOẠI :
1. Định nghĩa : Anđehit là những hợp chất hữu cơ trong phân tử có nhóm –CH=O liên kết trực tiếp với nguyên tử cacbon (của gốc hiđrocacbon hay nhóm –CHO khác) hoặc nguyên tử hiđro.
Nhóm –CH=O gọi là nhóm chức anđehit.
2. Phân loại :
Dựa vào đặc điểm cấu tạo của gốc hiđrocacbon và số nhóm –CHO trong phân tử, người ta chia thành anđehit no, khôn no, thơm ; anđehit đơn chức, anđehit đa chức.
a. Công thức chung của anđehit bất kì :
R(CHO)n hay CxHy(CHO)n (n ≥ 1, nguyên)
b. Công thức chung của anđehit no đơn chức, mạch hở (ankanal) :
CnH2n+1CHO (n ≥ 0, nguyên) hay CmH2mO (m ≥ 1)
Ví dụ : HCHO , CH3CHO ,…
c. Công thức chung của anđehit không no (1 nối đôi C=C), đơn chức, mạch hở (ankenal) :
CnH2n-1CHO (n ≥ 2, nguyên ) hay CmH2m-2O (m ≥ 3)
Ví dụ : CH2=CH–CHO anđehit acrylat ,…
d. Công thức chung anđehit thơm (có 1 nhóm benzen) đơn chức :
CnH2n-7CHO (n ≥ 6, nguyên) hay CmH2m-8O (m ≥ 7)
3. Đồng phân, danh pháp :
· Tên thay thế : của các anđehit no, đơn chức, mạch hở được cấu tạo như sau :
+ Chọn mạch C chứa nhóm –CHO, dài nhất và có nhiều nhánh nhất, làm mạch chính.
+ Đánh số thứ tự C mạch chính bắt đầu từ nhóm –CHO.
“Số chỉ vị trí nhánh + số lượng nhánh + tên nhánh + tên hiđrocacbon no tương ứng với mạch chính + al”.
+ Ưu tiên nhóm –CHO trước nối đôi, nối ba, mạch nhánh.
Ví dụ : but – 2 – en – 1 – al (anđehit crotonic hay crotoanđehit)
· Tên thông thường : “anđehit + tên axit tương ứng”.
BẢNG : TÊN GỌI CỦA 1 SỐ ANĐEHIT NO, ĐƠN CHỨC, MẠCH HỞ THƯỜNG GẶP
|
CTPT |
CTCT |
Tên thay thế |
Tên thông thường |
|
CH2O |
HCHO |
metanal |
anđehit fomic (fomanđehit) |
|
C2H4O |
CH3CHO |
etanal |
anđehit axetic (axetanđehit) |
|
C3H6O |
CH3CH2CHO |
propanal |
anđehit propionic (propionanđehit) |
|
C4H8O |
CH3CH2CH2CHO |
butanal |
anđehit butiric (butiranđehit) |
|
|
2 – metylpropanal |
anđehit isobutiric (isobutiranđehit) |
|
|
C5H10O |
CH3CH2CH2CH2CHO |
pentanal |
anđehit valeric |
|
|
3 – metylbutanal |
anđehit isovaleric |
|
|
|
2 – metylbutanal |
|
|
|
|
2,2 – đimetylpropanal |
|
II. ĐẶC ĐIỂM CẤU TẠO, TÍNH CHẤT VẬT LÍ :
1. Đặc điểm cấu tạo :
Nhóm –CHO có cấu tạo như sau :
Trong nhóm –CHO, liên kết đôi C=O gồm một liên kết σ bền và một liên kết π kém bền hơn, tương tự liên kết đôi C=C trong phân tử anken, đo đó anđehit có một số tính chất giống anken.
2. Tính chất vật lí :
- Chỉ có HCHO, CH3CHO là chất khí, không màu, mùi cay xốc khó ngửi, tan rất tốt trong nước. Các anđehit tiếp theo là chất lỏng hoặc rắn, độ tan trong nước của chúng giảm dần theo chiều tăng của phân tử khối.
- Dung dịch nước của anđehit fomic được gọi là fomon. Dung dịch bão hòa của anđehit fomic (có nồng độ 37 – 40%) được gọi là fomalin.
III. TÍNH CHẤT HÓA HỌC :
1. Phản ứng cộng hiđro :
R(CHO)x + xH2 R(CH2OH)x
Ví dụ : CH3CHO + H2 CH3CH2OH
Chú ý: + Trong phản ứng của anđehit với H2 : Nếu gốc R có các liên kết pi thì H2 cộng vào cả các liên kết pi đó.
+ Phản ứng với H2 chứng tỏ anđehit có tính oxi hóa.
2. Phản ứng oxi hóa không hoàn toàn :
a. Tác dụng với AgNO3/NH3 (phản ứng tráng bạc) :
R(CHO)x + 2xAgNO3 + 3xNH3 + xH2O R(COONH4)x + xNH4NO3 + 2xAg
Vi dụ : CH3CHO + 2AgNO3 + 3NH3 + H2O CH3COONH4 + NH4NO3 + 2Ag
- Phản ứng được dùng để nhận biết anđehit.
- Riêng HCHO có phản ứng :
HCHO + 4AgNO3 + 6NH3 + 2H2O (NH4)2CO3 + 4NH4NO3 + 4Ag
Phản ứng trên được gọi là phản ứng tráng bạc do người ta dùng phương pháp này để tráng một lớp Ag trên bề mặt kính làm gương soi, tráng ruột phích,…
Chú ý:
- Phản ứng tổng quát ở trên áp dụng với anđehit không có nối ba nằm đầu mạch. Nếu có nối ba nằm ở đầu mạch thì H của C nối ba cũng bị thay thế bằng Ag.
- Các đặc điểm của phản ứng tráng gương của anđehit:
+ Nếu nAg = 2nanđehit → anđehit thuộc loại đơn chức và không phải HCHO.
+ Nếu nAg = 4nanđehit → anđehit đó thuộc loại 2 chức hoặc HCHO.
+ Nếu nAg > 2nhỗn hợp các anđehit đơn chức thì hỗn hợp đó có HCHO.
+ Số nhóm CHO = nAg/2nanđehit (nếu trong hỗn hợp không có HCHO).
- Một số loại chất khác cũng có khả năng tham gia phản ứng tráng gương gồm:
+ HCOOH và muối hoặc este của nó: HCOONa, HCOONH4, (HCOO)nR.
Các chất HCHO, HCOOH, HCOONH4 khi phản ứng chỉ tạo ra các chất vô cơ.
+ Các tạp chức có chứa nhóm chức CHO: glucozơ, fructozơ,…
b. Oxi hóa anđehit thành axit :
R(CHO)x + O2 R(COOH)x
Ví dụ : CH3CHO + ½ O2 CH3COOH
- Các phản ứng trên chứng minh anđehit có tính khử.
c. Phản ứng với dung dịch Br2 :
R(CHO)x + xBr2 + xH2O → R(COOH)x + 2xHBr
Ví dụ : CH3CHO + Br2 + H2O → CH3COOH + 2HBr
Nếu anđehit còn có liên kết pi ở gốc hiđrocacbon thì xảy ra đồng thời phản ứng cộng Br2 vào liên kết pi đó.
d. Phản ứng với dung dịch KMnO4 :
3RCHO + 2KMnO4 + H2O → 3RCOOH + 2MnO2 + 2KOH
e. Phản ứng với Cu(OH)2 ở nhiệt độ cao :
R(CHO)x + 2xCu(OH)2↓ R(COOH)x + xCu2O↓ + 2xH2O
xanh đỏ gạch
→ Phản ứng này được dùng để nhận biết anđehit.
Chú ý: Phản ứng với Cu(OH)2 thường được thực hiện trong môi trường kiềm nên có thể viết phản ứng dưới dạng:
R(CHO)x + 2xCu(OH)2 + xNaOH R(COONa)x + xCu2O↓ + 3xH2O
HCOOH, HCOOR, glucozơ, fructozơ, mantozơ cũng có phản ứng này.
Riêng anđehit fomic có phản ứng :
HCHO + 4Cu(OH)2 + 2NaOH Na2CO3 + Cu2O↓ + 6H2O
IV. ĐIỀU CHẾ :
1. Oxi hóa ancol bậc I :
R(CH2OH)x + xCuO R(CHO)x + xCu + xH2O
Ví dụ : CH3CH2OH + CuO CH3CHO + Cu + H2O
2. Từ hiđrocacbon và các chất khác :
2CH3OH + O2 2HCHO + 2H2O
CH4 + O2 HCHO + H2O
2CH2=CH2 + O2 2CH3CHO
C2H2 + H2O CH3CHO
V. ỨNG DỤNG :
- Fomanđehit được dùng làm nguyên liệu sản xuất nhựa phenolfomanđehit, nhựa urefomanđehit.
- Dung dịch nước của fomanđehit (fomon) được dùng làm chất tẩy uế, ngâm mẫu vật làm tiêu bản, dùng trong kĩ nghệ da giày do có tính sát trùng.
- Anđehit axetic được dùng để sản xuất axit axetic làm nguyên liệu cho nhiều ngành sản xuất.
- Nhiều anđehit có nguồn gốc thiên nhiên được dùng làm hương liệu trrong công nghiệp thực phẩm, mĩ phẩm như geranial (trong tinh dầu hoa hồng), xitrolenal (trong tinh dầu bạch đàn), vanilin, piperonal,…
AXIT CACBOXYLIC
I. ĐỊNH NGHĨA, PHÂN LOẠI :
1. Định nghĩa :
Axit cacboxylic là những hợp chất hữu cơ mà phân tử có nhóm cacboxyl (–COOH) liên kết trực tiếp với nguyên tử cacbon (có thể của gốc hiđrocacbon hoặc của nhóm –COOH khác) hoặc nguyên tử hiđro.
Nhóm cacboxyl (–COOH) là nhóm chức của axit cacboxylic.
2. Phân loại :
Dựa vào đặc điểm cấu tạo của gốc hiđrocacbon và số nhóm cacboxyl trong phân tử, các axit được chia thành :
a. Axit no, đơn chức, mạch hở :
CnH2n+1COOH (n ≥ 0) hoặc CmH2mO2 (m ≥ 1)
Ví dụ : HCOOH , CH3COOH , CH3[CH2]15COOH ,…
b. Axit không no, 1 nối đôi C=C, đơn chức, mạch hở :
CnH2n-1COOH (n ≥ 2) hoặc CmH2m-2O2 (m ≥ 3)
Ví dụ : CH2=CH–COOH ; CH3[CH2]7CH=CH[CH2]7COOH ; …
c. Axit thơm, đơn chức :
CnH2n-7COOH (n ≥ 6) hoặc CmH2m-8O2 (m ≥ 7)
Ví dụ : C6H5–COOH , CH3–C6H4–COOH ,…
d. Axit no, hai chức, mạch hở :
CnH2n(COOH)2 (n ≥ 0) hoặc CmH2m-2O4 (m ≥ 2)
Ví dụ : (COOH)2 , HOOC – CH2 – COOH ,…
II. ĐỒNG PHÂN, DANH PHÁP :
1. Axit no, đơn chức, mạch hở :
· Tên thay thế :
“Axit + số chỉ vị trí nhánh + số lượng nhánh (2 : đi, 3 : tri, 4 : tetra, 5 : penta,…) + tên mạch chính (tên ankan tương ứng) + oic”
- Mạch chính của phân tử axit là mạch cacbon dài nhất bắt đầu từ nhóm –COOH.
- Mạch cacbon được đánh số bắt đầu từ nguyên tử cacbon của nhóm –COOH
- Ưu tiên nhóm –COOH trước nối đôi, nối ba, mạch nhánh.
Ví dụ :
· Tên thông thường : xuất phát từ nguồn gốc tìm ra chúng.
BẢNG : TÊN GỌI 1 SỐ AXIT CACBOXYLIC NO, ĐƠN CHỨC, MẠCH HỞ.
|
CTPT |
CTCT |
Tên thay thế |
Tên thông thường |
|
CH2O2 |
HCOOH |
axit metanoic |
axit fomic |
|
C2H4O2 |
CH3COOH |
axit etanoic |
axit axetic |
|
C3H6O2 |
C2H5COOH |
axit propanoic |
axit propionic |
|
C4H8O2 |
CH3CH2CH2COOH |
axit butanoic |
axit bitiric |
|
|
axit – 2 – metylpropanoic |
axit isobutiric |
|
|
C5H10O2 |
CH3[CH2]3COOH |
axit pentanoic |
axit valeric |
|
|
axit 3 – metylbutanoic |
axit isovaleric |
|
|
|
axit 2 – metylbutanoic |
|
|
|
|
axit 2,2 – đimetylpropanoic |
|
BẢNG : MỘT SỐ AXIT THƯỜNG GẶP KHÁC
|
CTCT |
Tên thông thường |
|
CH2=CH-COOH |
Axit acrylic |
|
CH2=C(CH3)-COOH |
Axit metacrylic |
|
(COOH)2 |
axit oxalic |
|
C6H5COOH |
Axit benzoic |
|
C15H31COOH |
Axit pamitic |
|
C17H35COOH |
Axit stearic |
|
C17H33COOH |
Axit oleic |
|
C17H31COOH |
Axit linoleic |
II. ĐẶC ĐIỂM CẤU TẠO :
Nhóm cacboxyl có cấu tạo :
Như vậy, nhóm –COOH coi như được liên kết bởi nhóm C=O và nhóm OH. Liên kết O–H trong phân tử axit phân cực mạnh hơn liên kết O–H trong phân tử ancol, do đó nguyên tử H của nhóm –COOH linh động hơn nguyên tử H của nhóm –OH ancol. Liên kết của nhóm cacboxyl phân cực mạnh hơn liên kết ancol và phenol nên nhóm OH của axit cacboxylic cũng có thể bị thay thế.
III. TÍNH CHẤT VẬT LÍ :
- Các axit đều là chất lỏng hoặc rắn ở điều kiện thường. Nhiệt độ sôi của các axit tăng theo chiều tăng của phân tử khối và cao hơn nhiệt độ sôi của các ancol có cùng phân tử khối. Nguyên nhân là giữa các phân tử axit có liên kết hiđro bền hơn liên kết hiđro giữa các phân tử ancol.
- Axit fomic, axit axetic tan vô hạn trong nước. Độ tan trong nước của các axit giảm dần theo chiều tăng của phân tử khối.
- Mỗi axit có vị riêng : axit axetic có vị giấm ăn, axit oxalic có vị chua của me, …
IV. TÍNH CHẤT HÓA HỌC :
Axit cacboxylic dễ dàng tham gia các phản ứng thế hoặc trao đổi nguyên tử H hoặc nhóm –OH của nhóm chức –COOH.
1. Tính axit :
a. Trong dung dịch, axit cacboxylic phân li thuận nghịch :
- Phân tử axit có nhóm cacbonyl C=O là nhóm hút e mạnh nên làm giảm mật độ e tự do trên nguyên tử O làm cho liên kết O–H bị phân cực hơn → dễ bị phân li thành H+ thể hiện tính axit.
RCOOH RCOO- + H+
- Độ mạnh của axit phụ thuộc vào độ linh động của nguyên tử H và độ tan của axit trong dung môi nước.
- Nếu nhóm COOH gắn với nhóm đẩy e (gốc hiđrocacbon no) thì tính axit yếu hơn so với HCOOH. Gốc ankyl càng có nhiều nguyên tử H thì đẩy e càng mạnh làm cho tính axit càng giảm.
- Nếu nhóm COOH gắn với nhóm hút e (gốc hiđrocacbon không no, gốc có chứa nhóm NO2, halogen, OH…) thì tính axit mạnh hơn so với HCOOH. Càng nhiều gốc hút e thì tính axit càng mạnh. Gốc hút e càng mạnh thì tính axit càng mạnh, nhóm hút e nằm càng gần nhóm COOH thì làm cho tính axit của axit càng mạnh.
b. Các phản ứng thể hiện tính axit :
- Axit làm quỳ tím chuyển thành màu hồng.
- Tác dụng với bazơ → muối + H2O
CH3COOH + NaOH → CH3COONa + H2O
- Tác dụng với oxit bazơ → muối + H2O
2CH3COOH + ZnO → (CH3COO)2Zn + H2O
- Tác dụng với kim loại đứng trước H → muối + H2
2CH3COOH + Mg → (CH3COO)2Mg + H2
→ Phản ứng này có thể dùng để nhận biết axit.
- Tác dụng với muối của axit yếu hơn (muối cacbonat, phenolat, ancolat) → muối mới + axit mới.
2CH3COOH + CaCO3 → (CH3COO)2Ca + CO2 + H2O
CH3COOH + NaHCO3 → CH3COONa + CO2 + H2O
→ Thường dùng muối cacbonat hoặc hiđrocacbonat để nhận biết các axit.
2. Phản ứng thế nhóm –OH :
RCOOH + R’OH RCOOR’ + H2O
Ví dụ : CH3COOH + C2H5OH CH3COOC2H5 + H2O
Phản ứng giữa axit và ancol tạo thành este và nước được gọi là phản ứng este hóa.
Đặc điểm của phản ứng este hóa là thuận nghịch và cần axit H2SO4 đặc làm xúc tác.
3. Phản ứng oxi hóa hoàn toàn :
CxHyOz + O2 xCO2 + H2O
Nếu đốt cháy axit thu được thì axit thuộc loại no, đơn chức, mạch hở:
CnH2n+1COOH (n + 1)CO2 + (n + 1)H2O
Chú ý:
- HCOOH có phản ứng tương tự như anđehit:
HCOOH + 2AgNO3 + 4NH3 + H2O → 2NH4NO3 + (NH4)2CO3 + 2Ag
- Các axit không no còn có các tính chất của hiđrocacbon tương ứng:
CH2=CH-COOH + Br2 dung dịch → CH2Br-CHBr-COOH
3CH2=CH-COOH + 2KMnO4 + 4H2O → 3CH2OH-CHOH-COOH + 2MnO2 + 2KOH
Sản phẩm cộng của CH2 = CH - COOH với HX trái với Maccopnhicop
- Axit thơm có phản ứng thế vào vị trí meta.
- Axit no có phản ứng thế vào vị trí α.
V. ĐIỀU CHẾ :
1. Phương pháp lên men giấm :
C2H5OH + O2 CH3COOH + H2O
Đây là phương pháp cổ truyền sản xuất axit axetic. Ngày nay, phương pháp này chỉ dùng sản xuất lượng nhỏ axit axetic để làm giấm ăn.
2. Oxi hóa anđehit axetic : (điều chế từ etilen hoặc axetilen) trước đây là phương pháp chủ yếu để sản xuất axit axetic.
2CH3CHO + O2 2CH3COOH
3. Oxi hóa ankan :
Oxi hóa butan thu được axit axetic :
2CH3CH2CH2CH3 + 5O2 4CH3COOH + 2H2O
Oxi hóa không hoàn toàn các ankan có mạch cacbon dài để tổng hợp các axit có phân tử khối lớn :
2R–CH2–CH2–R1 + 5O2 2R – COOH + 2R1 – COOH + 2H2O
4. Từ metanol :
CH3OH + CO CH3COOH
Đây là phương pháp hiện đại sản xuất axit axetic.